Résumé
L’analyse des extraits méthanoliques de feuilles (folioles) du palmier dattier Phoenix dactylifera L., cultivar Takerbucht, par chromatographie en phase gazeuse couplée à la spectrométrie de masse CG-SM a permis de détecter vingt substances. Parmi ces molécules figurent deux sapogénines aglycones caractérisant les saponines stéroïdes: le (3β,25R)-spirost-5-èn-3-ol et le (3β,25R)-spirost-5-èn-3-ol acétate. Ces molécules présentent un squelette en C27 de type spirostane et sont respectivement connues sous les noms communs de diosgénine et acétate de yamogénine. Ces substances naturelles, biologiquement actives, constituent un enjeu majeur des sciences du vivant dans la mesure où elles ne présentent aucune toxicité et où elles pourraient être administrées à l’homme pour diverses affections graves. Elles présentent des intérêts multiples dans le domaine de la santé et pour les industries pharmaceutique et cosmétique. Leur valorisation et leur utilisation ultérieures dans le domaine industriel pourraient être envisagées.
Abstract
Interest in the date palm, Phoenix dactylifera L., is due to its ecological role, because it creates a favorable bioclimate for oasis development and to its socio-economic importance because dates occupy a prominent place as a source of foreign currency and in human and animal food; hence, this fruit carries significant agro-food opportunities. Its chemical investigation can contribute to a better appreciation of the date palm, by the identification of new molecules of interest from its by-products.
Many compounds with interesting biological activities such as flavonoids, phenol acids and derived, sugars, fatty acids, proteins, vitamins and also volatile compounds have been identified in by-products of date palm. However, the knowledge of the chemical composition of these by products is by no means complete. Hence, the studies we undertake aim at searching new natural bioactive molecules able to contribute to this Saharan plant valorisation.
Our experimentation was carried out on leaflets collected in March 2008 from five date palm trees belonging to Takerbucht cultivar growing in the experimental station of the National Institute of Agronomic Research (INRA) of Adrar, in the South-west (27 54’ Northern, 0 17’1” West) of the Algerian Sahara.
The dry material (5 g) has been hydrolyzed during 40 min by hydrochloric acid (2 N) in boiling “bain-marie”. The organic phase separation was obtained by three successive extractions with diethyl ether. The aqueous phase containing orange-red colored anthocyanidins has been eliminated, then the organic phase evaporated. The dry residues have been treated again by absolute methanol.
The analysis of methanolic leaflets extracts was performed using a gas chromatograph Hewlett Packard 6890 coupled to a mass spectrometer Electron Impact HP 5973 type. Identification of compounds was achieved by comparing the mass spectra obtained with those of the National Institute of Standards and Technology Library (Nist98).
The analytical process applied allowed the separation of complex mixtures. The chromatographic profiles by GC-MS of date palm leaflets are not very diversified. Twenty substances were detected; their total area is 99,98%. Among these compounds, eighteen were identified, adding up a 94,61% area; two could not be identified.
Among the identified molecules, two are abundant; they represent an area of 33,75%. The comparison of their mass spectra and their chromatographic profiles obtained under our experimental conditions with those of the Nist98 library, allowed the identification of these substances. There are two sapogenin aglycones characterizing the steroidal saponins: the (3β,25R)-spirost-5-en-3-ol and (3β,25R)-spirost-5-en-3-ol acetate. These molecules present a C27 spirostane-type skeleton and are commonly called diosgenin and yamogenin acetate. The yamogenin drifts from the diosgenin by isomerisation and products the yamogenin acetate by acetylating. To our knowledge, these two natural bioactive molecules are identified for the first time in the date palm, Phoenix dactylifera L. (Arecaceae). They constitute a major challenge in biological sciences, since they are increasingly used in the biomedical field because of their various biological activities and low toxicity. Their valorisation and use in the industrial field could be considered.
A. Introduction
L’intérêt suscité par le palmier dattier, Phoenix dactylifera L., est dû d’une part à son rôle écologique, car il crée un bioclimat favorable au développement de l’oasis (Toutain, Dollé et Ferry Citation1990), d’autre part, à son rôle socio-économique, la datte occupant une place primordiale en tant que source de devises, dans l’alimentation humaine et animale et possédant d’importantes possibilités agro-alimentaires (Gaceb-Terrak et Rahmania Citation2010).
L’investigation chimique permet de contribuer à une meilleure valorisation du palmier dattier, notamment par la détermination de nouvelles molécules d’intérêt à partir de ses sous-produits.
De nombreux composés ont déjà été détectés à partir des sous-produits de cette plante, tels que des flavonoïdes (Ouafi et al. Citation1988; Ziouti et al. Citation1996), des acides phénoliques et dérivés (Mansouri et al. Citation2005; Gaceb-Terrak, Touam et Rahmania Citation2008), des sucres, des acides gras, des protéines et des vitamines (Al-Shahib et Marshall Citation2003a, Al-Shahib et Marshall Citation2003b; Al-Humaid et al. Citation2010), ainsi que des composés volatils (Besbes et al. Citation2004; Harrak et al. Citation2005; Gaceb-Terrak et Rahmania Citation2010).
Le palmier dattier, ainsi que ses sous-produits, possède de nombreuses activités biologiques aussi intéressantes qu’importantes qui ont été révélées, ces dernières années, par divers auteurs. Ainsi, des tests in vitro montrent que des extraits foliaires de Phoenix dactylifera L. présentent à la fois une activité antifongique sur Fusarium oxysporum f. sp. albedinis, agent causal de la fusariose vasculaire du palmier dattier (Gaceb-Terrak, Touam, et Rahmania Citation2008) et antibactérienne contre des germes pathogènes Gram- et Gram+ (Perveen, Bokhari, et Soliman Citation2012).
Les extraits aqueux et sirops de dates présentent, in vitro, un important pouvoir antioxydant (Vayalil et Perveen Citation2002 ; El-Mamary et Al-Habori Citation2010 ; Saleh, Tawfik et Abu-Tarboush Citation2011 ; Al-Shoaibi et al. Citation2012) et peuvent avoir, in vivo, une action hormonale (Bauza et al. Citation2002) et hépato-protectrice (Al-Shoaibi et al. Citation2012).
Le pollen du dattier, souvent utilisé en médicine traditionnelle pour combattre la stérilité masculine, déclenche une activité anti-inflammatoire et antiproliférative sur l’hyperplasie atypique de la prostate provoquée expérimentalement chez le rat (Elberry et al. Citation2011).
L’étude que nous avons menée a pour objectif de renforcer la connaissance phytochimique du palmier dattier en recherchant des molécules naturelles biologiquement actives, qui puissent être valorisées et utilisées dans le domaine industriel.
B. Matériel et méthodes
1. Matériel végétal
L’ensemble de notre expérimentation a été réalisée sur des folioles médianes de palmes, prélevées en mars 2008 sur cinq palmiers femelles adultes appartenant à un cultivar local : Takerbucht. Ces individus sont cultivés dans la parcelle n°11, située dans la station expérimentale de l’Institut National de la Recherche Agronomique (INRA) d’Adrar, dans le Sud-ouest (27°54’ Nord, 0°17’1” Ouest) du Sahara algérien.
Les folioles sont séchées à température ambiante et à l’abri de la lumière vive, puis réduites en poudre à l’aide d’un broyeur électrique en vue d’une analyse chimique par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CG-SM).
2. Extraction et séparation de la phase organique
Le protocole d’analyse classique établi par Bate-Smith (Citation1954), repris par Lebreton et autres (Citation1967), puis par Jay et autres (Citation1975) est préconisé pour l’analyse des flavonoïdes par chromatographie sur papier, sur gel et liquide à haute performance. Ce protocole, détaillé ci-dessous, permet, par ailleurs, l’analyse par chromatographie en phase gazeuse des lipides et autres composés volatilisables à température élevée (Gaceb-Terrak Citation2011).
Un hydrolysat est réalisé avec 5 g de matériel végétal sec pulvérisé et passé au bain marie bouillant par 80 mL d’acide chlorhydrique (2 N) pendant 40 min avec insufflation d’oxygène toutes les 10 min. Après refroidissement de l’hydrolysat, trois extractions successives de la phase organique sont réalisées à l’aide d’éther di-éthylique (60–60-40 mL). La phase aqueuse contenant les anthocyanidines de couleur rouge orange selon les échantillons, est écartée.
La phase organique de chaque échantillon est ensuite évaporée à sec sous hotte ventilée. Les résidus secs sont repris chacun par 5 mL de méthanol absolu, puis la solution obtenue est analysée par CG-SM.
3. Conditions analytiques
L’analyse des extraits méthanoliques est réalisée à l’aide d’un chromatographe type Hewlett Packard 6890, couplé à un spectromètre de masse à impact électronique HP 5973 et équipé d’une colonne capillaire HP5MS (polymère de silice et poly-di-méthyle siloxane) de 30 m x 0,25 mm x 0,25 μm. Le gaz vecteur est l’Hélium, son débit est de 1 mL.min−1. La température de l’injecteur est de 250 °C et celle du détecteur est de 270 °C.
La programmation de la température dans la colonne est de 60 °C pendant 2 min à raison de 60 °C.min−1 jusqu’à 270 °C pendant 5 min.
Le volume de l’extrait injecté est de 5 μL en mode Split (1/50). La température de l’interface est de 280 °C et celle de la source d’ion est de 230 °C. Le spectre de masse est enregistré à l’aide d’un détecteur de type quadripôle (150 °C). L’ionisation est effectuée en impact électronique (IE) avec un potentiel de 70 eV.
4. Détection et identification
Les composés sont détectés selon leur ordre d’élution et sont identifiés par comparaison de leur spectre de masse et de leur indice de rétention (IR) avec la base de données du National Institute of Standards and Technology 1998 (NIST 98). Nous ne prenons en considération que les composés dont le taux de reconnaissance est supérieur à 75% ; les autres sont considérés comme substances non identifiées (NI).
Chaque composé décelé est caractérisé par son indice de rétention, son aire de répartition et son taux de reconnaissance définit par Nist98. Les chromatogrammes des échantillons analysés sont tracés à l’aide du logiciel OriginPro 8.0.
C. Résultats
Le procédé analytique appliqué a permis la séparation de mélanges complexes. Les profils chromatographiques par CG-MS des folioles du cultivar Takerbucht, sont peu diversifiés. Seules vingt substances naturelles ont été détectées ; leur aire de répartition globale est de 99,98%. Dix-huit molécules ont été identifiées, représentant un total de 94,61% du profil chromatographique; deux n’ont pu l’être (Tableau ).
Tableau 1. Composition chimique des extraits de folioles du palmier dattier, cultivar Takerbucht. Table 1. Chemical composition of the leaflets extracts of Takerbucht date palm cultivar.
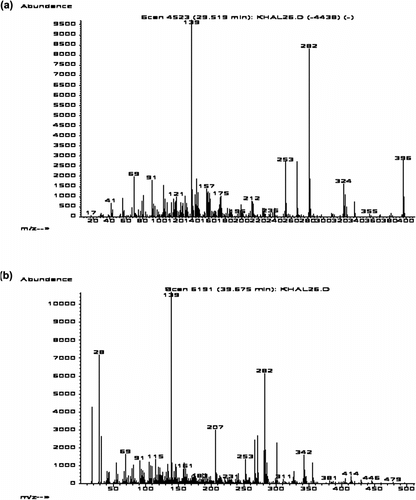
Deux molécules d’intérêt ont été détectées (pics 15 et 19) ; elles représentent plus d’un tiers (33,75%) du profil chromatographique des folioles du cultivar Takerbucht (Tableau ). La comparaison de leur profil chromatographique (Figure ) et de leurs spectres de masse (Figures. a et 2b) obtenus dans nos conditions expérimentales avec ceux de la bibliothèque Nist98, a permis l’identification de ces deux substances.
Figure 1 Chromatogramme par CG-SM des extraits de folioles de palmier dattier, cultivar Takerbucht. (a): (3β,25R)-Spirost-5-èn-3-ol, acétate et (b) : (3β,25R)-Spirost-5-èn-3-ol. Figure 1. GC-MS chromatogram of the leaflets extracts of Takerbucht date palm cultivar. (a): (3β,25R)-Spirost-5-en-3-ol, acetate and (b) : (3β,25R)-Spirost-5-en-3-ol.
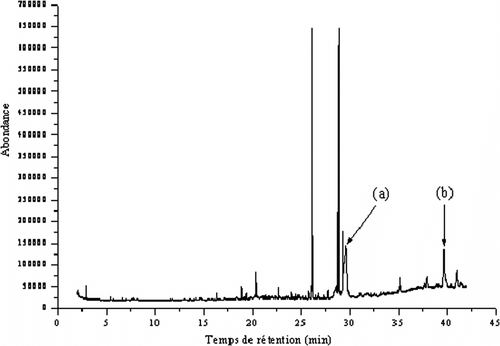
Figure 2 Spectres de masse des sapogénines identifiées dans les folioles du palmier dattier, cultivar Takerbucht. (a): (3β,25R)-Spirost-5-èn-3-ol, acétate et (b) : (3β,25R)-Spirost-5-èn-3-ol. Figure 2. Mass spectra of sapogenins identified from leaflets of Takerbucht date palm cultivar. (a): (3β,25R)-Spirost-5-en-3-ol acetate and (b): (3β,25R)-Spirost-5-en-3-ol.
Ces molécules sont (1) le (3β,25R)-spirost-5-èn-3-ol et (2) le (3β,25R)-spirost-5-èn-3-ol, acétate, connues respectivement sous les noms communs de diosgénine (C27H42O3 - 414,31 g.mol−1) et acétate de yamogénine (C29H44O4 - 456,657 g.mol−1), l’acétate de yamogénine étant un dérivé de la diosgénine produit suite à une réaction d’acétylation (Figure. ).
Figure 3 Relation structurale des sapogénines identifiées dans les folioles du palmier dattier. Figure 3. Structural relation of the sapogenins identified in the date palm leaflets.
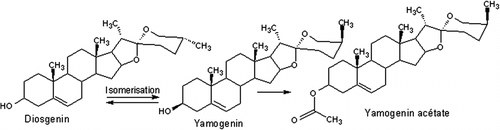
Leur structure de base en C27 correspond au type spirostane, qui est une sapogénine (aglycone de saponine) stéroïde. Ces substances n’ont jamais été détectées auparavant chez le palmier dattier et sont potentiellement intéressantes pour leur bioactivité.
D. Discussion
Les saponines ou saponosides sont des hétérosides complexes caractérisant quelques familles de végétaux. Elles sont issues de la combinaison d’un sucre avec un stéroïde, avec un alcaloïde ou avec un triterpène ; c’est pourquoi on les qualifie respectivement de saponines stéroïdes, saponines alcaloïdes ou saponines triterpènes (Guignard Citation2000).
Les saponines de type stéroïdien se rencontrent presque exclusivement au sein des angiospermes chez les monocotylédones, telles que, par exemple, les Dioscoreaceae (Wall Monroe et al. Citation1955; Hoyer, Sucrow, et Winkler Citation1975; Chen-Lai, Yan-Yong et Shao-Bin Citation1985), Liliaceae (Meng-Jing Citation1990), Agavaceae (Wall Monroe et al. Citation1955; Jin et al. Citation2007) et Arecaceae (Wall Monroe et al. Citation1955; Lim Citation2012).
La diosgénine fut découverte pour la première fois en 1936 dans les tubercules de Dioscorea tokoro Makino (Dioscoreaceae) (Degras Citation1986). Elle a été identifiée dans le feuillage de quelques genres et espèces d’Arecaceae, comme Trachycarpus fortunei (Hook.) H. Wendl. (Hirai et al. Citation1984a) et T. wagnerianus Becc. (Idaka, Hirai, et Shoji Citation1986), Rhapis exelsa Henry et R. humilis Bl. (Hirai et al. Citation1984b), Chamaerops humilis L. et Arecastrum romanzoffianum Becc. (Idaka, Hirai, et Shoji Citation1986, 1991).
Le genre Phoenix a fait l’objet de nombreux travaux sur la recherche de molécules bioactives. Trois saponines stéroïdiennes méthylées de type furostane (proto-rupicolaside, proto-Pb et proto-reclinatoside) ont été identifiées dans le feuillage de Phoenix rupicola T. Anderson, P. loureirii Kunth et P. reclinata N.J. Jacquin (Idaka, Hirai, et Shoji Citation1991); parmi ces trois saponines, seules les deux dernières figurent dans les palmes de Phoenix dactylifera L. (Asami, Hirai et Shoji Citation1991). Selon ces auteurs, une pro-sapogénine de type spirostane a été décelée dans le feuillage de cette même espèce. Par ailleurs, une saponine glycosylée a été mise en évidence par chromatographie sur gel à partir du pollen de P. dactylifera L. La génine correspondante n’a pu être identifiée ; les sucres auxquels elle est substituée sont le glucose et le rhamnose (Mahran, Abdel-Wahab, et Attia Citation1976).
L’étude des activités biologiques des deux saponines (diosgénine et yamogénine) identifiées par nous-mêmes, dans le feuillage du cultivar Takerbucht, est en cours dans notre laboratoire.
Outre ces deux molécules, nous avons déjà pu mettre en évidence dans les graines de ce même cultivar la présence d’une saponine triterpène tétracyclique dérivant de l’oléanane. Il s’agit du (3β,17ξ)-18,19-sécolupan-3-ol (Gaceb-Terrak Citation2010). Un composé proche de celui-ci, l’oléan-12-èn (ou β-amyrine), a été révélé dans le pollen de cette même espèce (Mahran, Abdel-Wahab et Attia Citation1976). Par ailleurs, aucune saponine de type alcaloïde n’a été décelée dans nos travaux, ni identifiée dans la littérature sur le palmier dattier.
Ces deux substances naturellement actives permettent d’accéder par synthèse à de nombreuses molécules analogues. Elles ont été depuis longtemps introduites dans l’hémi-synthèse industrielle de la progestérone (Marker et Krueger Citation1940) et sont souvent converties après plusieurs étapes en cortisone (Djerassi Citation1992), en pregnénolone et autres stéroïdes de synthèse (Dolgopolov, Lishcheta et Shvidko Citation1970; Guignard Citation2000).
Plusieurs travaux ont montré que l’utilisation de ces saponines d’origine végétale revêt une importance considérable pour l’homme; elles sont, en effet, dotées d’une activité cytotoxique (Corbière Citation2003; Sun et al. Citation2006). Ces deux sapogénines, qui ont la capacité d’induire un arrêt du cycle cellulaire et une apoptose de cellules cancéreuses, sont utilisées pour leur effet antiprolifératif des cellules surnuméraires (Corbière Citation2003; Léger et al. Citation2004; Liu et al. Citation2005). Elles ont notamment été déjà testées sur différentes lignées cancéreuses comme l’ostéosarcome, le laryngocarcinome et le mélanome (Corbière Citation2003).
Conclusion
La méthode analytique appliquée constitue un compromis raisonnable et fructueux au regard de l’information moléculaire. En effet, nous avons analysé des extraits habituellement utilisés pour l’étude des flavonoïdes, ce qui a permis d’obtenir ces résultats originaux, soit la séparation et l’identification de substances organiques biologiquement actives telles que les acides gras saturés, les alcanes, les phtalates, les sapogénines et autres molécules.
La mise en évidence de nouvelles substances naturelles, comme la diosgénine et la yamogénine, pourrait rendre au palmier dattier ses lettres de noblesse et orienter les recherches vers de nouvelles pistes. Leur exploitation ultérieure en tant que molécules bioactives dans le domaine thérapeutique humain est prometteuse.
Références
- Al-Humaid , A. I. , Mousa , H. M. , El-Mergawi , R. A. and Abdel-Salam , A. M. 2010 . Chemical composition and antioxidant activity of dates and dates-camel-milk mixtures as a protective meal against lipid peroxidation in rats . American Journal of Food Technology , 5 : 22 – 30 .
- Al-Shahib , W. and Marshall , R. J. 2003a . The fruit of date palm: it’s possible use as the best food for the future? . International Journal Food Sciences and Nutition , 54 ( 4 ) : 247 – 259 .
- Al-Shahib , W. and Marshall , R. J. 2003b . Fatty acid content of the seeds from 14 varieties of date palm Phoenix dactylifera L . International Journal Food Sciences and Nutition , 38 ( 6 ) : 709 – 712 .
- Al-Shoaibi , Z. , Al-Mamary , M. A. , Al-Habori , M. A. , Al-Zubairi , A. S. and Abdelwahab , S. I. 2012 . In vivo antioxidative and hepatoprotective effects of palm date fruits (Phoenix dactylifera) . International Journal of Pharmacology , 8 ( 3 ) : 185 – 191 .
- Asami, A., Y. Hirai, et J. Shoji. 1991. “Studies on the constituents of Palmae plants. VI- Steroid saponins and flavonoids of leaves of Phoenix canariensis hort. ex Chabaud, P. humilis Royle var. hanceana Beccari, P. dactylifera L. and Licuala spinosa Wurmb.” Chemical and Pharmaceutical Bulletin 39 (8): 2053–2056.
- Bate-Smith , E. C. 1954 . Leuco-anthocyanins: 1- Detection and identification of anthocyanidins formed from leuco-anthocyanins in plant tissues . Biochemical Journal , 58 : 122 – 125 .
- Bauza , E. , Dal Farra , C. , Berghi , A. , Oberto , G. , Peyronel , D. and Domloge , N. 2002 . Date palm kermel extract exhibits antiaging properties and significantly reduces skin wrinkles . International Journal of Tissue Reactions , 24 ( 4 ) : 131 – 136 .
- Besbes , S. , Blecker , C. , Deroanne , C. , Drira , N. D. and Attia , H. 2004 . Date seeds: chemical composition and characteristic profiles of the lipid fraction . Food Chemistry , 84 : 577 – 584 .
- Chen-Lai , L. , Yan-Yong , C. and Shao-Bin , G. 1985 . Isolation and identification of steroid saponino from Dioscorea parviflora Ting . Zhiwùxué Bào , 27 ( 6 ) : 635 – 639 .
- Corbière, C. 2003. Comparaison de l’effet antiprolifératif de trois stéroïdes végétaux (diosgénine, hécogénine, tigogénine) sur la lignée 1547 d’ostéosarcome humain. Implication de la mitochondrie et de la cyclooxygénase-2 dans l’apoptose induite par la diosgénine sur les lignées 1547, Hep-2 (laryngocarcinome) et M4Beu (mélanome). Thèse de Doct., Univ. de Limoges.
- Degras, Lucien. 1986. L’Igname: plante à tubercule tropicale. Vol. 36, éd. Maisonneuve et Larose Paris.
- Djerassi , C. 1992 . Steroid research at Syntex: the pill and cortisone . Steroids , 57 ( 12 ) : 631 – 641 .
- Dolgopolov , V. D. , Lishcheta , L. I. and Shvidko , R. I. 1970 . Determination of the end of reactions of acetylation of diosgenin and isomerization of diosgenin acetate in production of dehydropregnenolone by the method of thin-layer chromatography . Pharmaceutical Chemistry Journal , 4 ( 12 ) : 731 – 732 .
- Elberry, A. A., S. T. Mufti, J. A. Al-Maghrabi, E. A. Abdel-Sattar, O. M. Ashour, S. A. Ghareib, et H. A. Mosli. 2011. “Anti-inflammatory and antiproliferative activities of date palm pollen (Phoenix dactylifera) on experimentally-induced atypical prostatic hyperplasia in rats.” Journal of Inflammation. doi:10.1186/1476.9255.8.40
- El-Mamary, M., et M. Al-Habori. 2010. “The in-vitro antioxidant activity of different types of palm dates (Phoenix dactylifera) syrups.” Arabian Journal of Chemistry. doi:10.1016/j.arabjc.2010.11.014
- Gaceb-Terrak , R. , Touam , D. and Rahmania , F. 2008 . Action des acides phénols du palmier dattier Phoenix dactylifera L. sur la croissance du Fusarium oxysporum f. sp. albedinis . Revue des Régions Arides III , 21 : 1219 – 1223 .
- Gaceb-Terrak, R. 2010. Contribution à la connaissance des interactions palmier dattier Phoenix dactylifera L.-agent causal du bayoud Fusarium oxysporum f. sp. albedinis par analyses phytochimiques des lipides et des phénylpropanoïdes. Thèse Doct. d’État, Univ. Houari Boumediene Alger.
- Gaceb-Terrak, R., et F. Rahmania. 2010. “Analyse des lipides et autres composés volatils de Deglet Nour, cultivar de palmier dattier Phoenix dactylifera L., par chromatographie en phase gazeuse couplée à la spectrométrie de masse.” Acta Botanica Gallica 157 (1): 127–133.
- Gaceb-Terrak , R. 2011 . Contribution à la connaissance des interactions palmier dattier Phoenix dactylifera L.-agent causal du bayoud Fusarium oxysporum f. sp. albedinis par analyses phytochimiques des lipides et des phénylpropanoïdes . Acta Botanica Gallica , 158 ( 2 ) : 285 – 288 .
- Guignard, Jean-Louis. 2000. Biochimie végétale. 2ème édition de l’abrégé Dunod.
- Harrak , H. , Reynes , M. , Lebrun , M. , Hamouda , A. and Brat , P. 2005 . Identification et comparaison des composés volatils des fruits de huit variétés de dattes marocaines . Fruits , 60 : 267 – 278 .
- Hirai , Y. , Sanada , S. , Ida , Y. and Shoji , J. 1984 . Studies on the constituents of Palmae plants: I- The constituents of Trachycarpus fortuneio (Hook.) H. Wendl . Chemical and Pharmaceutical Bulletin , 32 : 295 – 301 .
- Hirai , Y. , Sanada , S. , Ida , Y. and Shoji , J. 1984 . Studies on the constituents of Palmae plants: II- The constituents of Rhapis exelsa Henry and R. humilis Bl . Chemical and Pharmaceutical Bulletin , 32 : 4003 – 4011 .
- Hoyer , G. A. , Sucrow , W. and Winkler , D. 1975 . Diosgenin saponins from Dioscorea floribunda . Phytochemistry , 14 : 539 – 542 .
- Idaka , K. , Hirai , Y. and Shoji , J. 1986 . Studies on the constituents of Palmae plants: III- The constituents of Chamaerops humilis L. and Trachycarpus wagnerianus Becc . Chemical and Pharmaceutical Bulletin , 34 : 82 – 87 .
- Idaka , K. , Hirai , Y. and Shoji , J. 1991 . Studies on the constituents of Palmae plants: V- Steroid saponins and flavonoids of leaves of Phoenix rupicola T. Anderson, P. loureirii Kunth, P. reclinata N. J. Jacquin and Arecastrum romanzoffianum Beccari . Chemical and Pharmaceutical Bulletin , 39 : 1455 – 1461 .
- Jay , M. , Gonnet , J. F. , Wollenweber , E. and Voirin , B. 1975 . Sur l’analyse qualitative des aglycones flavoniques dans une optique chimiotaxonomique . Phytochemistry , 14 : 1605 – 1612 .
- Jin , Y. L. , Kuk , J.H. , Oh , K. T. , Kim , Y. J. , Piao , X. L. and Park , R. D. 2007 . A new steroidal saponin, yuccalan, from the leaves of Yucca smalliana . Archives of Pharmacal Research , 30 ( 5 ) : 543 – 545 .
- Lebreton , P. , Jay , M. , Voirin , B. and Bouchez , M. P. 1967 . Sur l’analyse qualitative et quantitative des flavonoïdes . Chimie Analytique , 49 ( 7 ) : 375 – 383 .
- Léger , D. Y. , Liagre , B. , Cardot , P. J. P. , Beneytout , J. L. and Battu , S. 2004 . Diosgenin dose-dependent apoptosis and differentiation induction in human erythroleukemia cell line and sedimentation field-flow fractionation monitoring . Analytical biochemistry , 335 ( 2 ) : 267 – 278 .
- Lim, T. K. 2012. Edible medicinal and non-medicinal plants. Vol. 3 Fruits, éd. Elsevier.
- Liu , M. J. , Wang , Z. , Ju , Y. , Wong , R. N. and Wu , Q. Y. 2005 . Diosgenin induces cell cycle arrest and apoptosis in human leukemia K562 cells with the disruption of Ca2+ homeostasis . Cancer Chemotherapy and Pharmacology , 55 ( 1 ) : 79 – 90 .
- Mahran , G. H. , Abdel-Wahab , S. M. and Attia , A. M. 1976 . A phytochemical study of date palm pollen . Planta Medicinal , 29 ( 2 ) : 171 – 175 .
- Mansouri , A. , Guendez , E. , Kokkalou , E. and Kefalas , P. 2005 . Phenolic profile and antioxidant activity of the Algerian ripe date palm fruit (Phoenix dactylifera) . Food Chemistry , 89 : 411 – 420 .
- Marker , R. E. and Krueger , J. 1940 . Sterols, sapogenins: the preparation of trillin and its conversion to progesterone . Journal of the American Chemical Society , 62 ( 12 ) : 3349 – 3350 .
- Meng-Jing, C., X. Gui-Qiong, et Z. Guo-Wen. 1990. “Isolement et identification de saponines stéroïdes et de sapogénines d’Aspidistra zongbayi K.Y. Lang et Z.Y. Zhu.” Zhíwùxué Bào 32 (4): 297–301.
- Ouafi , S. , Gaceb-Terrak , R. , Bounaga , N. and Lebreton , P. 1988 . Les flavonoïdes, marqueurs intraspécifiques chez le palmier dattier Phœnix dactylifera L . Comptes Rendus de l’Académie des Sciences Paris , 306 : 399 – 404 .
- Perveen, K., N. A. Bokhari, et D. A. W. Soliman. 2012. “Antibacterial activity of Phoenix dactylifera L. leaf and pit extracts against selected Gram negative and Gram positive pathogenic bacteria.” Journal of the Medicinal Plants Research 6 (2): 296–300.
- Saleh , E. A. , Tawfik , M. S. and Abu-Tarboush , H. M. 2011 . Phenolic contents and antioxidant activity of various date palm (Phoenix dactylifera L.) fruits from Saudi Arabia . Food and Nutrition Sciences , 2 : 1134 – 1141 .
- Sun , L. X. , Fu , W. W. , Li , W. , Bi , K. S. and Wang , M. W. 2006 . Diosgenin glucuronides from Solanum lyratum and their cytotoxicity against tumor cell lines . Zeitschrift für Naturforschung C, Biosciences , 61 ( 3–4 ) : 171 – 176 .
- Toutain, G., V. Dollé, et M. Ferry. 1990. Situation des systèmes oasiens en régions chaudes. Options Méditerranéennes Ciheam: 7–18.
- Vayalil, P. K., et K. Perveen. 2002. “Antioxydant and antimutagenic properties of aqueous extract of date fruit (Phoenix dactylifera L. Arecaceae).” Journal of Agricultural and Food Chemistry 50 (3): 610–617.
- Wall Monroe , E. , Fenske , C. S. , Willaman , J. J. , Correll , D. S. , Schubert , B. G. and Gentry , H. S. 1955 . Steroidal sapogenins XXV: Survey of plants for steroidal sapogenins and other constituents . Journal of the American Pharmaceutical Association , 44 ( 7 ) : 438 – 440 .
- Ziouti , A. , El-Modafar , C. , Fleuriet , A. , El-Boustani , S. and Macheix , J. J. 1996 . Phenolic compounds in date palm cultivars sensitive and resistant to Fusarium oxysporum . Biologia Plantarum , 38 ( 3 ) : 451 – 457 .
