ABSTRACT
We performed a systematic review of the genus Anadia in Ecuador to delimit species based on several lines of evidence: external morphology, hemipenes, coloration, DNA sequences and geographical distribution. We describe a new species, Anadia buenaventura sp. nov., which is distinguished from other species of Anadia by presenting a pattern of coloration with light dorsolateral bands and paravertebral rows of dark spots, as well as fewer scales around the body. We also present new data on the distribution of Anadia petersi Oftedal and a molecular phylogeny that suggests that Anadia rhombifera (Günther) is a complex of species that requires further taxonomic work that should include material from Colombia.
RESUMEN
Realizamos una revisión sistemática del género Anadia en Ecuador para delimitar especies basándonos en varias líneas de evidencia: morfología externa, hemipenes, coloración, secuencias de ADN y distribución geográfica. Describimos una especie nueva, Anadia buenaventura sp. nov., que se distingue de otras especies de Anadia por presentar un patrón de coloración con bandas dorsolaterales claras e hileras paravertebrales de puntos oscuros, y menos escamas alrededor del cuerpo. También presentamos nuevos datos sobre la distribución de Anadia petersi Oftedal y una filogenia molecular que sugiere que Anadia rhombifera (Günther) constituye un complejo de especies que requiere más trabajo taxonómico que debería incluir material de Colombia.
Introducción
En el transcurso de la última década, la taxonomía, diversidad críptica y relaciones filogenéticas de los saurios neotropicales de la familia Gymnophthalmidae, han sido activamente estudiadas, con una tasa de descripción promedio de cuatro especies nuevas por año [e.g. Citation1–Citation6]). Varios estudios han provocado un cambio en el entendimiento de las relaciones filogenéticas entre los géneros que componen este clado, con la definición de subfamilias, cambios en los géneros y análisis biogeográficos [Citation7–Citation12]. Con 243 especies formalmente descritas, la familia Gymnophthalmidae se distribuye desde el sur de México hasta Argentina [Citation13], sobresaliendo Cercosaurinae como un clado que agrupa más de la mitad de especies, las cuales están concentradas en los biomas Andino Tropicales del norte de Sudamérica [Citation7,Citation11]. Uno de los géneros que componen este linaje es Anadia Gray [Citation14], conformado por 18 especies distribuidas en Costa Rica, Panamá, Guyana, Venezuela, Colombia y Ecuador [Citation13,Citation15,Citation16]. El género Anadia es más diverso al norte de los Andes, Colombia y Venezuela cuentan con nueve especies cada uno [Citation16,Citation17]. El límite de distribución austral del género es el sur de Ecuador, donde ocurren A. rhombifera [Citation18] y A. petersi [Citation19,Citation20]. Recientes análisis filogenéticos basados en ADN han identificado al género Anadia como un grupo no monofilético [Citation11,Citation13].
Oftedal [Citation19] realizó un importante aporte sobre el género, con la compilación de 11 de las 18 especies actualmente conocidas, incluyendo una revisión de los caracteres diagnósticos para el género y la descripción de Anadia petersi para el suroriente de Ecuador. Su trabajo presentó una propuesta sistemática con cinco grupos putativos para el género, identificados principalmente por su distribución geográfica, y la forma y conteo de escamas dorsales. Las dos especies ecuatorianas fueron incluidas en el grupo “ocellata”, junto a las especies colombianas Anadia ocellata Gray [Citation14] y Anadia vittata Boulenger [Citation21]. Desde el estudio de Oftedal, se han adicionado seis especies al género [Citation13] y se ha revalidado a una especie [Citation22].
El género Anadia se distingue morfológicamente de otros Gymnophthalmidae por presentar escamas rostral, frontonasal, frontal e interparietal únicas, y escamas nasales, prefrontales, frontoparietales y parietales pares. Las escamas dorsales, ventrales y gulares son lisas y las escamas de los flancos son de similar tamaño que las dorsales. Los poros femorales son evidentes en machos y usualmente en hembras. Las extremidades están bien desarrolladas, son pentadáctilas y todos los dedos terminan en garras [Citation19]. Varios estudios han recalcado la importancia del análisis de la morfología hemipenial para la caracterización de especies de gimnoftálmidos [Citation23,Citation24] y específicamente para el género Anadia [Citation17,Citation22,Citation25,Citation26]. Sin embargo, la información sobre hemipenes para este grupo se considera aún escasa [Citation17].
En general, la colección de especímenes del género Anadia en Ecuador ha sido muy limitada, dificultando el conocimiento sobre distribución geográfica, taxonomía y relaciones filogenéticas. En este estudio analizamos individuos de poblaciones ecuatorianas del género Anadia con el objetivo de definir límites entre especies, incorporando patrones de variación en conteos de escamas, coloración, morfología hemipenial, distribución geográfica, y relaciones filogenéticas basadas en secuencias de ADN. Presentamos un compendio para las especies reportadas en el territorio ecuatoriano, así como la descripción de una nueva especie para las estribaciones suroccidentales de los Andes de Ecuador.
Metodología
Las conclusiones taxonómicas de nuestro estudio se basan en la observación de características morfológicas (conteos de escamas, morfometría y morfología hemipenial), patrones de coloración y relaciones filogenéticas. Usamos esta información como criterios para delimitar especies, siguiendo el concepto general unificado de especie [Citation27,Citation28].
Datos morfológicos
Examinamos especímenes preservados y depositados en el Museo de Zoología de la Pontificia Universidad Católica del Ecuador (QCAZ) y en la División de Herpetología del Instituto Nacional de Biodiversidad (DHMECN) (ver Apéndice 1, material examinado). La terminología que utilizamos para los caracteres morfológicos se basó en Oftedal [Citation19], Myers et al. [Citation26], Kok & Rivas [Citation25] y Kizirian [Citation23]. Tomamos los datos morfométricos con un calibrador digital (Trupper, precisión 0.01 mm, redondeado a 0.1 mm) utilizando un estéreo microscopio Boeco BS-80 de 10x.
Los caracteres registrados corresponden a Morfometría: (1) longitud rostro-cloaca (LRC); (2) longitud de la cola (LC); (3) longitud de la cabeza, desde la punta del hocico hasta el margen anterior del tímpano; (4) ancho de la cabeza; (5) altura de la cabeza; (6) longitud nariz-axila; (7) longitud del cuello, desde el borde posterior del tímpano hasta la base del antebrazo; (8) longitud axila-ingle; (9) longitud de la extremidad anterior, desde la axila hasta la punta del dedo IV; (10) longitud de la extremidad posterior, desde la ingle hasta la punta del dedo IV. Proporciones: (11) ancho/longitud de la cabeza; (12) longitud de la extremidad posterior/longitud del cuerpo; (13) diámetro del tímpano/diámetro del ojo. Conteos de escamas (): (14) lamelas subdigitales en dedo IV de la mano; (15) lamelas subdigitales en dedo IV del pie; (16) dorsales en hileras transversales, desde las postoccipitales hasta nivel del borde posterior del muslo en ángulo recto con el cuerpo; (17) ventrales en hileras longitudinales, contadas a medio cuerpo incluyendo escamas ventrolaterales rectangulares pequeñas; (18) ventrales en hileras transversales, entre el collar y la cloaca, incluyendo las preanales; (19) escamas alrededor de medio cuerpo, contadas en la mitad de la distancia entre el collar y la cloaca; (20) supraoculares; (21) superciliares; (22) supralabiales; (23) infralabiales; (24) gulares en hileras transversales; (25) postparietales; (26) pregulares entre último par de geneiales; (27) escamas entre supraocular y superciliar; (28) presupraocular. Otros caracteres: (29) número de poros femorales; (30) longitud relativa de sutura entre prefrontales, según longitud de escama frontal (> 0.5 alargada, 0.5 moderada, < 0.5 estrecha); (31) contacto entre nasal y rostral; (32) presencia de surco subnostrilar; (33) número de ocelos en el flanco; (34) morfología hemipenial.
Figura 1. Anadia rhombifera (QCAZ10537), nomenclatura de escamas de la cabeza: A vista dorsal. B vista ventral. C vista lateral. Simbología: f, frontal; fn, frontonasal; fo, frenocular; fp, frontoparietal; ge, geneial; il, infralabial; ip, interparietal; l, loreal; m, mental; n, nasal; p, parietal; pf, prefrontal; pg, pregular (pregulares entre último par de geneiales en gris); pm, postmental; pp, postparietal; psc, presuperciliar; r, rostral; sbo, subocular; sc, superciliar; sl, supralabial; so, supraocular; t, temporal; conteo dorsal, conteo de hileras transversales de escamas dorsales. Modificado de Oftedal [18] y Kizirian [22]. Línea de escala: 2 mm.
![Figura 1. Anadia rhombifera (QCAZ10537), nomenclatura de escamas de la cabeza: A vista dorsal. B vista ventral. C vista lateral. Simbología: f, frontal; fn, frontonasal; fo, frenocular; fp, frontoparietal; ge, geneial; il, infralabial; ip, interparietal; l, loreal; m, mental; n, nasal; p, parietal; pf, prefrontal; pg, pregular (pregulares entre último par de geneiales en gris); pm, postmental; pp, postparietal; psc, presuperciliar; r, rostral; sbo, subocular; sc, superciliar; sl, supralabial; so, supraocular; t, temporal; conteo dorsal, conteo de hileras transversales de escamas dorsales. Modificado de Oftedal [18] y Kizirian [22]. Línea de escala: 2 mm.](/cms/asset/095d8b8d-1986-4365-aeac-7bcc1497fbb8/tneo_a_1487694_f0001_b.gif)
Los patrones de coloración en vida fueron determinados mediante la revisión de fotografías y notas de campo de los colectores de ejemplares. La determinación del sexo se verificó mediante la inspección de hemipenes.
Preparación de hemipenes
Para la descripción de los hemipenes y sus estructuras nos basamos en la observación directa de los órganos sexuales evertidos. Todos los hemipenes fueron preparados de especímenes preservados usando el método descrito por Pesantes [Citation29], con modificaciones. En la mayoría de ejemplares el órgano izquierdo fue removido con una incisión subcaudal, y sumergido en dodecilsulfato sódico por 24 horas. Cuando los tejidos estuvieron blandos y flexibles se evertieron los órganos con la ayuda de un bruñidor/bola de titanio 26/27, impulsando desde la cabeza del hemipene invertido hacia la base del órgano. El hemipene evertido fue inflado con vaselina de petróleo tinturada de rojo [Citation30]. Si alguna estructura del órgano fue perforada durante la eversión, se adicionó cianocrilato sobre el orificio [Citation31]. Consideramos la propuesta de Myers & Cadle [Citation32] para las condiciones de preparación hemipenial: totalmente evertido, totalmente expandido, parcialmente evertido y parcialmente expandido.
Datos moleculares y análisis filogenéticos
Siguiendo los protocolos de Torres-Carvajal et al. [Citation11], obtuvimos secuencias de nucleótidos de tres genes mitocondriales (12S, 16S y ND4) para un especimen de la especie nueva de Anadia descrita en este trabajo. Las secuencias generadas en este estudio fueron depositadas en Genbank, los números de acceso se presentan en la .
Tabla 1. Vouchers, datos de localidad y números de acceso de GenBank de ejemplares de Anadia incluidos en este estudio. Con *: nuevas secuencias obtenidas para este estudio; sin *: [11]. QCAZ (Museo de Zoología, Pontificia Universidad Católica del Ecuador, Quito, Ecuador).
Las secuencias nuevas fueron añadidas a la matriz de datos de Cercosaurinae presentada por Torres-Carvajal et al. [Citation11]. Los datos fueron ensamblados y alineados en Geneious v7.1.5 [Citation33] bajo ajustes por defecto para MAFFT [Citation34]. Las secuencias de ND4 y c-mos se tradujeron en aminoácidos para confirmar el alineamiento. Los modelos más adecuados de sustitución de nucleótidos y el esquema de partición fueron elegidos simultáneamente utilizando PartitionFinder v1.1.1 [Citation35] bajo el Criterio Bayesiano de Información (BIC, por sus siglas en inglés). El algoritmo “codicioso” fue utilizado con longitudes de rama de particiones alternativas vinculadas para buscar el mejor sistema de ajuste. La inferencia bayesiana se utilizó para obtener un árbol filogenético de todos los genes concatenados utilizando el programa MrBayes v3.2.1 [Citation36]. Todos los parámetros fueron desvinculados entre particiones (excepto topología y longitudes de rama) y se permitió variación de tasa entre particiones (prset Ratepr = variable). Cuatro corridas independientes, cada una con cuatro cadenas MCMC, se ejecutaron durante 107 generaciones, muestreando cada 1000 generaciones. Los resultados se analizaron en Tracer v1.6 [Citation37] para evaluar la convergencia y el tamaño de muestra efectivo (ESS, por sus siglas en inglés) para todos los parámetros. Adicionalmente, verificamos que la desviación estándar promedio de las frecuencias de división entre cadenas sea < 0.01, y el factor potencial de reducción de escala (PSRF) tenga valores cercanos a 1. De 10.000 árboles resultantes por corrida, 1000 fueron descartados como “burn-in”. De los 36.000 árboles resultantes se escogió el árbol de credibilidad máxima de clados, es decir la topología que maximiza el producto de las probabilidades posteriores de los clados. El árbol filogenético fue enraizado con Alopoglossus viridiceps [Citation7,Citation8,Citation38,Citation39], y visualizado y editado en FigTree v1.4.2 [Citation40].
Calculamos distancias genéticas de todos los genes mitocondriales entre las especies de Anadia incluidas en este estudio utilizando MEGA7 [Citation41].
Resultados
Basándonos en las líneas de evidencia analizadas en este estudio (análisis filogenético y morfológico), identificamos tres especies de Anadia para Ecuador, dos previamente identificadas en el trabajo de Oftedal [Citation19] (A. rhombifera (Günther [Citation18]) y A. petersi Oftedal [Citation19]) y una especie nueva proveniente de los bosques semideciduos del suroccidente de Ecuador.
Las distancias genéticas entre Anadia petersi y A. rhombifera son menores a las distancias entre cada una de esas especies y la especie nueva. La distancia del gen ND4 es 0.211 entre A. petersi y A. rhombifera, 0.236 entre la nueva especie y A. petersi, y 0.248 entre la nueva especie y A. rhombifera. En el mismo orden, las distancias del gen 12S son 0.097, 0.104, 0.110; mientras que las distancias del gen 16S son 0.032, 0.042, 0.035, respectivamente.
Los análisis filogenéticos se realizaron en base a siete particiones: (i) 12S (GTR + I + G); (ii) 16S (GTR + I + G); (iii) ND4, primer codón (GTR + I + G); (iv) ND4, segundo codón (GTR + I + G); (v) ND4, tercer codón (GTR + G); (vi) CMOS, tercer codón (HKY + G); y (vii) c-mos, primer y segundo codones (GTR + G). La filogenia inferida () muestra que Anadia rhombifera y A. petersi son especies hermanas con un alto soporte. Juntas forman un clado, que es hermano de una nueva especie que describimos a continuación.
Figura 2. Filogenia de Anadia. Árbol de máxima credibilidad de clados obtenido a partir de un análisis bayesiano de 176 especímenes, tres genes mitocondriales (12S, 16S, ND4) y un gen nuclear (c-mos). La topología y valores de soporte del árbol completo son muy similares a lo presentado por Torres-Carvajal et al. [11]. Los números sobre las ramas corresponden a valores de probabilidad posterior.
![Figura 2. Filogenia de Anadia. Árbol de máxima credibilidad de clados obtenido a partir de un análisis bayesiano de 176 especímenes, tres genes mitocondriales (12S, 16S, ND4) y un gen nuclear (c-mos). La topología y valores de soporte del árbol completo son muy similares a lo presentado por Torres-Carvajal et al. [11]. Los números sobre las ramas corresponden a valores de probabilidad posterior.](/cms/asset/01cd68c0-cca1-433d-8507-e14ab9959572/tneo_a_1487694_f0002_b.gif)
Compendio de especies
Anadia buenaventura sp. nov. (–)
Figura 3. Escamas de la cabeza, vista dorsal, ventral y lateral (escamas postparietales y escamas pregulares entre último par de geneiales en gris). A Anadia buenaventura sp. nov. (DHMECN9478, Holotipo). B Anadia petersi (QCAZ10087). Línea de escala: 2 mm.
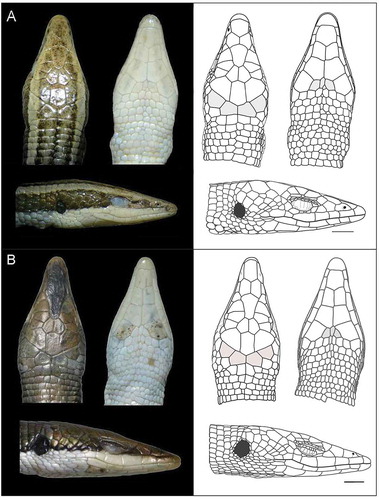
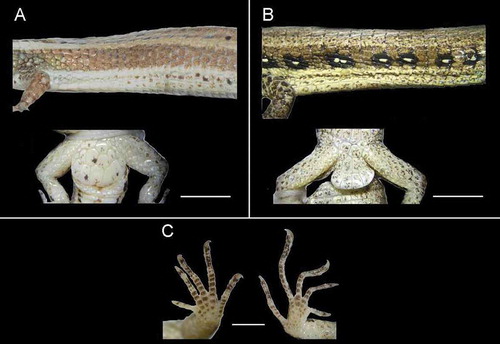
Figura 4. Anadia buenaventura sp. nov., flanco, región pélvica, mano y pie. A, C DHMECN9478 ♀ (holotipo). B QCAZ14088 ♂ (paratipo). Línea de escala: 5 mm.
Material tipo
Holotipo (♀ adulta): República del Ecuador, provincia El Oro, cantón Piñas, parroquia Moromoro en la Reserva Biológica Buenaventura (3° 38ʹ 47ʺ S, 79° 45ʹ 31ʺ O, 650 m de altitud), colectada el 18 de abril del 2012 por Mario Yánez-Muñoz, Marco Reyes-Puig, Gabriela Bautista, María Pérez y Miguel Alcoser (DHMECN9478). Paratipo (♂ subadulto): misma localidad (3°37ʹ53.47ʺ S, 79°45ʹ49.25ʺ O, 1059 m de altitud), colectado el 2 de agosto de 2015 por Dan Cogalniceanu (QCAZ14088).
Etimología
El epíteto específico es un sustantivo que hace referencia a su localidad tipo, la Reserva Biológica Buenaventura. Esta reserva es administrada por la Fundación Jocotoco y constituye una importante área de conservación en el suroccidente de Ecuador, que brinda refugio a especies endémicas de flora y fauna amenazadas de extinción [Citation42].
Diagnosis (n = 2)
Anadia buenaventura se caracteriza por la combinación de los siguientes caracteres: (1) talla mediana y cuerpo esbelto y alargado (LRC ♀: 52.8 mm, ♂: 61.8 mm; ); (2) escamas dorsales en 50–51 hileras transversales; (3) escamas ventrales en 34–36 hileras transversales; (4) escamas gulares en 13–14 hileras transversales; (5) escamas postparietales cuatro (); (6) pregulares entre último par de geneiales tres (); (7) poros femorales en hembras 1–2 y en machos 11; (8) ocelos difusos en hembras 2–4, ocelos marcados en machos 16–17 (); (9) dorso café con líneas dorsolaterales claras e hileras longitudinales de puntos oscuros dispuestos paravertebralmente (–)); (10) vientre crema con flecos cafés dispersos (); (11) hemipenes ligeramente alargados y bilobulados con papilas sobre cada lóbulo, apéndices de las papilas muy elongados, con 4–5 flecos espiculados en vista lateral ().
Figura 5. Anadia buenaventura sp. nov. (DHMECN9478, Holotipo). A vista dorsal. B vista ventral. Línea de escala: 5 mm.

Figura 6. Anadia buenaventura sp. nov. (DHMECN9478, Holotipo), coloración en vida. A y B diseño dorsal. C cabeza vista lateral. D diseño ventral y lateral. Línea de escala: 5 mm. (Fotografías: Mario Yánez-Muñoz).

Figura 7. Especies del género Anadia de Ecuador, coloración en preservado, vista dorsal. Anadia buenaventura sp. nov., A ♂ subadulto QCAZ14088, paratipo, B ♀ adulta DHMECN9478, holotipo. Anadia petersi, C ♂ subadulto QCAZ5068, D ♂ adulto QCAZ10087, E ♀ adulta DHMECN11260. Anadia rhombifera, F ♂ adulto QCAZ10556 (Pichincha), G ♂ adulto QCAZ11061 (Bolívar), H ♀ adulta, QCAZ11862 (Cotopaxi). Línea de escala: 10 mm.

Tabla 2. Comparación de caracteres morfológicos de Anadia buenaventura sp. nov., con otras especies de Anadia de Ecuador. Longitudes en mm, proporciones en %. * DHMECN9478 ♀ Holotipo; QCAZ14088 ♂ Paratipo.
Es una especie de cabeza angosta (53–57% de ancho y 39–45% de alto, en relación a la longitud de la cabeza), extremidades posteriores cortas (27% en relación a la LRC) y tímpano moderado (70% en relación al diámetro del ojo) ().
Comparaciones
Anadia buenaventura se diferencia de A. rhombifera por presentar cuatro escamas postparietales (cinco en A. rhombifera). Su diseño dorsal difiere de otras Anadia ecuatorianas, por presentar bandas dorsolaterales claras e hileras longitudinales de puntos oscuros dispuestos paravertebralmente, sobre un fondo café (uniforme o con marcas oscuras semiromboidales en A. rhombifera; uniforme o con bloques oscuros alternos en A. petersi; ); también se diferencia porque los machos presentan un mayor número de ocelos en los flancos, 16–17 (0–6 en A. rhombifera, 2–12 en A. petersi). Otras diferencias morfológicas entre las tres especies se presentan en la .
Anadia buenaventura pertenece al grupo “ocellata” definido por Oftedal [Citation19] por presentar escamas dorsales subhexagonales ligeramente imbricadas, prefrontales contactadas, escamas insertas entre supeciliares y supraoculares (0–1), ocelos laterales, escamas suboculares de tamaño variable que forman una protusión entre 4ta y 5ta supralabial y poros femorales reducidos en hembras (1–2) en relación a machos (11). Se distingue de otras especies del grupo “ocellata”, por presentar un menor número de escamas dorsales en hileras transversales, 50–51 (50–58 en A. ocellata, y 55–61 en A vittata).
Descripción del holotipo
Hembra adulta con una LRC de 52.8 mm y LC de 104.2 mm (completa) con cuerpo más ancho que alto. Cola de diámetro redondeado, aproximadamente del doble de longitud que la LRC. Patas pentadáctilas con todos los dígitos terminados en garras.
Cabeza con escamas lisas; escama rostral ancha, en contacto lateralmente con primera supralabial y separada de la escama nasal por escama frontonasal; frontonasal pentagonal con borde anterior ensanchado; sutura entre par de prefrontales moderada, prefrontales en contacto lateralmente con escama nasal, loreal y presuperciliar; frontal alargada, anteriormente más ancha y redondeada, en contacto lateralmente con 1ra y 2da supraocular; presupraocular y frontal no en contacto; frontoparietales pares en contacto lateralmente con 2da y 3ra supraocular; interparietal subhexagonal alargada; parietales en contacto anteriormente con frontoparietales y 3ra subocular; postparietales grandes, en número par (cuatro) y bordeando posteriormente a las parietales e interparietal ().
Escama nasal entera en contacto con escama loreal pentagonal; surco subnostrilar presente; escamas frenocular y presuperciliar contactadas; sin escama inserta entre hileras de superciliares y supraoculares; supraoculares 3; superciliares 3; borde inferior de 4ta subocular forma una protusión entre 4ta y 5ta supralabial; escamas palpebrales 5, alargadas verticalmente y semi transparentes; supralabiales 7, 4ta supralabial más grande, cubre el ancho de la órbita; escamas temporales de tamaño pequeño de forma semiredondeada; tímpano moderadamente grande y pigmentado de negro, ligeramente alargado dorso-ventralmente ().
Mental ancha, en contacto lateralmente con la primera infralabial y ventralmente con la postmental; infralabiales seis; postmental única en contacto con dos infralabiales a cada lado; tres pares de geneiales, último par separado por tres pregulares (una seccionada); escama pequeña alargada entre pregulares externas y última infralabial; escamas gulares medianas, redondeadas anteriormente y cuadrangulares cerca al collar, en 13 hileras transversales regulares; pliegue del collar evidente ().
Escamas dorsales en hileras transversales 51; escamas dorsales lisas, subhexagonales, con borde posterior redondeado y levemente imbricadas, ligeramente agrandadas en el tercio anterior del cuerpo; escamas en flancos lisas, cuadrangulares o semiredondeadas, yuxtapuestas, de similar tamaño que escamas dorsales (); escamas ventrales en diez hileras longitudinales y en 36 hileras transversales, lisas, cuadrangulares y ligeramente imbricadas; hileras de escamas dorsales, laterales y ventrales alrededor del cuerpo en su mayoría continuas; escamas alrededor del medio cuerpo 29.
Escamas braquiales anterodorsales hexagonales, grandes, lisas e imbricadas; braquiales posteroventrales redondeadas, de tamaño irregular, lisas y yuxtapuestas. Escamas antebraquiales posterodorsales poligonales, grandes, lisas e imbricadas; antebraquiales anteroventrales romboidales, grandes, lisas y subimbricadas. Escamas de la superficie dorsal de la mano poligonales, grandes, lisas y subimbricadas; escamas de la palma de las manos redondeadas, ligeramente convexas, más pequeñas que las dorsales, rugosas y yuxtapuestas; escamas tenares dos. Manos y pies pentadáctilos con todos los dígitos terminados en garras. Escamas de la superficie dorsal de los dedos lisas, cuadrangulares, imbricadas, lamelas supradigitales simples, tres en I, seis en II, siete en III, ocho en IV y seis en V; lamelas subdigitales simples, 4/5 en I, nueve en II, 11 en III, 11 en IV y 8/9 en V ().
Escamas preanales en dos hileras irregulares (2 + 4), sin poros preanales; escamas anales cinco; poros femorales 1/2 (♀) (). Escamas dorsales del muslo hexagonales, grandes, lisas y yuxtapuestas; escamas posteriores del muslo redondeadas, pequeñas, lisas y yuxtapuestas; escamas ventrales del muslo grandes, redondeadas, lisas y yuxtapuestas; escamas anteriores del muslo grandes, romboidales, lisas e imbricadas. Escamas anterodorsales del crus medianas, poligonales, lisas y subimbricadas; escamas posteroventrales del crus grandes, romboidales, lisas e imbricadas. Escamas de la superficie dorsal del pie poligonales, grandes, lisas y subimbricadas; escamas de la planta del pie redondeadas, pequeñas, más grandes en la parte distal, rugosas y yuxtapuestas. Escamas de la superficie dorsal de los dedos de los pies cuadrangulares, lisas; lamelas supradigitales simples, 3/4 en I, seis en II, nueve en III, 10/11 en IV y ocho en V; lamelas subdigitales simples, siete en I, 10 en II, 12 en III, 15 en IV y 14 en V (). Escamas caudales y subcaudales rectangulares lisas, más angostas distalmente, ordenadas en hileras transversales y longitudinales regulares.
Coloración en vida del holotipo
Cabeza delineada por franjas longitudinales laterales de color crema que continúan hacia el dorso formando franjas dorsolaterales; marca oscura triangular difusa sobre la cabeza que se extiende hacia el dorso formando dos hileras paravertebrales de puntos negros. Iris cobrizo. Región dorsal del cuerpo café, con marcas café oscuras y negras dispersas. Pequeña línea vertebral café que se extiende desde la región postparietal hasta el nivel de la inserción de los brazos. Cola con diseño de rombos unidos a nivel vertebral, con marcas negras dispersas. Franjas dorsolaterales de color crema que se extienden desde las escamas prefrontales, a lo largo de todo el cuerpo, hasta difuminarse en la cola. Franja café oscura que se extiende desde el nostrilo hasta la cola, con 2-4 ocelos difusos en cada flanco ( y 6). Superficie dorsal de las extremidades café oscuro con marcas claras irregulares. Región labial, mentón, garganta y tercio anterior del vientre crema uniforme; ⅔ posteriores del vientre crema con flecos cafés dispersos hacia los lados. Superficie ventral de la cola crema con marcas irregulares oscuras, algunas formando hileras subcaudales laterales. Superficie ventral de extremidades crema, con pigmento café oscuro en cada lamela digital.
Coloración en preservado
Las tonalidades cafés del diseño en vida se tornan grisáceas en los ejemplares preservados ().
Variación
Individuo macho (QCAZ14088) con las siguientes variaciones: ocho supralabiales, siete infralabiales, cuatro superciliares, una escama inserta entre superciliares y supraoculares, nasal en contacto con rostral, 11 poros femorales en cada extremidad y presencia de 16–17 ocelos bien definidos en los flancos ().
La coloración del ejemplar macho es café cenizo con líneas dorsolaterales de color crema que se extienden hasta la cola. Las líneas dorsolaterales están limitadas internamente en la parte anterior por una fina línea oscura hasta la mitad del dorso. Línea oscura vertebral desde escamas occipitales hasta décimo cuarta hilera transversal. Marcas oscuras pequeñas difuminadas sobre el dorso, cola y cabeza. Franja oscura lateral, desde el ojo hasta la ingle con ocelos en cada flanco. Labiales, mentón, garganta, pecho, vientre y región subcaudal color crema con puntillos cafés dispersos por toda la superficie.
El dimorfismo sexual en Anadia buenaventura está definido por el número de poros femorales (1–2 en ♀ y 11 en ♂), la presencia de ocelos bien definidos en machos (2–4 difusos en ♀; 16–17 en ♂) ( y ) y una mayor proporción del tamaño de la cabeza en machos en relación al alto/longitud (39% en ♀ y 45% en ♂) y ancho/longitud (53% en ♀ y 57% en ♂).
Morfología hemipenial (QCAZ14088)
El cuerpo del hemipene derecho mide 6 mm de longitud y 4 mm en su punto más ancho; al expandirlo sus papilas apicales no se evertieron completamente; en el lado asulcado y lateral las estructuras están mejor definidas que en su órgano homólogo. El hemipene izquierdo mide 5.5 mm de longitud y 3.5 mm en su punto más ancho; fue completamente evertido y expandido, sin embargo, no muestra definición en las estructuras laterales y del lado asulcado. Con base en los dos órganos observamos que el hemipene es más largo que ancho, de base cónica y simétricamente bilobulado, con papilas ubicadas medialmente en el extremo distal de cada lóbulo, cada papila tiene una proyección terminal muy elongada, a la que denominamos apéndice. La región medial y distal del lado sulcado es ligeramente rugosa; el surco espermático se ubica medialmente, definido por un borde dérmico a cada lado, el espacio de piel entre los bordes es ligeramente rugoso; el surco se bifurca en la región apical dirigiéndose diagonalmente hacia los lóbulos ().
Figura 8. Hemipenes de Anadia, de izquierda a derecha: lado sulcado (solo en A de los dos hemipenes); vista lateral (lado sulcado a la izquierda); lado asulcado y vista apical . A Anadia buenaventura sp. nov. (QCAZ14088, subadulto, paratipo). B. Anadia petersi (QCAZ5068, adulto). C Anadia rhombifera (QCAZ10556, adulto). Línea de escala: 2 mm.
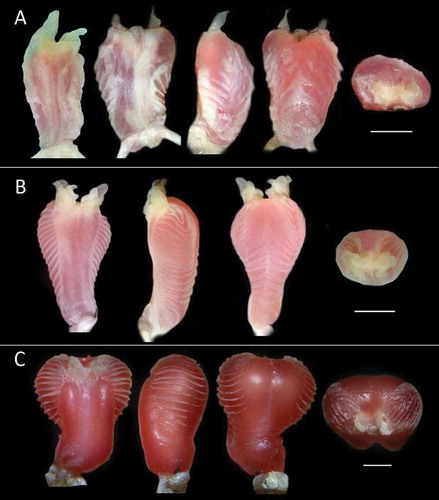
El lado asulcado presenta una textura de la piel ligeramente rugosa, con 4–5 flecos espiculados en forma de chevrón desde la región proximal hasta la región medial del órgano, extendiéndose débilmente hacia los lados y contactando el borde dérmico del surco espermático. El hemipene en vista lateral presenta cuatro flecos espiculados en forma de chevrón invertido, que se extienden a la región apical del lóbulo ().
Las papilas cubren la superficie sulcada en el extremo distal de cada lóbulo, el apéndice elongado de cada papila está constituido por tejido blando; hacia la parte posterior del órgano las papilas cubren parcialmente la superficie de los lóbulos; dichas papilas alcanzan hasta 2 mm de longitud desde la base del lóbulo; basalmente las papilas están conectadas entre sí por tejido blando ().
Apicalmente no se observan estructuras complejas ni definidas, identificándose principalmente los apéndices de la papila y el surco espermático ().
Distribución e historia natural
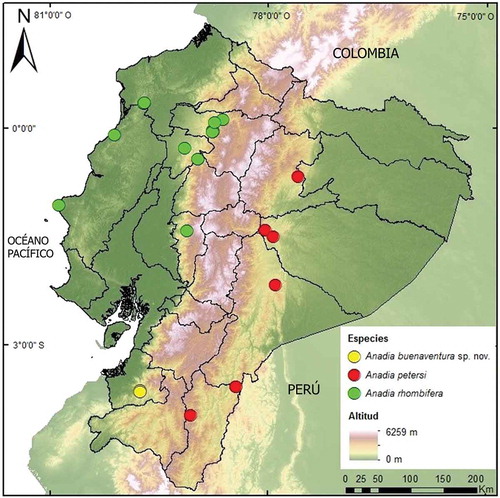
Anadia buenaventura es conocida únicamente de su localidad tipo en la Reserva Biológica Buenaventura, ubicada en las estribaciones suroccidentales de los Andes de Ecuador, en la provincia de El Oro (). El hábitat corresponde al ecosistema bosque semideciduo piemontano de Catamayo-Alamor [Citation43], caracterizado por la presencia de árboles de hasta 20 m de altura, abundantes arbustos y hierbas que en temporada lluviosa crecen sobre laderas en suelos pedregosos [Citation44]. El holotipo fue colectado en el día a nivel del suelo en el interior de la Estación Científica de la Reserva, sitio rodeado por bosque secundario. Otros saurios reportados en simpatría con Anadia buenaventura incluyen a Amphisbaena fuliginosa, Alopoglossus festae, Enyalioides touzeti, Anolis binotatus, Anolis fasciatus, Anolis fraseri, Holcosus septemlineatus y Stenocercus iridescens [Citation42].
Figura 9. Mapa de distribución de especies del género Anadia en Ecuador. Las localidades están basadas en especímenes depositados en el QCAZ y DHMECN (Material Examinado), bibliografía (Oftedal, 1974) y material fotográfico referido en el manuscrito.
Anadia petersi Oftedal, 1974
Anadia ocellata (erróneo) Peters [Citation45,p.121–133]
Anadia petersi Oftedal [Citation19,p.226–229] (Holotipo: USNM 193,221, San Ramón cerca de Loja, Ecuador)
Diagnosis
Anadia petersi se caracteriza por la combinación de los siguientes caracteres: (1) talla grande y cuerpo esbelto (LRC máximo ♀: 69.1 mm; ♂: 74.3 mm); (2) escamas dorsales en 48–56 hileras transversales; (3) escamas ventrales en 30–36 hileras transversales; (4) escamas gulares en 14–17 hileras transversales; (5) escamas postparietales cuatro, usualmente alguna segmentada (); (6) pregulares entre último par de geneiales 2–3 (); (7) poros femorales 9–12 en machos y 1–7 en hembras; (8) ocelos en hembras 3–6, ocelos en machos 2–12; (9) dorso café sin marcas o con bloques oscuros transversales cortos, líneas dorsolaterales claras difusas ( y 10); (10) vientre crema uniforme usualmente con flecos grises hacia los lados (); (11) hemipenes alargados, ligeramente bilobulados con papilas sobre cada lóbulo, apéndices de las papilas elongados, con 15 flecos espiculados en vista lateral ().
Figura 10. Anadia petersi. Coloración en vida. A ♀ adulta (DHMECN11260) vista dorsal. B-C ♂ sub-adulto (DHMECN11259) vista dorsal y ventral. D-E registros en la provincia de Pastaza, no colectados, D ejemplar fotografiado en la Reserva El Anzu, E ejemplar fotografiado en Veracruz. Línea de escala: 5 mm. (Fotografías: A-C Raquel Betancourt, D Juan Pablo Reyes; E Luis Oyagata).

Comparaciones
Anadia petersi se diferencia de A. rhombifera por tener cuatro escamas postparietales (cinco en A. rhombifera) ( y 3). Se diferencia de A. buenaventura por tener un diseño dorsal café, sin marcas o con bloques oscuros transversales cortos y alternos, con líneas dorsolaterales claras difusas (dorso café con líneas dorsolaterales claras muy marcadas e hileras longitudinales de puntos negros en A. buenaventura; ); los machos de A. petersi poseen 2–12 ocelos en los flancos (0–6 en A. rhombifera, 16–17 en A. buenaventura). Otras diferencias morfológicas entre las tres especies se presentan en la .
Anadia petersi se diferencia de otras especies del grupo “ocellata” por tener un menor número de escamas dorsales, 48–56 (55–61 en A. ocellata, y 50–58 en A vittata; Oftedal [Citation19]).
Descripción
Anadia petersi es una especie de cabeza angosta (51–55% de ancho y 33–40% de alto, en relación a la longitud de la cabeza), extremidades posteriores de longitud media (32–37% en relación a la LRC) y tímpano relativamente grande (60–90% en relación al diámetro del ojo) (). Las escamas dorsales son subhexagonales, lisas, imbricadas y con borde posterior redondeado. Las escamas ventrales son lisas, cuadrangulares y ligeramente imbricadas. Otros caracteres morfológicos son presentados en la .
Coloración en vida
La coloración dorsal de fondo varía de marrón-oliva a grisáceo, con o sin diseño de bloques oscuros transversales cortos y alternos. Algunos ejemplares poseen marcas oscuras en la superficie dorsal de la cabeza y cola ( y)) ( y)). Tres ejemplares machos presentan franjas dorsolaterales claras tenues; un ejemplar hembra evidencia marcas dorsolaterales anaranjadas desde la mitad del cuerpo hasta la cola (). Flancos con franja lateral marrón oscura o tenue que se extiende hasta la ingle y es más oscura desde el nostrilo hasta la inserción del antebrazo; algunos ejemplares carecen de esta franja y tienen el flanco bicolor, combinando la coloración dorsal y ventral; ocelos evidentes desde la base del antebrazo hacia atrás (). Vientre, región gular, mentón y región labial de color crema uniforme, usualmente amarillento hacia la punta del hocico, en la región abdominal y anal (); algunos ejemplares tienen flecos grises hacia los lados del vientre. La región ventral de los muslos es crema uniforme; las palmas y plantas de manos y pies son marrón amarillento.
Coloración en preservado
En los ejemplares preservados la coloración dorsal marrón se torna grisácea a verdosa, las marcas anaranjadas cambian a verde oliva con barras negras cortas y alternas; franja lateral marrón o grisácea (); región gular, mentón y escamas labiales crema uniforme; vientre gris o con tonalidades verde tornasolado. Las palmas y plantas de manos y pies son marrón oscuro.
Morfología hemipenial (QCAZ5068)
El cuerpo del hemipene izquierdo mide 5.9 mm de longitud y 3.5 mm en su punto más ancho, completamente expandido y evertido. El cuerpo del hemipene es más largo que ancho, ligeramente bilobulado y globoso hacia el extremo distal, con papilas ubicadas medialmente en cada lóbulo, tiene un apéndice elongado en cada papila. La región medial y distal del lado sulcado es lisa, y la porción proximal ligeramente rugosa; el surco espermático se ubica medialmente y se bifurca diagonalmente hacia la base de las papilas de los lóbulos ().
El lado asulcado posee una textura de piel ligeramente rugosa, con 12–13 flecos espiculados en forma de chevrón desde la región proximal hasta la región distal del órgano, extendiéndose hacia los lados del órgano y contactando el borde dérmico del surco espermático; presenta una superficie redondeada de piel desnuda limitada a la inserción de los lóbulos. El hemipene en vista lateral presenta 15 flecos espiculados en forma de chevrón invertido, que se extienden a la región apical del lóbulo y contactan con el apéndice elongado de cada papila de los lóbulos ().
Las papilas cubren la porción más distal de la superficie sulcada de los lóbulos y tienen apéndices elongados constituidos por tejido blando; dichas papilas alcanzan hasta 1,2 mm de longitud desde la base del lóbulo; las papilas están conectadas entre sí transversalmente por tejido blando; lateralmente las papilas exhiben estructuras a manera de oreja ().
Apicalmente se identifican los apéndices de las papilas, el surco espermático y los flecos espiculados laterales de cada lóbulo ().
Distribución e historia natural
Cuatro especímenes han sido colectados en tres nuevas localidades para la especie; en el sector de Tundayme, cordillera del Cóndor, Zamora Chinchipe (DHMECN11259–60); en Nuevo Israel, cordillera de Kutucú, Morona Santiago (QCAZ10087) y en la Estación Biológica WildSumaco, en las estribaciones orientales de los Andes, provincia de Napo (QCAZ5068). Estas localidades amplían el rango de distribución de la especie 400 km al nororiente de la localidad tipo reportada por Oftedal [Citation19] en San Ramón, provincia de Loja ().
Dos ejemplares adicionales han sido fotografiados en las localidades Reserva Ecológica El Anzu y Veracruz, en la provincia de Pastaza (). Los patrones de coloración y escamación cefálica de estos ejemplares coinciden con lo descrito para A. petersi, por lo cual se ha decidido hacer referencia de este material.
Anadia petersi habita en bosque siempreverde piemontano, montano bajo y montano, en las estribaciones orientales de los Andes y en cordilleras subandinas del centro y suroriente de Ecuador (cordillera del Cóndor y Kutucú), en las provincias de Napo, Pastaza, Morona Santiago, Loja, Zamora Chinchipe, en una amplitud altitudinal de 950–2200 m.
Los ejemplares de Tundayme fueron colectados durante el día en restos de vegetación en bosque maduro recién talado, ubicado en laderas de formaciones de “tepuy” (mesetas de arenisca) características de la cordillera del Cóndor. Una hembra adulta (DHMECN11260) con dos huevos desarrollados, fue colectada en el mes de marzo. En general Anadia petersi es una especie muy poco frecuente, simpátrica con otros gimnoftálmidos como Alopoglossus buckleyi, Potamites strangulatus y Euspondylus guentheri.
Comentarios
Algunas variaciones morfológicas se observan en el ejemplar proveniente de Napo (QCAZ5068), el cual presenta escamas nasal y rostral en contacto, escama presupraocular y surco subnostrilar. Es además el único ejemplar examinado que no posee diseño de coloración dorsal con marcas oscuras, afín a uno de los ejemplares de la colección tipo [Citation19] y a un ejemplar fotografiado en Pastaza.
Anadia rhombifera (Günther, 1859)
Cercosaurus rhombifer Günther [Citation18,p.405–407] (Holotipo: BMNH 1946.9.1.4, W. Ecuador, ♀ adulta).
Ecpleopus (Euspondylus) rhombifer; Peters [Citation46,p.208–209]
Leposoma rhombiferum Cope [Citation47,p.98]
Anadia rhombifera Boulenger [Citation48,p.399]; Peters & Donoso-Barros [Citation49,p.41]; Oftedal [Citation19,p-223–226]
Diagnosis
Anadia rhombifera se caracteriza por la combinación de los siguientes caracteres: (1) talla mediana y cuerpo esbelto (LRC máximo ♀: 69.4 mm; ♂: 69.8 mm); (2) escamas dorsales en 44–50 hileras transversales; (3) escamas ventrales en 29–32 hileras transversales; (4) escamas gulares en 11–13 hileras transversales; (5) escamas postparietales cinco (); (6) pregulares entre último par de geneiales dos (); (7) poros femorales 8–15 en machos y 0–2 en hembras (una hembra con 7); (8) ocelos ausentes en machos y hembras (solo un macho presentó 4–5 ocelos) (); (9) dorso café o grisáceo uniforme (♂ y ♀) o con bloques oscuros irregulares (♀) ( y 9); (10) vientre claro, a menudo con flecos cafés dispersos hacia los lados; (11) hemipene ligeramente alargado, bilobulado y globoso, con papilas pequeñas ubicadas medialmente en el lado sulcado de cada lóbulo, y con 12 flecos en vista lateral ().
Comparaciones
Anadia rhombifera se diferencia de A. buenaventura y A. petersi por presentar cinco escamas postparietales (cuatro postparietales en ambas especies; y 3). También se diferencia de A. buenaventura porque su diseño dorsal es uniforme o presenta marcas oscuras semiromboidales grandes (diseño con líneas dorsolaterales claras e hileras longitudinales de puntos negros en A. buenaventura; ); los machos de A. rhombifera poseen un menor número de ocelos en los flancos, 0–6 (2–12 en A. petersi, 16–17 en A. buenaventura). Otras diferencias morfológicas entre las tres especies se presentan en la .
Anadia rhombifera se diferencia de otras especies del grupo “ocellata” por su menor conteo de escamas dorsales, 43–50 (55–61 en A. ocellata, y 50–58 en A vittata; Oftedal [Citation19]).
Descripción
Anadia rhombifera es una especie de cabeza relativamente grande (57–62% de ancho y 42–56% de alto, en relación a la longitud de la cabeza), extremidades posteriores de longitud media (32–35% en relación a la LRC) y tímpano pequeño (40–60% en relación al diámetro del ojo). Las escamas dorsales son subhexagonales, lisas, con borde posterior redondeado y ligeramente imbricado. Las escamas en el vientre son lisas, cuadrangulares a veces rectangulares y generalmente yuxtapuestas. Otros caracteres morfológicos se presentan en la .
Coloración en vida
La coloración en vida fue descrita por Oftedal [Citation19] y Arteaga et al. [Citation50]; a continuación presentamos nuevos datos.
Se observan tres patrones de coloración dorsal en ejemplares adultos: (1) dorso marrón grisáceo uniforme, flancos bicolor combinando coloración dorsal y ventral (♂ y ♀; ); (2) dorso marrón grisáceo oscuro o claro uniforme, flancos con franja oscura o tenue que se extiende desde el borde posterior de la apertura auditiva hasta la ingle (♂ y ♀; ); (3) dorso marrón claro con marcas oscuras grandes semi-romboidales a nivel vertebral, que se extienden de manera irregular hacia los flancos, flancos con marcas irregulares difusas (♀; ). Únicamente un macho juvenil presenta ocelos marcados y líneas dorsolaterales tenues.
El patrón de la coloración sobre la cola consiste en marcas romboidales longitudinales, tenues en los patrones (1) y (2), y oscuras en el diseño (3) ( y 11). El vientre es blanco o crema con pigmentación oscura dispersa hacia los lados; la región gular y mentón son crema uniforme, con o sin marcas oscuras a los lados de la garganta; y la región labial (infra y supralabiales) es crema con marcas marrones dispersas. La superficie ventral de los muslos, palmas y plantas de manos y pies es crema con marcas oscuras.
Morfología hemipenial (QCAZ10556)
El cuerpo del hemipene izquierdo mide 9 mm de longitud y 7 mm en su punto más ancho, expandido y evertido totalmente. El órgano es ligeramente más largo que ancho, de base cónica y simétricamente bilobulado, con papilas pequeñas, poco desarrolladas, ubicadas medialmente en el lado sulcado de los lóbulos. El surco espermático se ubica medialmente, definido por dos bordes gruesos paralelos separados entre sí por espacio de piel desnuda, que se dirigen hacia la región medial de los lóbulos; en la región medial del órgano se observan 11–13 flecos espiculados, que rodean los lóbulos hasta la región medial en el lado asulcado ().
En el lado asulcado se evidencian dos porciones del órgano, una parte inferior definida como el tronco, la cual está separada de la porción superior por la presencia de flecos espiculados continuos hacia el lado sulcado; en la región distal los lóbulos están bien definidos por un surco medial; la textura del lado asulcado se compone de piel desnuda en la mayor parte de los lóbulos y de los espacios que separan los flecos espiculados. Lateralmente presenta 12 flecos espiculados que rodean transversalmente al tronco y lóbulos hasta la región medial del lado sulcado y del lado asulcado ().
Apicalmente se identifican los flecos espiculados laterales de los lóbulos, y en el centro el tejido blando de las papilas y el surco espermático ().
Distribución e historia natural
Los registros publicados de Anadia rhombifera en Colombia incluyen el piedemonte del noreste de los Andes centrales, así como el noroccidente y sur de los Andes occidentales en los departamentos de Antioquia, Santander, Boyacá, Quindío y Huila, entre 0 y 1760 m de altitud [Citation16,Citation20].
En Ecuador, la especie habita en bosque piemontano y montano bajo, en las estribaciones occidentales de los Andes; en las provincias de Pichincha, Santo Domingo de los Tsáchilas, Cotopaxi y Bolívar [Citation19,Citation50]. Existen además registros en bosque siempreverde de tierras bajas del Chocó, en la provincia de Esmeraldas [Citation51] y en bosque semideciduo de Manabí. Oftedal [Citation19] reporta ejemplares de la vertiente Amazónica (KU142754–60), provenientes de Río Verde en Tungurahua (ver Discusión). La especie habita entre 335 y 1600 m de altitud ().
Algunos aspectos sobre la historia natural de Anadia rhombifera son detallados por Oftedal [Citation19] y Arteaga et al. [Citation50]. En general, es una especie poco común, de hábitos diurnos y arborícolas, que eventualmente es encontrada a nivel del suelo. Ha sido registrada en claros de bosque, pastizales y áreas abiertas rodeadas por ambientes forestales. En las localidades de Bilsa, Mindo y Las Tolas, la especie ha sido reportada en simpatría con Alopoglossus festae, Echinosaura horrida, E. keyi y Pholidobolus vertebralis [Citation50–Citation52].
Comentarios
Los ejemplares de tierras bajas en Manabí y Esmeraldas no difieren significativamente en cuanto a conteo de escamas de los especímenes de otras localidades de mayor altitud; sin embargo, presentan variaciones como la presencia de poros femorales en hembras (QCAZ11510) y la presencia de ocelos en machos (DHMECN3646) (ver Discusión).
Los reportes provenientes de Los Ríos, Guayas, Chimborazo y Cañar en Ecuador, citados en Vanegas-Guerrero et al. [Citation20], deben ser ratificados ya que al parecer carecen de vouchers que validen su identidad; y aquellos reportados para El Oro (Buenaventura) [Citation42,Citation53], corresponden a la especie nueva descrita en este manuscrito.
Discusión
Los registros del género Anadia en Ecuador son muy escasos, lo que dificulta en gran medida su investigación. El hábito semi-arborícola y arborícola de las especies ha limitado significativamente la colección de especímenes, haciendo que su biología y estado de conservación sean aún muy poco conocidos. La mayoría de colecciones se han realizado de manera casual a nivel del suelo o estratos bajos, incluso después de procesos de tala; no se han realizado exploraciones puntuales en estratos medios o altos para definir aspectos básicos de la historia natural de estas especies. Es así que el presente estudio incorpora material representativo de la mayor parte de poblaciones del género Anadia presentes en el Ecuador, que han permitido evaluar sus límites de variabilidad morfológica y genética.
Los análisis filogenéticos presentados por Torres-Carvajal et al. [Citation11] y Sánchez-Pacheco et al. [Citation12] identifican a Anadia como el taxón hermano del clado formado por Macropholidus y Pholidobolus. En ambos estudios, A. mcdiarmidi Kok & Rivas [Citation25] (especie venezolana) se ubicó fuera de Anadia, por lo cual Sánchez-Pacheco et al. [Citation12] reubicaron a esta especie dentro del género Oreosaurus. El análisis actual determina que Anadia buenaventura es el taxón hermano del clado formado por las especies hermanas A. petersi y A. rhombifera.
Es importante resaltar que los linajes que componen las poblaciones ecuatorianas asignadas como A. rhombifera podrían representar un complejo de especies al exhibir una amplia variabilidad genética, que podría corresponder por lo menos a dos linajes evolutivos independientes; por un lado las poblaciones provenientes de bosques piemontanos occidentales entre Pichincha y Cotopaxi y por otro, las poblaciones de bosque de tierras bajas y piemontanos entre Esmeraldas, Manabí y Bolívar. Al no contar con material genético de las poblaciones colombianas, el grado de incertidumbre sobre el estatus taxonómico de la especie es alto, por lo cual decidimos tratar a la especie como Anadia rhombifera sensu lato.
A pesar de identificar esta variabilidad genética en las poblaciones de Anadia rhombifera del occidente de Ecuador, no se encontraron evidencias morfológicas concretas en los especímenes examinados para separarlas como especies distintas. No obstante, se observaron variaciones discretas en algunas poblaciones; así, una hembra juvenil proveniente de Manabí (QCAZ11510) posee poros femorales, ausentes en hembras de otras localidades; y un ejemplar macho juvenil proveniente de Esmeraldas (DHMECN3646), posee ocelos en los flancos y líneas dorsolaterales claras, ausentes en especímenes de otras localidades de Ecuador, pero presentes en poblaciones de Colombia [Citation19,Citation20]. Se sugiere que futuros estudios que decidan resolver el estatus taxonómico de A. rhombifera (sensu lato), incorporen mayor información morfológica y genética de poblaciones colombianas y ecuatorianas.
Anadia rhombifera es una especie restringida a la costa Pacífica y estribaciones occidentales de los Andes. Sin embargo, Oftedal [Citation19] también reporta a esta especie para la vertiente oriental de los Andes en Río Verde, provincia de Tungurahua, basado en una serie de especímenes depositados en la colección del Museo de Historia Natural de la Universidad de Kansas (KU). Desafortunadamente estos especímenes no pudieron ser localizados y por lo tanto, no fueron examinados. Sin embargo, material fotográfico disponible de dos localidades cercanas a Río Verde en la cuenca alta del río Pastaza, permiten presumir que los patrones de escamación cefálicos (número de escamas postparietales) y de coloración dorsal de estas poblaciones son más cercanos a A. petersi que a A. rhombifera. Por lo cual se sugiere que las poblaciones de las estribaciones orientales de los Andes, entre las provincias de Napo y Zamora Chinchipe, corresponden a A. petersi.
El análisis de las características morfológicas externas de las especies del género Anadia de Ecuador (A. buenaventura, A. petersi y A. rhombifera), sugieren su inclusión dentro del grupo “ocellata” (sensu Oftedal [Citation19]) por presentar escamas dorsales subhexagonales ligeramente imbricadas (cuadrangulares y yuxtapuestas en grupos: “steyeri”, “bitaeniata” y “marmorata”). A diferencia de las especies ecuatorianas, el grupo “bogotensis” presenta escamas dorsales y ventrales notoriamente imbricadas [Citation19]. Sin embargo, la validez de los grupos propuestos por Oftedal todavía es cuestionable. Por ejemplo, el análisis de la morfología hemipenial realizado en especies pertenecientes al grupo “bitaeniata” y “steyeri”, no ha detectado un patrón robusto para consolidar los grupos propuestos por Oftedal [Citation16]. Asimismo, A. pariaensis Rivas et al. [Citation17] no ha sido asignada a ningún grupo debido a su morfología hemipenial única [Citation17], situación similar a la que ocurría con A. mcdiarmidi en su descripción original [Citation25], aunque esta especie fue recientemente asignada al género Oreosaurus Peters [Citation12,Citation46].
Se observaron diferencias notorias en los hemipenes de Anadia rhombifera y A. petersi, comparados con algunas especies asignadas a los grupos “bitaeniata” y “steyeri” (e.g., A. altaserrania, A. antioquensis, A steyeri). Los hemipenes de las especies ecuatorianas poseen una forma ensanchada y globosa hacia la parte distal del órgano (similar a lo graficado para A. ocellata por Myers et al. [Citation26]), mientras que los hemipenes de las especies citadas poseen una forma regular y alargada desde el tronco hacia los lóbulos [Citation16,Citation17,Citation22].
Los hemipenes de Anadia rhombifera y A. petersi se diferencian de los de A. ocellata porque presentan un tronco hemipenial mucho más alargado y la papilas del extremo de cada lóbulo son más pequeñas, según lo descrito por Myers et al. [Citation26]. Anadia petersi posee un área desnuda en el lado asulcado limitada a la inserción de los dos lóbulos, los apéndices de las papilas son más alargados y delgados y los flecos espiculados laterales son menos definidos; en A. rhombifera la superficie desnuda en el lado asulcado es ancha y se ubica desde la mitad distal hasta la unión de los lóbulos, los apéndices de las papilas son cortos y gruesos y los flecos laterales son bien definidos.
En Anadia buenaventura, los hemipenes analizados pertenecen a un ejemplar subadulto; fueron evertidos y parcialmente expandidos, lo que dificultó la definición clara de sus estructuras [Citation30]. Sin embargo, se evidencia que su morfología difiere de otras especies ecuatorianas al tener papilas con apéndices muy elongados sobre cada lóbulo, una forma semiglobosa hacia el extremo distal, un tronco hemipenial moderado y un menor número de flecos espiculados. Debido a que las estructuras no están bien definidas en la preparación, es necesario contar con material de ejemplares adultos de la nueva especie para definir mejor su morfología hemipenial.
Consideramos que los grupos propuestos por Oftedal [Citation19] están sujetos a comprobación, y deberían ser considerados grupos putativos, hasta contar con evidencias integrativas que amplíen muestreos genéticos asociados a datos morfológicos a escala regional, para dilucidar la composición, relaciones filogenéticas y límites de especies dentro del género Anadia
Associate Editor: Mauricio Ortega
Acknowledgments
Agradecemos a Fernando Ayala, Diego Paucar y Santiago Guamán quienes prestaron las facilidades necesarias durante el trabajo de laboratorio (QCAZ). Alejandro Arteaga (Tropical Herping), Juan Pablo Reyes-Puig, Luis Oyagata y Ricardo Elbay colaboraron gentilmente con material fotográfico de ejemplares en vida y hemipenes. Rafe Brown, curador de herpetología del Museo de Historia Natural de la Universidad de Kansas (KU), nos ayudó en la indagación sobre los especímenes de Anadia rhombifera de Tungurahua.
Los especímenes fueron colectados bajo los permisos de investigación: 001-10 IC-FAU-DNB/MA, 001-11 IC-FAU-DNB/MA, 005-12 IC-FAU-DNB/MA, 003-14 IC-FAU-DNB/MA, 003-17-IC-FAU-DNB/MA, 005-2009-INVESTIGACIÓN-B-DPMS/MAE y N°007-IC-FAU/FLO-DPZCH-MA; emitidos por el Ministerio del Ambiente del Ecuador.
Disclosure statement
No potential conflict of interest was reported by the authors.
Additional information
Funding
References
- Sánchez-Pacheco SJ, Aguirre-Peñafiel V, Torres-Carvajal O. Lizards of the Genus Riama (Squamata: gymnophthalmidae): the Diversity in Southern Ecuador Revisited. S Am J Herpetol. 2012;7(3):259–275.
- Aguirre-Peñafiel V, Torres-Carvajal O, Sales Nunes PM, et al. A new species of Riama Gray, 1858 (Squamata: gymnophthalmidae) from the Tropical Andes. Zootaxa. 2014;3866(2):246–260.
- Goicoechea N, Padial JM, Chaparro JC, et al. A taxonomic revision of Proctoporus bolivianus Werner (Squamata: gymnophthalmidae) with the description of three new species and resurrection of Proctoporus lacertus Stejneger. Amer Mus Novitates. 2013;3786:1–32.
- Chávez G, Catenazzi A, Venegas PJ. A new species of arboreal microteiid lizard of the genus Euspondylus (Gymnophtalmidae: cercosaurinae) from the Andean slopes of central Peru with comments on Peruvian Euspondylus. Zootaxa. 2017;2:301–316.
- Torres-Carvajal O, Venegas PJ, Lobos SE, et al. A new species of Pholidobolus (Squamata: gymnophthalmidae) from the Andes of southern Ecuador. Amphib Reptile Conserv. 2014;8(1):76–88.
- Venegas PJ, Echevarría LY, Lobos SE, et al. A new species of Andean microteiid lizard (Gymnophthalmidae: cercosaurinae: pholidobolus) from Peru, with comments on P. vertebralis. Amphib Reptile Conserv. 2016;10(1):21–33.
- Pellegrino KC, Rodrigues MT, Yonenaga-Yassuda Y, et al. A molecular perspective on the evolution of microteiid lizards (Squamata, Gymnophthalmidae), and a new classification for the family. Biol J Linnean Soc. 2001;74(3):315–338.
- Castoe TA, Doan TM, Parkinson CL. Data Partitions and Complex Models in Bayesian Analysis: the Phylogeny of Gymnophthalmid Lizards. Syst Biol. 2004;53(3):448–469.
- Goicoechea N, Padial JM, Chaparro JC, et al. Molecular phylogenetics, species diversity, and biogeography of the Andean lizards of the genus Proctoporus (Squamata: gymnophthalmidae). Mol Phylogenet Evol. 2012;65:953–964.
- Torres-Carvajal O, Lobos SE, Venegas PJ. Phylogeny of Neotropical Cercosaura (Squamata: gymnophthalmidae) lizards. Mol Phylogenet Evol. 2015;93:281–288.
- Torres-Carvajal O, Lobos SE, Venegas PJ, et al. Phylogeny and biogeography of the most diverse clade of South American gymnophthalmid lizards (Squamata, Gymnophthalmidae, Cercosaurinae). Mol Phylogenet Evol. 2016;99:63–75.
- Sánchez-Pacheco SJ, Torres-Carvajal O, Aguirre-Peñafiel V, et al. Phylogeny of Riama (Squamata: gymnophthalmidae), impact of phenotypic evidence on molecular datasets, and the origin of the Sierra Nevada de Santa Marta endemic fauna. Cladistics. 2017;2017:1–32.
- Uetz P, Freed P, Hošek J, editors. The Reptile Database [Internet]. 2018 [cited 2018 Mar 11]. Avaible from: http://www.reptile-database.org.
- Gray JE. Catalogue of the specimens of lizards in the collection of the British Museum. London: Trustees of die British Mus/Edward Newman; 1845.
- Kok PJ, Means DB, Rivas GA. First record of the genus Anadia (Reptilia: squamata: gymnophthalmidae) from Guyana based on an enigmatic specimen from Mount Kopinang, Wokomung Massif. Bol Mus Para Emilio Goeldi Cienc Nat. 2013;8(1):27–39.
- Arredondo JC. A new species of gymnophthalmid lizard of the genus Anadia (Gymnophthalmidae: cercosaurinae) from Northern Andes of Colombia. Amphib-Reptil. 2013;34(2):173–184.
- Rivas GA, Sales Nunes PM, Dixon JR, et al. Taxonomy, hemipenial morphology and natural history of two poorly known species of Anadia (Gymnophthalmidae) from northern. S Am J Herpetol. 2012;46(1):33–40.
- Günther A. Second list of cold-blooded vertebrata collected by Mr Fraser in the Andes of Western Ecuador. Ibidem. 1859;27:402–407.
- Oftedal OT. A revision of the genus Anadia (Sauria, Teiidae). Arq Zool. 1974;25(4):203–265.
- Vanegas-Guerrero J, Gómez-Hoyos DA, Gómez-López CM, et al. Reptilia, Sauria, Gymnophthalmidae, Anadia rhombifera (Günther, 1859): distribution extension and first records from Quindío department, Colombia. Check List. 2015;11(1):1512.
- Boulenger GA. On a collection of batrachians and reptiles made by Dr H.G. Spurrell,F.Z.S. in the Choco, Colombia. Proc Zool Soc. 1913;1913:1019–1038.
- Harris DM, Ayala S. A new Anadia (Sauria: teiidae) from Colombia and Restoration of Anadia pamplonensis Dunn to Species Status. Herpetologica. 1987;43(2):182–190.
- Kizirian DA. A review of Ecuadorian Proctoporus (Squamata: gymnophthalmidae) with descriptions of nine new species. Herpetol Monogr. 1996;10:85–155.
- Köhler G, Lehr E. Comments on Euspondylus and Proctoporus (Squamata: gymnophthalmidae) from Peru, with the description of three new species and a key to the peruvian species. Herpetologica. 2004;60:4.
- Kok PJ, Rivas GA. A new species of Anadia (Reptilia, Squamata) from the Venezuelan “Lost World”, northern South America. Eur J Taxon. 2011;3:1–18.
- Myers CW, Rivas GA, Jadin RC. New species of lizards from Auyantepui and La Escalera in the Venezuelan Guayana, with notes on “microteiid” hemipenes (Squamata: gymnophthalmidae). Amer Mus Novitates. 2009;3660:1–31.
- de-Queiroz K. The general lineage concept of species, species criteria and the process of speciation. En. Howard DJ, Berlocher SH editores. Endless Forms. Species and Speciation. Oxford (UK): Oxford University Press; 1998. 57–75.
- de-Queiroz K. Species concepts and species delimitation. Syst Biol. 2007;56::879–886.
- Pesantes O. A method for preparing hemipenis of preserved snakes. J Herpetol. 1994;28:93–95.
- Myers CW, Cadle JE. A new genus for South American snakes related to Rhadinaea obtusa (Colubridae) and resurrection of Taeniophallus Cope for the “Rhadinaea” brevirostris group. Amer Mus Novitates. 1994;3102:1–33.
- Zaher H. Hemipenial morphology of the South American Xenodontine snakes, with a proposal for a monophyletic Xenodontinae and a reappraisal of Colubroid hemipenes. Bull Am Mus Nat Hist. 1999;240:1–168.
- Myers CW, Cadle JE. On the snake hemipenis, with notes on Psomophis and techniques of eversion: a response to Dowling. Herpetol Rev. 2003;34:295–302.
- Kearse M, Moir R, Wilson A, et al. Geneious Basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics. 2012;28:1647–1649.
- Katoh K, Toh H. Parallelization of the MAFFT multiple sequence alignment program. Bioinformatics. 2010;26:1899–1900.
- Lanfear R, Calcott B, Ho SY, et al. Partition-Finder: combined selection of partitioning schemes and substitution models for phylogenetic analyses. Mol Biol Evol. 2012;29:1695–1701.
- Ronquist F, Teslenko M, Van Der Mark P, et al. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space. Syst Biol. 2012;61::539–542.
- Rambaut A, Drummond AJ Tracer [Internet]. Version 1.4. UK; BEAST Software; 2007 [accessed 2015 Oct 30] Avaible from: http://beast.bio.ed.ac.uk/Tracer
- Pyron RA, Burbrink FT, Wiens JJ. A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. BMC Evol Biol. 2013;13:93.
- Goicoechea N, Frost DR, De La Riva I, et al. Molecular systematics of teioid lizards (Teioidea/Gymnophthalmoidea: squamata) based on the analysis of 48 loci under tree-alignment and similarity-alignment. Cladistics. 2016;2016:1–48.
- Rambaut A. FigTree [Internet]. Version 1.4.2. UK; BEAST Software; 2014 [accessed 2015 Oct 30] Avaible from: http://tree.bio.ed.ac.uk/software/figtree/
- Kumar S, Stecher G, Tamura K. MEGA7: molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets. Mol Biol Evol. 2016;33::1870–1874.
- Yánez-Muñoz MH, Morales-Mite M, Reyes-Puig M, et al. Reserva Biológica Buenaventura: entre la transición húmedo tropical y la influencia Tumbesina. En: Morales-Mite M, editor. Herpetofauna en áreas prioritarias para la conservación: el sistema de reservas Jocotoco y Ecominga. Quito: MECN/Ediecuatorial. (Serie de Publicaciones del MECN; 6). 2013. p. 63–76.
- Galeas R, Guevara J, Medina-Torres B et al. editores. Sistema de clasificación de los ecosistemas del Ecuador continental. Quito: Ministerio del Ambiente del Ecuador; 2013.
- Aguirre Z, Kvist LP. Composición florística y estado de conservación de los bosques secos del sur-occidente del Ecuador. Lyonia. 2005;8:41–67.
- Peters JA. Notas misceláneas sobre saurios del Ecuador. Cienc Nat. 1959;2(1118):124.
- Peters W. [About Cercosaura and the related lizards from South America]. Abh. K. Preuss. Akad Wiss. 1862;1862: 208–209. German.
- Cope ED. Catalogue of the species of batrachians and reptiles contained in a collection made at Pebas, Upper Amazon by John Hauxwell. Proc Am Philos Soc. 1885;23:98.
- Boulenger GA. Catalogue of the lizards in the British Museum (Natural History). Vol. I. London: Taylor & Francis. 1885;p. 399.
- Peters JA, Donoso-Barros R. Catalogue of the Neotropical Squamata: part II Lizards and Amphisbaenians. Washington (DC): Smithsonian Institution Press; 1970. p. 41.
- Arteaga A, Bustamante L, Guayasamin JM. The Amphibians and Reptiles of Mindo. Quito: Universidad Tecnológica Indoamérica; 2013. p. 127–129.
- Ortega-Andrade HM, Bermingham J, Aulestia C, et al. Herpetofauna of the Bilsa Biological Station, province of Esmeraldas, Ecuador. Check List. 2010;6(1):119–154.
- Museo Ecuatoriano de Ciencias Naturales (MECN). Guía de campo de los pequeños vertebrados del Distrito Metropolitano de Quito (DMQ). Quito: Imprenta Nuevo Arte; 2009. (Serie de Publicaciones del MECN; 5).
- Sánchez JC, Capítulo Y-M-M. VI Herpetofauna en, bosques piemontanos. En. Mena-Valenzuela P, Garzón-Santomaro C editores. Anfibios, reptiles y aves de la provincia de El Oro, una guía para Ecosistemas Marino Costeros. Quito: Graficarte; 2015. 113–119. (Serie de Publicaciones del MECN; 7).
Apéndice I Material Examinado
Anadia buenaventura, sp. nov. ECUADOR: EL ORO: Reserva Biológica Buenaventura (3° 38ʹ 47ʺ S, 79° 45ʹ31ʺ O, 650 m de altitud), DHMECN9478, holotipo; Reserva Biológica Buenaventura (3° 37ʹ 53.47ʺ S, 79° 45ʹ 49.25ʺ O, 1059 m) QCAZ14088, paratipo.
Anadia petersi. ECUADOR: NAPO: Wildsumaco Wildlife Sanctuary, Wildsumaco Biological Station, aproximadamente un km al sur de la comunidad Pacto Sumaco (0° 40ʹ 17.36ʺ S, 77° 35ʹ 54.82ʺ O, 1660 m), QCAZ5068; MORONA SANTIAGO: Comunidad Nuevo Israel, Cordillera del Kutukú (2° 9ʹ 54.0ʺ S, 77° 54ʹ 10.5ʺ O, 1289 m), QCAZ10087; ZAMORA CHINCHIPE: Subcuenca del río Wawayme, Tundayme, Cordillera del Cóndor (3° 34ʹ 33.01ʺ S, 78° 26ʹ 43.01ʺ O, 1059 m) DHMECN11259; Subcuenca del río Wawayme, Tundayme, Cordillera del Cóndor (3° 34ʹ 46.99ʺ S, 78° 26ʹ 22.13ʺ O, 1361 m) DHMECN11260.
Anadia rhombifera. ECUADOR: BOLÍVAR: Mulidiaguán, Río Verde (1° 25ʹ 11.03ʺ S, 79° 7ʹ 30.1ʺ O, 1305 m), QCAZ11061; COTOPAXI: San Francisco de la Pampas (0° 25ʹ 59.72ʺ S, 78° 58ʹ 0.24ʺ O, 1600 m) QCAZ3744; San Francisco de la Pampas (0° 25ʹ 59.99ʺ S, 78° 58ʹ 0ʺ O, 1600 m) QCAZ11862; PICHINCHA: Acceso principal a Mindo (0° 2ʹ 0.62ʺ S, 78° 45ʹ 56.32ʺ O) QCAZ10537; Hostería Yelow House, Mindo (0° 2ʹ 30.99ʺ S, 78° 45ʹ 34.99ʺ O) QCAZ10556, Mindo (0° 3ʹ 2.41ʺ S, 78° 46ʹ 18.77ʺ O, 1600 m) QCAZ1362; MANABÍ: Refugio Casa Martínez, Proyecto Ecoturístico Tres Bosques, Jama (0° 5ʹ 39.18ʺ S, 80° 7ʹ 15.65ʺ O, 489 m) QCAZ5782, (solo cola); Bosque de Pacoche (1° 4ʹ 0.3ʺ S, 80° 52ʹ 51.6ʺ O, 335 m) QCAZ11510; ESMERALDAS: Reserva Ecológica Bilsa, Estación Biológica Bilsa (0° 20ʹ 40.92ʺ S, 79° 42ʹ 38.34ʺ O, 528 m) QCAZ6873; Reserva Ecológica Bilsa (0° 21ʹ 3.37ʺ S, 79° 42ʹ 34.26ʺ O, 552 m) DHMECN3646.

