ABSTRACT
We describe a new glandular terrestrial frog of the Pristimantis (Anura: Craugastoridae) genus. The new species inhabits the high montane forests of the Cañar province in southern Ecuador. It differs from other terrestrial frogs by having a striking dark gray and red dorsal coloration, dorsal skin with a corrugated texture, a small tubercle on the eyelid and heel, absence of vomerine odontophores, and large glandular patches on the supratympanic area, arms and limbs. Our molecular analyses show that the new species is in a clade with P. orcesi and P. erythros. Based on our results, we redefine the orcesi group and suggest that it contains only three species (P. orcesi, P. erythros, and the new species); the group is diagnosed mainly by exhibiting conspicuous dermal macroglands on the head, body and legs.
RESUMEN
Describimos una nueva rana terrestre glandular del género Pristimantis (Anura: Craugastoridae), que habita en el bosque montano alto de la provincia del Cañar en el sur del Ecuador. La nueva especie se diferencia de otras ranas terrestres de los altos Andes por su llamativa coloración dorsal gris oscuro y rojo, piel del dorso con una textura corrugada, un diminuto tubérculo en el párpado y talón, ausencia de odontóforos vomerinos, y grandes parches glandulares en la zona supratimpánica, flancos y extremidades. Los análisis moleculares muestran que la nueva especie conforma un clado con P. orcesi y P. erythros. Con base en nuestros análisis, redefinimos el grupo orcesi, el cual contiene únicamente tres especies (P. orcesi, P. erythros y la nueva especie); el grupo se caracteriza por la presencia de macroglándulas cutáneas en la cabeza, cuerpo y extremidades.
PALABRAS CLAVE:
Introducción
El conjunto de especies Pristimantis orcesi, originalmente propuesto por Lynch [Citation1] con base en similitudes morfológicas externas, incluye a P. obmutescens [Citation2], P. orcesi [Citation3], P. racemus [Citation2], P. simoterus [Citation2], P. thymelensis [Citation3], P. simoteriscus [Citation4], P. huicundo [Citation5] y P. ortizi [Citation5]. Las características osteológicas de estas especies fueron revisadas por Guayasamin [Citation6], quién hipotetizó que la presencia de una fontanella entre los huesos frontoparietales representa una sinapomorfía para el grupo. Sin embargo, aunque algunas de estas especies han sido incluidas en filogenias, hasta el momento no se han realizado análisis moleculares y taxonómicos específicos que incluyan una representación significativa de las especies del grupo, por lo que sus relaciones filogenéticas son inconclusas [Citation7]. Por ejemplo, Padial et al. [Citation8] incluyeron en su filogenia de Terrarana a dos especies (P. orcesi y P. thymelensis), evidenciando que no son genéticamente cercanas; sin embargo, estos resultados no fueron informativos puesto que la muestra asignada como P. thymelensis corresponde realmente a P. myersi [Citation9].
Recientemente, dos nuevas especies descritas de los páramos del sur del Ecuador: P. erythros [Citation10] y P. andinogigas [Citation11], han sido tentativamente sugeridas como miembros del grupo P. orcesi debido a sus similitudes morfológicas con P. orcesi, incluyendo la presencia de macroglándulas dermales. Las macroglándulas son un carácter poco común en el género Pristimantis y hasta ahora solamente han sido reportadas en las especies mencionadas y P. pycnodermis, P. orcesi y P. loujosti [Citation10,Citation12]. Sin embargo, las relaciones evolutivas entre estas especies de ranas glandulares son aún inciertas porque, hasta la fecha, no habían secuencias que permita incluirlas en análisis filogenéticos.
Durante expediciones llevadas a cabo en un bosque altoandino del sur de los Andes de Ecuador, encontramos una especie del género Pristimantis que es morfológicamente similar a P. orcesi y P. erythros, y que también presenta macroglándulas dermales a lo largo del cuerpo. Con estas nuevas colecciones, en la presente investigación nos enfocamos en generar información molecular y morfológica de estas tres especies para examinar sus relaciones filogenéticas. También utilizamos evidencia molecular, morfológica y de comportamiento para delimitar y describir una nueva rana Pristimantis glandular.
Métodos
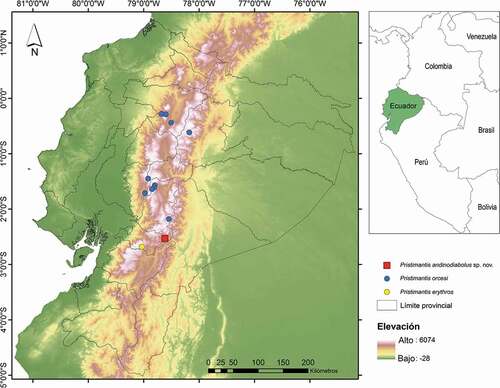
La investigación fue realizada bajo los permisos de investigación 001-AIC-DPC-MAE y MAE-DNB-CM-2015-0017 del Ministerio de Ambiente de Ecuador. Las colecciones de la nueva especie fueron realizadas en la localidad de Monay, cantón Rivera, provincia de Cañar, Ecuador (3°31ʹ52.36”S, 78°37ʹ1.71”W) (), en un rango de elevación entre los 3374 y 3535 metros. El trabajo de campo se desarrolló durante el levantamiento de información y monitoreo de anfibios y reptiles junto con la Microempresa Asociativa de Promotores Ambientales (CUTIN) y realizado mediante la metodología de inventario completo de especies [Citation13]. Los muestreos se llevaron a cabo en febrero del 2017, julio del 2018 y octubre del 2019, e incluyeron muestreos diurnos y nocturnos entre las 7:00 am y 1:00 pm. Los especímenes fueron sacrificados con roxicaína al 5%, fijados en formaldehido al 10% y preservados en etanol al 70%. El área presenta una gradiente altitudinal entre los 2800 y 3600 m de elevación y está conformada principalmente por bosque montano y páramo, aunque la porción más baja del bosque ha sido reemplazada por pastizales destinados a ganadería.
Figura 1. Mapa del Ecuador con ubicación de la localidad tipo de Pristimantis andinodiabolus sp. nov. (cuadrado rojo) y la distribución de P. orcesi (círculo azul) y P. erythros (círculo amarillo)
Datos morfológicos
La descripción de la especie sigue el formato estándar de Lynch y Duellman [Citation14] y la clasificación taxonómica propuesta por Padial et al. [Citation8]. Las descripciones de las glándulas siguen la terminología de Toledo y Jared [Citation15]. El sexo y la edad de los especímenes se determinaron mediante el reconocimiento de órganos sexuales internos a través de una incisión dorsolateral. Las medidas fueron tomadas con un calibrador de precisión e igualadas al 0,1 mm más cercano. Los dedos de las manos y pies fueron numerados preaxialmente a postaxialmente, del I al IV y V, respectivamente.
Las abreviaciones utilizadas siguen el formato de Duellman y Lehr [Citation16]: DON = distancia órbita-narina (desde el margen anterior de la órbita hasta el margen posterior de la narina); LC = longitud cefálica (desde el margen posterior de la mandíbula hasta el extremo del rostro); AC = ancho cefálico (entre las comisuras de la boca); DIO = distancia interorbital (tomada en el ancho sobre el cráneo entre las órbitas); DIN = distancia internarinal (en línea recta entre los bordes internos de las narinas); LRC = longitud rostro-cloacal (tomada desde la punta del hocico hasta la cloaca); LT = longitud de la tibia (distancia desde la rodilla hasta el talón); LP = longitud del pie (desde el margen proximal del tubérculo metatarsal interno hasta la punta del dedo IV); LM = longitud de la mano (desde la base del tubérculo tenar hasta la punta del dedo III); DT = diámetro horizontal del tímpano; DO = longitud horizontal del ojo; AP = ancho del párpado (en línea perpendicular al borde superior del párpado).
Los patrones de coloración en vida y características ecológicas fueron tomados de las notas de campo de los autores y fotografías en el campo y laboratorio. Las coordenadas y elevación fueron registradas con un GPS Garmin Etrex 10. El material examinado está depositado en el Museo de Zoología de la Universidad del Azuay (MZUA), Cuenca, Ecuador, Instituto Nacional de Biodiversidad del Ecuador (INABIO) y Museo de Zoología de la Pontificia Universidad Católica del Ecuador (PUCE) (Apéndice I). El sistema de clasificación de ecosistemas utilizado para caracterizar el hábitat de las especies sigue la clasificación del Ministerio del Ambiente del Ecuador (2012) [Citation17]. Los créditos fotográficos por parte de los autores siguen las siguientes siglas: Juan C. Sánchez (JCS) y Verónica L. Urgiles (VLU).
Amplificación y secuenciación del ADN
Para la extracción de ADN se utilizó el protocolo diseñado por Peñafiel et al. [Citation18], mediante el cual se extrajo ADN genómico de tejido hepático conservado en etanol. Amplificamos el gen mitocondrial 12S, utilizando una combinación de cebadores (12L29E-F, t-Phe-frog-R, 16H50-R) y protocolos de amplificación descritos en Heinicke et al. [Citation19]. Cada reacción de PCR contenía una concentración final de 1.5 mM MgCl2, 0.5 mM dNTP, 0.25 U/μL de ADN polimerasa Taq (Invitrogen) y 0.2 μl de cada cebador, en un volumen total de 25 μL.
Las amplificaciones obtenidas se visualizaron por medio de electroforesis con un gel de agarosa al 2%. Las muestras amplificadas se limpiaron con Exosap y se enviaron a Macrogen Inc (Corea del Sur) para la secuenciación de Sanger [Citation20]. Las secuencias obtenidas fueron ensambladas en Geneious 11.1.5 [Citation21].
Análisis filogenéticos y distancias genéticas
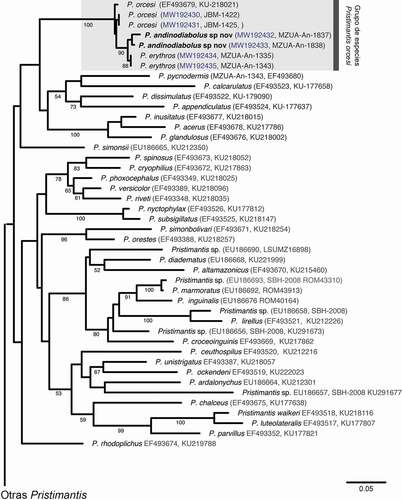
Se generaron seis nuevas secuencias de individuos pertenecientes a Pristimantis erythros, P. orcesi y la especie nueva descrita en el presente estudio. Para los análisis filogenéticos, trabajamos con las secuencias del gen mitocondrial 12S más similares a la nueva especie, utilizando BLAST [Citation22]. Todas las secuencias utilizadas en este estudio, así como sus códigos GenBank respectivos, se encuentran detalladas en la . Las secuencias se alinearon utilizando el programa MAFFT v7 [Citation23], con la estrategia Q-INS-i. El alineamiento obtenido fue revisado manualmente en Mesquite 3.51 [Citation24]. Los árboles filogenéticos se infirieron bajo el criterio de Máxima Verosimilitud (ML), utilizando el programa GARLI 2.01 [Citation25]; este programa utiliza un algoritmo genético que maximiza el valor de verosimilitud mediante alteraciones simultaneas de la topología, longitud de ramas y parámetros del modelo de evolución. La confiabilidad y robustez del árbol se evaluó con 1000 bootstraps, también realizados en GARLI con los parámetros sugeridos por Zwickl [Citation25]. Las distancias genéticas entre la nueva especie y las más cercanamente relacionadas fueron obtenidas en PAUP 4.0 [Citation26].
Figura 2. Relaciones filogenéticas de Pristimantis. Árbol de máxima verosimilitud obtenido a partir de análisis de secuencias de ADN mitocondrial (12S). Los números bajo las barras corresponden a los valores de bootstrap support (BB). Los valores BB < 50 no se muestran. El código de acceso de GenBank y de Museo para cada terminal están entre paréntesis
Análisis del canto de anuncio
En septiembre de 2019, JCS grabó los llamados de un macho (no colectado) de Pristimantis en la localidad de Monay, provincia de Cañar a 3510 metros (). Las grabaciones analizadas y descritas correspondieron a las obtenidas entre las 22:00 h y 22:43 h. Las grabaciones se realizaron hasta una distancia lineal aproximada de 7 metros. (temperatura = 7.1 °C; humedad relativa = 94.9 %; velocidad del viento = 0.6 m/s). Este individuo no pudo ser capturado debido a la dificultad de acceso a su ubicación en el árbol desde el cual vocalizaba (ver descripción del canto); sin embargo, se pudo observar al macho que cantaba y su singular patrón de coloración permitió una identificación sin ambigüedades (ver coloración en vida y diagnosis).
Para la grabación se utilizó un equipo Handy Recorder H1 marca ZOOM con micrófonos estéreos incorporados X/Y a 90º, una frecuencia de muestreo de 44 kHz y resolución de 24 bits, en formato de archivo (.wav). La temperatura del aire y la humedad se tomaron con un medidor meteorológico/ambiental (Kestrel 5400). Las gráficas de los espectrogramas del canto de anuncio fueron elaboradas en R [Citation27], usando los paquetes seewave y tuneR [Citation28,Citation29], con una frecuencia de muestreo de 44.1 kHz, 90% de superposición en un ancho de banda de 1024 puntos y un límite espectral de 4 kHz. Para medir las variables tanto en los oscilogramas y espectrogramas se usó Raven Studio 1.5 [Citation30], con los siguientes ajustes de ventana: Hamming, DFT: 512 muestras, ancho de banda del filtro de 3 dB: 124 Hz y 50% de superposición. En vista espectral, se hizo una reducción de −10 dB para cada llamado del canto de anuncio.
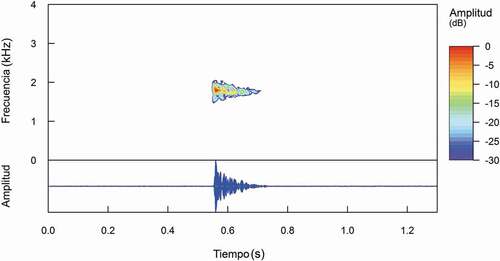
Basados en la estructura de la vocalización grabada seguimos las sugerencias de Köhler et al. [Citation31], utilizando el esquema terminológico “centrado en llamado” (call-centered), debido a que el elemento que compone el canto de anuncio es un llamado de un solo elemento que se repite durante cierto periodo de tiempo. Medimos y analizamos los siguientes parámetros temporales y espectrales: (1) duración de la nota: la duración de una sola nota dentro del canto, medida desde el principio hasta el final de la nota; (2) intervalo entre notas: el intervalo entre dos notas consecutivas dentro del mismo canto, medido desde el final de una nota hasta el comienzo de la nota consecutiva; (3) frecuencia dominante: la frecuencia que contiene la energía sonora más alta, medida a lo largo de todo el canto; (4) ancho de banda: rango total de las frecuencias presentes en el sonido emitido; (5) frecuencias: número de ciclos de oscilación de ondas sonoras por unidad de tiempo; (6) la duración del canto y; (7) número de notas por canto.
Resultados
Filogenia y distancias genéticas
La inferencia topológica con el criterio de máxima verosimilitud () muestra que la nueva especie es hermana de Pristimantis erythros y, juntas, son hermanas de P. orcesi; este clado (especie nueva + P. erythros + P. orcesi) tiene un muy alto soporte (bootstrap = 100%). Otras especies cercanamente emparentadas, pero con muy bajo soporte, incluyen: P. pycnodermis, P. disimulatus, P. appendiculatus, P. calcarulatus, P. inusitatus, P. acerus, P. glandulosus, y P. simonsii (, Material Suplementario I).
Las distancias genéticas en un fragmento de 661 pares de bases del gen mitocondrial 12S muestran que las dos muestras de la nueva especie de Pristimantis difieren entre ellas en un 1.2%. Pristimantis erythros y la nueva especie tienen secuencias muy similares (0.5–1.3%). Pristimantis orcesi difiere de la nueva especie en un 1.9–2.7% y de P. erythros en 1.7%.
Pristimantis andinodiabolus sp. nov. (, –11)
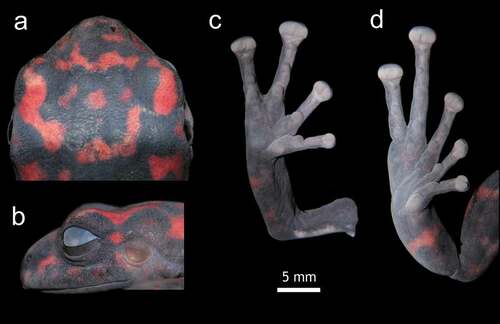
Figura 3. Holotipo de Pristimantis andinodiabolus sp. nov., hembra MZUA.AN.1903, en vida. (a) vista dorsal, (b) vista frontal, (c) vista lateral, (d) vista ventral. LRC = 42,8 mm. Fotografías: VLU

LSID: FCCB9AD3-F7A5-4660-BE92-3BCE159020B4
Nombre común en español: Cutín diablo andino
Common name in English: Andean Devil Rainfrog
Holotipo
Hembra adulta MZUA.AN.1903 (Serie de campo: JCS-941) colectada el 24 de febrero del 2017 por JCS, VLU, Jhonny Cedeño-P y Homero Abad-P, en el bosque de Monay (2°31ʹ52.36”S, 78°37ʹ1.71”W, elevación: 3418 m), cantón Rivera, provincia de Cañar, Ecuador (, ).
Figura 4. Detalles en la morfología externa y ubicación de macroglándulas dermales del Holotipo de Pristimantis andinodiabolus sp. nov., MZUA.AN.1903. Fotografías: VLU

Paratipos
Hembras subadultas MZUA.AN.1838, MZUA.AN.1863, MZUA.AN.1864, y hembras juveniles MZUA.AN.1837, MZUA.AN.1839, MZUA.AN.1914, con los mismos datos del Holotipo (, 9).
Etimología
El epíteto específico andinodiabolus proviene de la combinación de dos palabras, “andino” que hace referencia a los Andes, palabra de origen quechua y “diabolus” en griego, que significa diablo o demonio y hace alusión a su combinación de colores rojo brillante con gris oscuro, única entre todas las especies del género en los Andes de Ecuador.
Diagnosis
Pristimantis andinodiabolus se diferencia de otras especies del género por la combinación de los siguientes caracteres: (1) Piel de la cabeza y dorso finamente corrugada, piel de flancos y vientre areolada con verrugas bajas; pliegues dorsolaterales ausentes; pliegue discoidal ausente; pliegue torácico presente; (2) membrana y anillo timpánico presentes, equivale al 55 % del DO, borde superior del anillo timpánico y mitad posterior del párpado parcialmente cubierto por una macroglándula; (3) hocico corto, subacuminado en vista de perfil y dorsal exhibiendo una pequeña papila en la punta del hocico; (4) párpado con un diminuto tubérculo bajo, visible principalmente en juveniles y subadultos; DIO mayor a AP; crestas craneales ausentes; (5) procesos dentígeros del vómer ausentes; (6) hendiduras bucales, sacos vocales presentes, almohadillas nupciales desconocidas; (7) dedo I de la mano más corto que el dedo II, terminaciones digitales expandidas con discos II, III y IV, del mismo ancho que el dígito en disco I, surcos circunferenciales presentes en todos los dígitos; (8) dedos con rebordes cutáneos laterales gruesos; (9) una macroglándula radioulnar cubriendo la superficie dorsal del antebrazo, engrosado un ¼ más que el ancho del brazo; (10) un pequeño tubérculo bajo en el talón, sin tubérculos en los bordes del tarso; macroglándulas en la superficie dorsal de pantorrilla, tarso y pie; en el pie se extiende hasta los dedos IV y V; (11) dedo V del pie más largo que III, alcanza el tubérculo subarticular distal del dedo V; dos tubérculos metatarsales, ovales, el interno tres veces del tamaño del externo, tubérculos supernumerarios plantares bajos; (12) dedos de los pies con rebordes cutáneos laterales, sin membranas interdigitales; almohadillas digitales del pie tan grandes como las de las manos, siendo más expandidas en los dígitos III, IV y V y casi del ancho del dígito en I y II, surcos circunferenciales presentes en todos los dígitos; (13) una macroglándula paracnemida cubriendo la superficie dorsal externa del pie; (14) coloración del dorso y flancos es gris oscuro (casi negro) con grandes manchas irregulares rojas, vientre gris-rojizo, más oscuro en la región pectoral; extremidades con el mismo patrón de coloración dorsal; iris café oscuro con diminutos puntos dorados; (15) LRC en hembras adultas de 42,8 mm (n = 1), en hembras subadultas de 19,9–23,2 mm (21,1, n = 3); en machos desconocida.
Comparaciones con otras especies
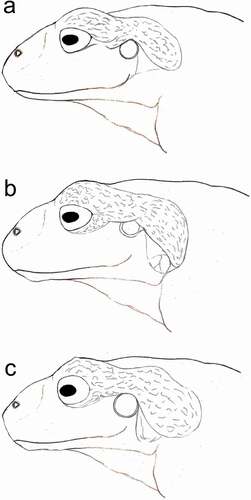
Pristimantis andinodiabolus difiere de todas las demás especies de Pristimantis por presentar una coloración dorsal llamativa rojo y gris oscuro en vida (gris y café rojizo en preservado); piel de textura finamente corrugada, un diminuto tubérculo en el párpado y talón, una papila en la punta del hocico y, sobre todo, macroglándulas cutáneas: parotoideas, paracnemidas y radioulnares (). La presencia y distribución de las macroglándulas, además de los tamaños de los individuos adultos de P. andinodiabolus, son similares a los de P. andinogigas, P. erythros, P. orcesi y P. pycnodermis, por lo que a continuación, detallamos las diferencias entre estas especies.
Pristimantis erythros y P. orcesi son las especies más semejantes por su apariencia externa y la ausencia de procesos odontóforos vomerinos, además de ser las especies más cercanas filogenéticamente; sin embargo, P. erythros y P. orcesi se diferencian de P. andinodiabolus (caracteres en paréntesis) por la ausencia de tubérculos en párpados y papila en la punta del hocico (presentes); discos manuales y pediales truncados (elípticos). Adicionalmente, P. erythros no presenta tubérculo en talón (presente) (). Las tres especies presentan una textura de la piel dorsal corrugada, la cual varía sutilmente entre ellas. El área cubierta por la glándula parotoidea sobre el tímpano y anillo timpánico se puede diferenciar claramente entre las tres especies (). Finalmente, P. orcesi presenta una coloración café oscura o negra, con algunas manchas blancas, y P. erythros una coloración uniforme rojo o naranja rojizo (coloración gris oscura con manchas grandes irregulares rojas) (). Pristimantis pycnodermis se diferencia de la nueva especie por presentar una coloración dorsal entre café y verde claro con grandes manchas negras en los flancos y manchas rojas o anaranjadas en las superficies ocultas de los muslos y axilas, por tener odontóforos vomerinos prominentes y crestas craneales (coloración dorsal rojo y gris oscuro, odontóforos vomerinos y crestas craneales ausentes); P. andinogigas presenta una textura porosa en la piel dorsal y odontóforos vomerinos presentes (piel dorsal corrugada y odontóforos vomerinos ausentes) ().
Descripción del Holotipo
Hembra adulta (), cabeza ligeramente más ancha que el cuerpo, casi 1/4 más ancha que larga, equivale al 36% de la longitud rostro-cloacal; hocico corto con una pequeña papila en la punta, redondeado en vista dorsal y de perfil; canto rostral curvo, redondeado, región loreal cóncava; narinas dirigidas fronto-lateralmente; área interorbital plana, más del doble que el ancho del párpado; párpado superior equivale al 45% de la distancia interorbital. Crestas craneales ausentes; con una macroglándula en la región parotoidea que se extiende hasta un 5% más que el borde posterior del brazo en vista dorsal. Membrana anillo timpánicos diferenciados, redondeado, 52% del diámetro del ojo, anillo timpánico menos evidente en la parte superior donde se cubre parcialmente por esta macroglándula. Coanas pequeñas, ovaladas, no cubiertas por el piso palatal o el arco maxilar; procesos odontóforos vomerinos ausentes; lengua más ancha que larga, siendo la región posterior más ancha, adherida aproximadamente el 25% al piso de la boca.
Piel del dorso finamente corrugada, flancos y vientre areolados; un pequeño tubérculo achatado en parpado y talón; sin pliegues dorsolaterales; pliegue discoidal poco definido en la región ventral baja; pliegue torácico visible; cubierta cloacal con grandes verrugas ovales ().
Una macroglándula radioulnar cubre la superficie dorsal del antebrazo; tubérculos palmares anchos y bajos, tubérculo palmar externo redondeado, 1/3 más grande que el interno, tubérculo palmar interno redondo; tubérculos supernumerarios grandes y aplanados; tubérculos subarticulares pronunciados en vista ventral y lateral; dedos manuales con rebordes cutáneos laterales, sin membranas interdigitales; dedo I más corto que dedo II, discos notoriamente expandidos del II–IV, poco expandido en dedo I, todos los dedos manuales con cojinetes ventrales bien definidos con surcos circunferenciales ().
Extremidades posteriores robustas, longitud de la tibia 41% de la longitud rostro cloacal; talón con un pequeño tubérculo achatado, bordes externos de tarso y pantorrilla sin tubérculos, cubiertos dorsal y ventralmente por una macroglándula; pliegue tarsal interno ausente; tubérculos metatarsales ovales, el interno tres veces más grande que el tubérculo metatarsal externo; tubérculos supernumerarios escasos, grandes y aplanados; dedos del pie con rebordes cutáneos laterales; sin membranas entre los dedos; discos del pie ligeramente más pequeños que los discos manuales, más expandidos en dedos II–V y poco expandido en dedo I; fórmula de los dedos I< II<III<V< IV, dedo V alcanza al tubérculo subarticular distal del dedo IV, todos los dedos pediales con cojinetes ventrales bien definidos con surcos circunferenciales ().
Coloración en vida del holotipo
Dorso gris muy oscuro con manchas rojas brillantes irregulares. Flancos con manchas más oscuras en un fondo gris oscuro. Vientre gris-rojizo, siendo más oscuro en la región abdominal; manchas rojas poco definidas en extremidades y garganta. Superficies ventrales de manos y pies la tonalidad gris-rosado es más clara ().
Coloración en preservado del holotipo
Dorsalmente presenta una coloración gris oscura (casi negra) con manchas rojas irregulares. Flancos con el mismo patrón dorsal, las manchas rojas se vuelven oscuras en la región cercana al vientre. Vientre gris muy oscuro con manchas rojas oscuras que se pierden con el fondo gris, siendo más notorias en extremidades y garganta. Superficies ventrales de las palmas de las manos y plantas de los pies, grises ().
Variación
Los patrones de coloración de Pristimantis andinodiabolus varían por el diseño moteado de su coloración dorsal, donde, las manchas rojas pueden ser, desde esparcidas a abundantes, cubriendo en vista dorsal en un 50% aproximadamente, llegando hasta un 80% aproximadamente ().
Medidas del holotipo (mm)
DON = 4,0; LC = 11,7; AC = 15,5; DIO = 8,7; DIN = 4,0; LRC = 42,8; LT = 17,9; LP = 19,6; LM = 14,2; DT = 2,5; DO = 4,7; AP = 4,0
Descripción del canto de anuncio
El individuo grabado vocalizaba desde una altura aproximada de cinco metros desde una rama de un árbol cubierta de líquenes y musgos sobre un parche densamente formado principalmente por una hierba del género Neurolepis. El llamado emitido era un tik. Dicha vocalización inició un minuto antes de las 19:00 h y continuaron hasta las 22:43 h. El canto de anuncio de P. andinodiabolus () está compuesto por un elemento simple de frecuencia constante. Los resultados de las mediciones se presentan en la .
Tabla 1. Características de las variables medidas en el canto de anuncio de Pristimantis andinodiabolus sp. nov
Distribución e historia natural
Pristimantis andinodiabolus es conocida únicamente en la localidad tipo, en el sector de Monay. El área está conformada por bosque montano alto, en una gradiente de elevación entre 3374 y 3535 m (). Los individuos fueron capturados durante la noche (entre las 21:00 y 23:00 h), en el interior del bosque; los juveniles y subadultos MZUA.AN.1838, MZUA.AN.1863, MZUA.AN.1864, MZUA.AN.1837, MZUA.AN.1839, MZUA.AN.1914 fueron encontrados sobre bromelias epífitas y terrestres, entre los 30 cm y 2 m sobre la superficie del suelo. El holotipo (MZUA.AN.1903) fue encontrado en una rama a aproximadamente 170 cm del suelo.
Visitas posteriores permitieron ubicar a dos machos vocalizando en zonas con dosel alto (superior a 10 m), densamente pobladas de una hierba del género Neurolepis, donde, uno fue grabado a una altura que sobrepasó los 3 metros, de donde fue imposible capturarlo dadas las condiciones de su ubicación y del cual se realizó la descripción del canto. Pristimantis andinodiabolus habita en simpatría con P. colodactylus, P. aff. cryophilius y P. quintanai.
Las hembras adultas y subadultas encontradas, al momento de su captura, liberaron una sustancia blanquecina de aspecto lechoso por la superficie dorsal del cuerpo y extremidades. Esta excreción no generó ninguna reacción a sus manipuladores, sin embargo, presentaba un olor un tanto mentolado.
Amenazas para su conservación
Jhonny Cedeño y Homero Abad han monitoreado al bosque de Monay y sus alrededores desde el año 2010 hasta la fecha; sus registros de la nueva especie, tanto visuales como auditivos, se presentan únicamente en la localidad tipo. Luego de búsquedas realizadas en 2018 y 2019 en localidades cercanas a la localidad tipo, no se registraron otras poblaciones.
Los bosques montanos y páramos de la cuenca del Río Paute (donde está el sector de Monay) están bajo constantes monitoreos biológicos por parte de la Asociación de Promotores Ambientales “Cutín”; sin embargo, estos ecosistemas están sometidos a importantes presiones provocadas por el cambio del uso del suelo para la ganadería.
Hemos evaluado los porcentajes de cobertura vegetal entre la localidad de Monay y localidades vecinas, encontrando que Monay presenta una mayor cobertura y complejidad topográfica (Sánchez-Nivicela et al. en prep.). Es posible que los valles cercanos a la localidad tipo sean barreras climáticas que limiten la dispersión de P. andinodiabolus, especie que parece estar restringuida a la microcuenca del río Llavircay
Adicionalmente, las densidades de P. andinodiabolus en el área no son altas y no superan a los 10 individuos observados en muestreos de cuatro horas en promedio en un transecto de 1,9 km (datos no publicados de los registros de monitoreo de la Asociación Cutín). Debido a que el área de bosque montano de la microcuenca del río Llavircay tiene una extensión aproximada de 7,5 km2 y que en todos nuestros muestreo no hemos encontrado individuos de este especies en áreas circundantes, sugerimos que P. andinodiabolus debe incluirse en la categoría de Peligro Crítico (CR), según los criterios de la IUCN: B1, B2b (i,ii,iii) [Citation32].
Discusión
En nuestro estudio, argumentamos la validez de P. andinodiabolus como nueva especie con base en caracteres morfológicos, relaciones filogenéticas y patrones de distribución. Aunque las distancias genéticas entre P. andinodiabolus y las dos especies más cercanas (P. orcesi y P. erythros) son menores al umbral generalmente usado del 3% para delimitar especies [Citation33], las evidencias morfológicas son un indicativo sólido de la validez de la nueva especie; adicionalmente, en anfibios se han reportado casos similares de baja diferenciación genética y diagnosis claros en otros tipos de caracteres (e.g. morfológicos, ecológicos y comportamentales) [Citation34,Citation35].
En el análisis filogenético de Targino-Rocha [Citation36], se incluyen secuencias de varias especies que se encontraban en el grupo orcesi (P. huicundo, P. obmutescens, P. simoterus, P. thymelensis y P. orcesi) y se muestra que, a excepción de P. orcesi, todas las demás especies forman parte de un grupo filogenéticamente distante, sugiriendo que P. orcesi es parte de un grupo de especies distinto (P. glandulosus) junto con P. acerus [Citation37], P. appendiculatus [Citation38], P. calcarulatus [Citation39], P. cedros [Citation40], P. dissimulatus [Citation14], P. glandulosus [Citation41], P. inusitatus [Citation37], P. orcesi [Citation3], P. pahuma [Citation40]. P. pycnodermis [Citation42] y P. tribulosus [Citation43]. Sin embargo, el grupo propuesto por Targino-Rocha es morfológicamente diverso y, por lo tanto, no presenta sinapomorfías morfológicas claras. Limitando su uso para fines comparativos.
En nuestro estudio y, basados en los análisis filogenéticos y una combinación de caracteres morfológicos compartidos, sugerimos que el grupo de especies Pristimantis orcesi incluye a tres especies endémicas del Ecuador: P. andinodiabolus, P. erythros y P. orcesi. Estas tres especies forman un clado con alto soporte (BB = 100 %) y comparten las siguientes características morfológicas: tamaño medio, grandes parches formados por macroglándulas dermales en la región supratimpánica y extremidades, la ausencia de procesos odontóforos vomerinos y ausencia de crestas craneales. Entre los caracteres mencionados, las macroglándulas dermales parecen representar una sinapomorfía, ya que la morfología interna y reacciones histoquímicas de sus productos de secreción son similares en las tres especies del grupo orcesi (Sánchez-Nivicela et al. en prep.).
Con base en estos resultados y el objetivo de que los grupos subgenéricos reflejen una historia evolutiva común y, claro, similitud morfológica, excluimos del grupo orcesi a las siguientes especies: P. huicundo, P. obmutescens, P. ortizi, P. pycnodermis, P. racemus, P. simoteriscus, P. simoterus, y P. thymelensis. Estas especies no presentan las características más conspicuas del grupo orcesi, es decir, las macroglándulas cutáneas y la ausencia de los procesos odontóforos vomerinos.
También excluimos del grupo a P. andinogigas. Si bien esta especie exhibe parches glandulares, principalmente en la región supratimpánica, la morfología y naturaleza de sus productos de secreción son diferentes a las especies que asignamos dentro del grupo orcesi (Sánchez-Nivicela et al. en prep.). Además, presenta procesos odontóforos vomerinos.
La presencia de macroglándulas localizadas en regiones estratégicas del cuerpo, principalmente en la región post-orbital, está asociada a la producción de secreciones como mecanismo de defensa avanzado [Citation44,Citation45]. Estos distintivos parches glandulares, además de patrones de coloración llamativos (aposemáticos), sugieren la existencia de un mecanismo antidepredatorio por toxicidad [Citation46,Citation47]. Esta hipótesis está apoyada por observaciones de campo al momento de captura de individuos de P. andinodiabolus y P. erythros donde notamos la producción de un exudado de aspecto lechoso en ambas especies.
Las otras especies del grupo ocesi, P. erythros y P. orcesi, presentan distribuciones exclusivas a los páramos del macizo del Cajas y Cordillera Real en el centro y norte del Ecuador, respectivamente. Pristimantis andinodiabolus es la única especie que se encuentra en bosque montano, sobre los 3300 metros de elevación. La distribución de estas especies muestra que los procesos de especiación parecen ser principalmente alopátricos, en donde las depresiones causadas por ríos con gran afluente separan sus poblaciones [Citation48,Citation49].
El Macizo del Cajas (localidad de P. erythros) se encuentra aislada del resto de la cordillera [Citation9], presentando una distancia de aproximadamente 50 km con la localidad de la nueva especie. Pristimantis orcesi presenta una distribución más amplia; la población más cercana conocida (Laguna de Atillo) se encuentra a aproximadamente 40 km al norte de la localidad tipo de P. andinodiabolus. Al igual que con otros grupos de especies del género, los procesos de diversificación y especiación se pueden presentar simultáneamente en áreas relativamente pequeñas, pero con una topografía compleja [Citation35,Citation49–51].
La distribución restringida de P. andinodiabolus en el bosque montano de la microcuenca del río Llavircay coincide con lo observado en P. erythros, cuya distribución también se encuentra restringida a un pequeño parche de matorrales en el páramo de Chanlud, en Azuay [Citation10]. Las distribuciones de ambas especies demuestran la importancia de conservar y proteger esta área, sobre todo al develarse los microendemismos que presenta. Estas acciones de conservación implican no solo la protección de su hábitat, sino también el manejo de cuencas para evitar la dispersión de enfermedades y de especies introducidas [Citation52,Citation53].
Agradecimientos
Agradecemos de manera muy especial a Edwin Prado, Ricardo García, Sixto Mendez, Rene Guamán, José Toalongo, Fabián Tamay, Manuel Zhibri, Remigio Orellana, Santiago Marquina, Flor Vintimilla, Henry Ávila, Homero Zhibri y Martin Zanahuaray de la Asociación de Promotores Ambientales “Cutín” por apoyarnos activamente en las expediciones de campo y por compartir sus conocimientos con nosotros. A la Unidad de Negocios HidroPaute-CELEC EP por financiar esta investigación, de manera especial a Tito Torres, Pablo Guzmán y Pedro Alvarado por apoyar la conservación y protección de las fuentes hídricas y ecosistemas frágiles en la provincia de Cañar. A Eduardo Toral por generar el soporte para realizar esta descripción y el levantamiento de información de las áreas protegidas de la provincia de Cañar. A Zaira Vicuña, Karina Chamorro y al Fondo del Agua para la Conservación de la cuenca el Río Paute-FONAPA por proveer financiamiento y apoyo logístico durante este estudio. A Santiago R. Ron y Mario Yánez-Muñoz por proveer las fotografías de Pristimantis andinogigas y P. orcesi, respectivamente. A Manuel Sánchez y Diego Batallas por su ayuda y guía en el análisis y descripción de las vocalizaciones. A Jorge Brito del INABIO por brindarnos muestras de sus tejidos para nuestros análisis. Finalmente, agradecemos al Museo de Zoología de la Universidad del Azuay por su apoyo y por permitirnos depositar las muestras y el acceso a la colección.
Contribución de los autores
Jhonny Cedeño y Homero Abad descubrieron a la especie. JCS, VLU, Jhonny Cedeño y Homero Abad colectaron los especímenes en el campo. JCS escribió el texto, realizó el mapa de distribución, editó las fotografías de los especímenes. VLU preparó los especímenes, revisó y editó el texto. JMG obtuvo y analizó las secuencias moleculares y contribuyó a la escritura del manuscrito.
Financiamiento
Esta investigación fue financiada por CELEC-Unidad de negocios Hidropaute como parte del convenio con la microempresa de promotores ambientales “Cutín” y el fideicomiso para el Fondo del Agua para la Conservación de la cuenca el Río Paute- FONAPA, bajo el convenio [HPA-CON-0049-16]. Este estudio fue apoyado por la Universidad San Francisco de Quito (Collaboration Grants 5447, 11164, 16871) y la Secretaría de Educación Superior, Ciencia, Tecnología en Innovación del Ecuador (Programa Inédita: Respuestas a la crisis de biodiversidad: La descripción de especies como herramienta de conservación).
Disclosure statement
No potential conflict of interest was reported by the authors.
Referencias
- Lynch JD Leptodactylid frogs of the genus Eleutherodactylus in the Andes of Northern Ecuador and adjacent Colombia. Miscellaneous Publications, vol. 72, pp. 1–46. The University of Kansas; 1981.
- Lynch JD. New species of Eleutherodactylus of Colombia (Amphibia: leptodactylidae). I: five new species from the paramos of the Cordillera Central. Caldasia. 1980;13:165–188.
- Lynch JD. Two new species of frogs (Eleutherodactylus: leptodactylidae) from the paramos of northern Ecuador. Herpetologica. 1972;28:141–147.
- Lynch JD, Ruiz-Carranza PM, Ardila-Robayo MC. Three new species of Eleutherodactylus (Amphibia: leptodactylidae) from high elevations of the Cordillera Central of Colombia. Caldasia. 1997;18(3):329–342.
- Guayasamín JM, Almeida-Reinoso DP, Nogales-Sornosa F. Two new species of frogs (Leptodactylidae: eleutherodactylus) from the high Andes of northern Ecuador. Herpetological Monograph. 2004;18:127–141.
- Guayasamín JM. The Eleutherodactylus orcesi species group (Anura: leptodactylidae): comparative osteology and comment on its monophyly. Herpetological Monograph. 2004;18:142–174.
- Hedges SB, Duellman WE, Heinicke MP. New World direct-developing frogs (Anura: terrarana): molecular phylogeny, classification, biogeography, and conservation. Zootaxa. 2008;1737(1):1–182.
- Padial JM, Grant T, Frost DR. Molecular systematics of terraranas (Anura: brachycephaloidea) with an assessment of the effects of alignment and optimality criteria. Zootaxa. 2014;3825(1):1–132.
- Guayasamin JM, Arteaga A, Hutter CR. A new (singleton) rainfrog of the Pristimantis myersi Group (Amphibia: craugastoridae) from the northern Andes of Ecuador. Zootaxa. 2018;4527(3):323–334.
- Sánchez-Nivicela JC, Celi-Piedra E, Posse-Sarmiento, et al. A new species of Pristimantis (Anura, Craugastoridae) from the Cajas Massif, southern Ecuador. ZooKeys. 2018;751:113–128.
- Yánez-Muñoz MH, Veintimilla-Yánez D, Batallas D, et al. A new giant Pristimantis (Anura, Craugastoridae) from the paramos of the Podocarpus National Park, southern Ecuador. ZooKeys. 2019;852:137.
- Yánez-Muñoz MH, Cisneros-Heredia DF, Reyes-Puig JP. Una nueva especie de rana terrestre Pristimantis (Anura: terrarana: strabomantidae) de la cuenca alta del Río Pastaza, Ecuador. Avances en Ciencias e Ingenierías. Sección B. Quito. 2011;2(3):B28–B32. “2010”.
- Angulo A, Rueda-Almonacid JV, Rodríguez-Mahecha JV, et al.. Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo No 2. Bogotá DC.: Panamericana Formas e Impresos S.A.; 2006, 298.
- Lynch JD, Duellman WE. Frogs of the genus Eleutherodactylus in western Ecuador. Systematics, ecology, and biogeography. Special Publication. Vol. 23. Natural History Museum, University of Kansas; 1997. p. 1–236.
- Toledo RC, Jared C. Cutaneous granular glands and amphibian venoms. Comp Biochem Physiol. 1995;111:1–29.
- Duellman WE, Lehr E. Terrestrial-breeding frogs (Strabomantidae) in Peru. Münster: Natur und – Verlag; 2009.
- Ministerio del Ambiente del Ecuador (MAE). Sistema de Clasificación de los Ecosistemas del Ecuador Continental. Quito: Ministerio del Ambiente del Ecuador; 2012.
- Peñafiel N, Flores DM, Rivero De Aguilar J, et al. A cost-effective protocol for total DNA isolation from animal tissue. Neotrop Biodivers. 2020;5:69–75.
- Heinicke MP, Duellman WE, Trueb L, et al. A new frog family (Anura: terrarana) from South America and an expanded direct-developing clade revealed by molecular phylogeny. Zootaxa. 2009;2211:1–35.
- Sanger F, Coulson AR. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 1975;94(3):441–448.
- Kearse M, Moir R, Wilson A, et al. Geneious Basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics. 2012;28(12):1647–1649.
- Altschul SF BLAST algorithm. eLS; 2001. Access date: 15 June 2020. https://www.ncbi.nlm.nih.gov/genbank/
- Katoh K, Standley DM. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Mol Biol Evol. 2013;30(4):772–780.
- Maddison WP, Maddison DR Mesquite: a modular system for evolutionary analysis. Version 3.51; 2018. Access date: 20 June 2020. http://www.mesquiteproject.org
- Zwickl DJ. Genetic algorithm approaches for the phylogenetic analyses of large biological sequence datasets under the maximum likelihood criterion [dissertation]. Austin: The University of Texas at Austin; 2006.
- Swofford DL PAUP*: phylogenetic Analysis Using Parsimony (*and Other Methods). Version 4. Sunderland, Massachusetts: Sinauer Associates; 2002.
- R Development Core Team. R: A language and environment for statistical computing (version 3.5.3). Vienna, Austria: R Foundation for Statistical Computing; 2019. http://www.R-project.org
- Sueur J, Aubin T, Simonis C. Seewave: a free modular tool for sound analysis and synthesis. Bioacoustics. 2008;18:213–226.
- Ligges U, Krey S, Mersmann O, et al. tuneR: analysis of music. R package versión 1.3.3; 2018. Access date: 13 December 2019. https://CRAN.Rproject.org/package=tuner.
- Center for Conservation Bioacoustics. Raven Pro: Interactive Sound Analysis Software (Version 1.5) [Computer software]. Ithaca, NY: The Cornell Lab of Ornithology. 2014. http://ravensoundsoftware.com/
- Köhler J, Jansen M, Rodríguez A, et al. The use of bioacoustics in anuran taxonomy: theory, terminology, methods and recommendations for best practice. Zootaxa. 2017;4251:1–124.
- IUCN. The IUCN red list of threatened species. Version 2020-2. [A ccess: 9 July 2020]. https://www.iucnredlist.org.
- Fouquet A, Gilles A, Vences M, et al. Underestimation of species richness in neotropical frogs revealed by mtDNA analyses. PLoS ONE. 2007;10:e1109.
- Funk WC, Caminer M, Ron SR. High levels of cryptic species diversity uncovered in Amazonian frogs. Proc Royal Soc, Biol Sci. 2012;279:1806–1814.
- Páez NB, Ron SR. Systematics of Huicundomantis, a new subgenus of Pristimantis (Anura, Strabomantidae) with extraordinary cryptic diversity and eleven new species. ZooKeys. 2019;868:1.
- Targino-Rocha M Análise filogenética de Pristimantis Jiménez de la Espada, 1870, um genero megadiverso de anfibios (Anura: brachycephaloidea, Craugastoridae). Tese para a obtencao de Título de Doutor em Ciencias Biológicas, na Área de Zoologia. Instituto de Biociencias da Universidade de Sao Paulo; 2016.
- Lynch JD, Duellman WE The Eleutherodactylus of the Amazonian slopes of the Ecuadorian Andes (Anura: leptodactylidae). Miscellaneous Publication. Museum of Natural History, University of Kansas. 1980; 69: 1–86.
- Werner F. Herpetologische Nova. Zoologischer Anzeiger. 1894;17:410–415.
- Lynch JD New species of frogs (Leptodactylidae: eleutherodactylus) from the Pacific versant of Ecuador. Occasional Papers of the Museum of Natural History. University of Kansas. 1976; 55: 1–33.
- Hutter CR, Guayasamin JM. Cryptic diversity concealed in the Andean cloud forests: two new species of rainfrogs (Pristimantis) uncovered by molecular and bioacoustic data. Neotrop Biodivers. 2015;1:35–59.
- Boulenger GA. Reptiles et batraciens recueillis par M. Émile de Ville dan les Andes de l’Équateur. Bulletin de la Société Zoologique de France. 1880;5:41–48.
- Lynch JD. Leptodactylid frogs of the genus Eleutherodactylus from the Andes of southern Ecuador. Miscellaneous Publication. Museum of Natural History, University of Kansas. 1979;66:1–62.
- Lynch JD, Rueda-Almonacid JV. Three new frogs (Eleutherodactylus: leptodactylidae) from cloud forests in eastern Departamento Caldas, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 1997;21:131–142.
- Jared C, Antoniazzi MM, Jordao AEC, et al. Parotid macroglands in toad (Rhinella jimi): their estructure and functioning in passive defense. Toxicon. 2009;54:197–207.
- Toledo LF, Sazima I, Haddad CFB. Behavioral defenses of anurans: an overview. Ethol Ecol Evol. 2011;23:1–25.
- Rojas B. Behavioural, ecological, and evolutionary aspects of diversity in frog colour patterns. Biol Rev. 2017;92(2):1059–1080.
- Edmunds M. Defence in animals: a survey of anti-predator defences. New York: Longman Publishing Group; 1974.
- Wollenberg Valero KC, Marshall JC, Bastiaans E, et al. Patterns, mechanisms and genetics of speciation in reptiles and amphibians. Genes (Basel). 2019;10(9):646.
- Guayasamin JM, Cisneros-Heredia DF, McDiarmid RW, et al. Glassfrogs of Ecuador: diversity, evolution, and conservation. Diversity. 2020;12(222):1–285.
- Guayasamin JM, Hutter CR, Tapia EE, et al. Diversification of the rainfrog Pristimantis ornatissimus in the lowlands and Andean foothills of Ecuador. PloS One. 2017;12:3.
- Rodríguez A, Börner M, Pabijan M, et al. Genetic divergence in tropical anurans: deeper phylogeographic structure in forest specialists and in topographically complex regions. Evol Ecol. 2015;29(5):765–785.
- Berger L, Speare R, Daszak P, et al. Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America. Proc Nat Academy Sci, USA. 1998;95:9031–9036.
- Martín-Torrijos L, Sandoval-Sierra JV, Diéguez-Uribeondo J, et al. Rainbow Trout (Oncorhynchus mykiss) threaten Andean amphibians. Neotrop Biodivers. 2016;2:26–36.
Appendices
Apéndice
Especímenes examinados
Pristimantis andinogigas: DHMECN 10984, 10986, 10991–93, 10996, 10999, 11005, 11008, 11010, 11012-13: Provincia de Loja: Cajanuma, Parque Nacional Podocarpus (4° 6ʹ30.05”S, 79° 9ʹ43.37”W, 3313 m).
Pristimantis erythros: MZUA.A.1335, 1347–50, 1352–55: Provincia del Azuay: Chanlud, Ecuador (2°40ʹ56.11”S, 79°02ʹ00.34”W, 3512m); MZUA.A.1351: Provincia del Azuay: Chanlud, Ecuador (2°40ʹ49.20”S, 79°02ʹ34.01”W, 3521m); MZUA.A.1342-43: Provincia del Azuay: Chanlud, Ecuador (2°41ʹ15.22”S, 79°02ʹ10.21”W, 3792m).
Pristimantis orcesi: QCAZ 01025, 01028, 01030-31, 12581, 12584: Provincia de Bolívar, Bosque Protector Cashca Totoras, Ecuador (1°42ʹ41.40”S, 78°58ʹ40.98”W, 3036m); QCAZ 00744, 01125, 39783: Provincia de Pichincha, Bosque Protector Pasochoa, Ecuador (0°26ʹ24.49”S, 78°30ʹ15.23”W, 3052m); QCAZ 43217, 432220: Provincia de Chimborazo, Lagunas de Atillo, Ecuador (2°10ʹ55.45”S, 78°32ʹ46.86”W, 3497m); DHMECN 2903: Provincia de Napo, Quebrada de Condor Pamba, Ecuador (0°36ʹ57.02”S, 78°10ʹ39.11”W, 3779m); JBM 1422, 1424, 1445: Provincia de Chimborazo, Cubillines (1°45ʹ33.19”S, 78°29ʹ16.11”W, 3800m).
Pristimantis pycnodermis: MZUA.A. 0573, 0579, 0595, 0598-99, 0873, 0888, 0897, 0901-02: Provincia de Morona Santiago, Bosque y Vegetación Protectores Tinajillas-Río Gualaceño, Ecuador (3° 0ʹ43.12”S, 78°38ʹ39.86”W, 3204m; 3° 0ʹ27.86”S, 78°38ʹ55.68”W, 3195m; 3° 0ʹ21.08”S, 78°38ʹ50.94”W, 3072m; 3° 0ʹ23.78”S, 78°38ʹ52.23”W, 3229m; 3° 0ʹ9.56”S, 78°39ʹ4.66”W, 3204; 3° 0ʹ10.02”S, 78°39ʹ6.31”O, 3195m; 3° 0ʹ43.67”S, 78°38ʹ38.53”W, 3072m); MZUA.A. 1850: Provincia de Cañar, Dudas, Ecuador (2°36ʹ46.40”S, 78°42ʹ17.34”W, 3254m); MZUA.A. 1868, 1883: Provincia de Cañar, Guangra, Ecuador (2°29ʹ28.64”S, 78°36ʹ17.23”W, 2773m); MZUA.A. 1913, 1925: Provincia de Cañar, Monay, Ecuador (2°31ʹ55.49”S, 78°37ʹ5.95”W, 3348m); MZUA.A. 1953: Provincia de Cañar, Zhoray, Ecuador (2°33ʹ12.14”S, 78°38ʹ44.62”W, 2928m); MZUA.A. 2065, 2088: Provincia de Morona Santiago, Parque Nacional Río Negro-Sopladora, Ecuador (2°47ʹ18.04”S, 78°36ʹ5.37”W, 3097m; 2°47ʹ13.21”S, 78°35ʹ56.55”W, 2935m); MZUA.A. 2628, 2634, 2637: Provincia de Chimborazo, Parque Nacional Sangay, Ecuador (2°10ʹ29.79”S, 78°29ʹ59.71”W, 3447m); MZUA.A. 2888: Provincia de Cañar, Colepato, Ecuador (2°31ʹ49.23”S, 78°44ʹ14.78”W, 3519m).