RESUMEN
Estudiamos la historia natural de Osteocephalus castaneicola en el suroeste de la Amazonia. Usamos observaciones de un experimento no exitoso pero relevante, entre enero de 2009 y enero de 2010 en la Fazenda Experimental Catuaba, así como de registros de diez recipientes para almacenamiento de látex entre enero y marzo del 2011 y 2012 en la Fazenda Bonal. Los datos de campo de ambas áreas y de colecciones biológicas permitieron mostrar aspectos de su reproducción en fitotelmata, variación fenotípica, canto de anuncio y generar un mapa de distribución actual de Osteocephalus castaneicola. Esta especie evidenció una gran plasticidad reproductiva en los tipos de fitotelmata, desde la preferencia de bambús muertos y cápsulas de castaña brasileña (Bertholletia excelsa) en el suelo, hasta huecos de árboles en diferentes estratos cerca al dosel. Hubo diferencia en el número de huevos y tipo de cuidado parental para congéneres restantes. Registramos reproducción estacional restringida a la época lluviosa y especializada con renacuajos caníbales con suministro facultativo de huevos tróficos. Su canto de anuncio está compuesto por 23.4 cantos promedio por minuto y una frecuencia dominante que oscila entre 0.486 y 0.904 kHz. La distribución de esta especie fue ampliada de la previamente conocida, mostrando una gran plasticidad ecológica en diferentes hábitats.
Palabras-claves:
Introducción
Los anfibios poseen una de las mayores diversidades de modos reproductivos entre los vertebrados [Citation1]. Esa diversidad es bien notada en la región neotropical, donde la heterogeneidad ambiental combinada a condiciones de alta humedad y factores de segregación espacio-temporal permiten la coexistencia de una gran cuantidad de especies [Citation2]. En la Amazonía, los diferentes ambientes y las diferentes estrategias reproductivas permitieron a las especies el desenvolvimiento de diversos tipos de reproducción [Citation3]. El modo reproductivo considerado más sencillo y posiblemente por el cual todos los otros fueron originados, es conocido como el modo 1, que se caracteriza porque los huevos son depositados directamente en la superficie del agua de ambientes lénticos permitiendo el desarrollo de renacuajos exotróficos [Citation1]. Desde la primera clasificación propuesta por Crump [Citation2], que envuelve los modos reproductivos en comunidades de anuros, muchos trabajos han utilizado esas categorizaciones para organizar las especies en “guildas reproductivas”. Uno de los trabajos más completos sobre el asunto fue escrita por Hödl [Citation3], donde detalla con más clareza los modos reproductivos para la región Amazónica. Así mismo, Haddad y Prado [Citation4] hicieron la mayor revisión contemplando diez nuevos modos reproductivos y totalizando así, 39 para la clase Amphibia. El uso de fitotelmata para reproducción es encontrado para más de 100 especies de anfibios anuros [Citation5], esto representa aproximadamente el 2% de anuros conocidas y el 40% de estas especies tienen algún tipo de cuidado parental [Citation5]. Recientemente, de los diez tipos de cuidado parental propuestos por Lehtinen y Nussbaum [Citation6], los anuros fitotelmata exhiben en lo mínimo seis (construcción de nidos, asistencia y transporte para los huevos, y asistencia, transporte y alimentación para renacuajos). Este número es considerable, ya que pocos son los estudios sobre cuidado parental en estas especies de la región Neotropical.
Entre las especies que utilizan el bambú como sitios de reproducción, existen diversos linajes, y eso puede ayudar a entender como evolucionaron las diferentes estrategias adaptativas, tales como: tamaño de los individuos adultos, de las desovas y renacuajos, y el modo reproductivo [Citation7]. El uso de fitotelmata para reproducción en hílidos es conocido para varias especies [Citation8,Citation9] y representan cinco de los 39 modos reproductivos conocidos [Citation10]. En el suroeste de la Amazonia, existen por lo menos doce especies que utilizan este tipo de ambiente para reproducción, distribuidas en las familias: Aromobatidae, Bufonidae, Dendrobatidae y Hylidae [Citation11]. Él género Osteocephalus Steindachner, 1862, abriga más de 26 especies descritas [Citation12,Citation13], siendo uno de los grupos taxonómicamente incierta de los anfibios anuros [Citation14]. Dentro de este género, el uso de fitotelmata es bien conocido para especies que utilizan bromelias [Citation15,Citation16]. Este grupo ha recibido atención en diversos trabajos enfocados en taxonomía [Citation17,Citation18,Citation19,Citation20,Citation21] y biología reproductiva [Citation22]. La difícil definición para las especies de este género es notada cuando constatamos que casi la mitad de sus especies fue descrita en los últimos 25 años [Citation12,Citation13,Citation23] y varias especies fueron revalidadas o encuadradas en sinonimias [Citation17,Citation20,Citation21,Citation23]. Osteocephalus castaneicola Moravec, Aparicio, Guerrero-Reinhard, Calderón, Jungfer & Gvoždík, 2009, es una especie que utiliza cápsulas de castaña [Citation24] y culmos de bambú [Citation25] para su reproducción; sin embargo, poco se conoce sobre las asociaciones interespecíficas en esos ambientes y su distribución, y no existen informaciones sobre su canto de anuncio. El trabajo de campo con muestreos sistemáticos y logística escasa en la Amazonía, hace que el reto se convierta en un gran esfuerzo. Sobre esto Crump [Citation10] afirma:
“Aunque es difícil obtener fondos para llevar a cabo el trabajo de campo de observación y publicar observaciones de historia natural, debemos continuar describiendo la realidad”.
Bajo esta premisa, presentamos aquí un resumen detallado que incorpora datos obtenidos durante una década de estudio. En este trabajo se presentan informaciones sobre historia natural de Osteocephalus castaneicola, describimos su canto de anuncio y basado en datos de museos, presentamos una actualización de su distribución. Por último, proporcionamos grabaciones para facilitar su detección durante inventarios en la Amazonía.
Materiales y métodos
Área de estudio
Las observaciones de campo fueron realizadas en dos áreas: la Fazenda Experimental Catuaba (FEC) y la Fazenda Bonal (FB). La FEC es un remaneciente forestal de 820 ha (10º04ʹ53” S; 67º37ʹ19” W) perteneciente a la Universidade Federal do Acre, localizado en el municipio de Senador Guiomard, Acre, Brasil. La vegetación predominante en el área es un mosaico de bosque abierto con bambús de la especie Guadua weberbaueri [Citation26]. La FEC posee una vegetación bien preservada (bosque primario que sufrió corte selectivo), bosque secundario (purma) en diversas etapas de sucesión, y el área es circundada por pastizales [Citation27]. Y la Fazenda Bonal (FB), un fragmento forestal de 10.000 ha (9º53ʹ45.1” S; 67º18ʹ14.8” W) con las mismas características forestales del sitio anterior.
Muestreo y Metodología muestral
Los muestreos en la FEC ocurrieron entre enero de 2009 y enero de 2010 totalizando 42 visitas. Las colectas durante el periodo lluvioso acontecieron en intervalos semanales, mientras que, en el período de estiaje fueron quincenales. En la FB, los datos fueron colectados quincenalmente entre enero y marzo del 2011 y 2012. Las definiciones referidas a la precipitación acompañan lo observado por [Citation27]. La mayor parte del muestreo durante el periodo lluvioso (noviembre hasta abril), fue debido a la mayor actividad de vocalizaciones y reproducción de anfibios del área [Citation27,Citation28]. Para los muestreos diurnos y nocturnos, fue empleado el método de búsqueda activa [Citation29], que consiste en la verificación de todos los estratos de la vegetación, removiendo ramas, troncos caídos y hojarasca.
Escogimos áreas con alta densidad de bambús (más de 2000 culmos/ha) e instalamos al azar diez parcelas de 20 x 25 m, totalizando 5000 m2 en la FEC. Se muestrearon las diez parcelas añadiendo 19 nidos en culmos de bambú en nueve de ellas, manteniendo una como el control, totalizando 171 nidos disponibles en alturas desde 0.5 m hasta 4 m. Todos los culmos y aquellos considerados como adultos (sensu Silveira [Citation26]) fueron considerados para observaciones de potenciales nidos de Osteocephalus castaneicola. La instalación de los nidos fue en bambús vivos.
Para el mantenimiento del volumen de agua dentro de los parámetros similares a los nidos naturales (entre 50 y 300 ml), retiramos agua retenida en otros bambús vivos de áreas adyacentes y depositamos en los nidos experimentales. Este procedimiento se llevaba a cabo en los meses secos (desde mayo hasta octubre) y fue adaptado para nidos que fueron quebrados por la acción natural (viento y/o troncos y ramas que caían sobre los mismos).
Este diseño permitió a priori contemplar los mejores rangos de ocupación de la especie, también porque es la altura donde previamente habíamos escuchado machos vocalizando y finalmente, porque es muy difícil manejar un bambú con alturas superiores a 4 m debido a la presencia de espinos y por el riesgo para el investigador en alturas por encima de ese límite.
Además, hicimos registros nocturnos durante la estación lluviosa de dos años en antiguos shiringales de la FB en diez recipientes para almacenamiento de látex de Hevea brasiliensis (shiringa) fijados a la altura de 1.3 m.
En ambas áreas, fue observada la ocurrencia de sitios de oviposición (bambú vivo o muerto, castañas y hueco de árbol), tamaño de las desovas, tipo de cuidado parental, duración del desarrollo embrionario de tres cohortes y comportamiento de renacuajos. Para la variación fenotípica, se midió la longitud hocico-cloaca (LHC) de machos y hembras de individuos registrados en campo y especímenes de las colecciones herpetológicas de la Universidade Federal do Acre, Rio Branco, Acre y del Museu Nacional, Rio de Janeiro, Brasil. Relaciones interespecíficas en fitotelmata y actividad en el sitio de reproducción también fueron observadas.
Canto de anuncio
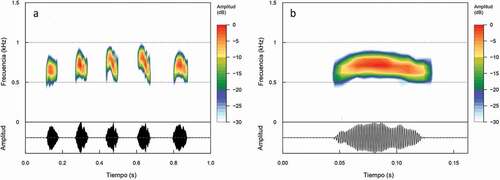
Las vocalizaciones fueron grabadas de machos vocalizando desde 1.5 m a 2.5 m de altura. Se grabaron cantos con el uso de un grabador portátil Sony® ICX-50 digital recorder con las configuraciones: formato .WAV, canal mono, 44.1 kHz y 16 bits de resolución. Las mejores grabaciones fueron digitalizadas y filtradas de ruido, para analizar los temporales con el programa Praat 6.0.37 [Citation30]. Los análisis espectrales se realizaron en el programa Raven Pro®1.6.1. [Citation31], con la ventana de Hann al 50% de superposición y 512 puntos de resolución de la transformación rápida de Fourier (FFT).
Los oscilogramas y espectrogramas fueron graficados con el programa R versión 3.6.3 [Citation32], por medio del paquete Seewave versión 2.1.6 [Citation33], importando los archivos audio en formato .WAV con la ayuda del paquete tuneR versión 1.3.3 [Citation34].
Los parámetros que se analizaron fueron: cantos/minuto: tasa de repetición de llamados en el lapso de un minuto; duración del canto: tiempo desde el inicio hasta el final de un llamado; intervalos entre cantos: tiempo transcurrido entre llamado y llamado; notas/canto: número de unidades acústicas de un determinado patrón de amplitud reconocido en los cantos; duración de las notas; intervalos entre las notas y la frecuencia dominante: frecuencia de mayor energía medida a lo largo de todo el canto y en todos sus componentes. Las definiciones y mediciones de los parámetros utilizados se basaron según los términos de [Citation35]. Para cada parámetro se calcularon las medidas de dispersión: máximo, mínimo, media y desviación estándar.
Distribución geográfica
Se utilizaron las coordenadas geográficas de publicaciones previas [Citation10,Citation24,Citation36–44], datos de muestreos de campo y especímenes de las colecciones herpetológicas arriba mencionadas, con el fin de generar un mapa de la distribución actual de Osteocephalus castaneicola con el programa ArcMap 10.5.
Resultados
Ocurrencia de sitios de oviposición y cuidado parental
Osteocephalus castaneicola es una especie fitotelmata obligatoria. Entretanto, utiliza tanto culmos de bambús como huecos de árboles para vocalizar y reproducirse a diferentes alturas en el sotobosque (hasta ocho metros), y cápsulas de castaña brasileña en el suelo.
Fueron encontrados 11 desovas en nidos naturales dentro de las parcelas que variaron entre 7 a 138 huevos, teniendo una cantidad promedio de 50 ± 37.69 huevos. En esos nidos, todos los culmos estaban muertos, dispuestos de manera horizontal y sus aberturas fueron más largas que las proporcionadas en los nidos experimentales cortados, para facilitar la deposición de huevos. Apenas en dos nidos experimentales cortados (3.5%) hubo deposición de huevos, el diámetro medio de los huevos fue de 1.16 ± 0.04 mm (N = 10) en nidos vivos con agua limpia ().
Figura 1: A – Renacuajo de Osteocephalus castaneicola canibalizando un renacuajo pequeño (flecha roja), en culmo de bambú. B – Renacuajo de Ranitomeya sirensis (flecha amarilla) coexistiendo con desova de O. castaneicola. C y D – Desova de O. castaneicola en cápsulas de castaña brasilera (Bertholletia excelsa). En la foto D, los renacuajos alimentándose de huevos de Rhinella castaneotica. E – Embriones y renacuajos de O. castaneicola mostrando branquias externas lado a lado con una pupa de Toxorhynchites sp. F – Desova de O. castaneicola en culmo de bambú

En cinco ocasiones fue observada la deposición de huevos para renacuajos. No fue constatada la asistencia de huevos. Así mismo, dos tipos de cuidado parental fueron observados: 1) asistencia de los renacuajos, que fue hecha por el macho (N = 1) y 2) deposición de huevos tróficos (N = 3). Consumo de huevo de Rhinella castaneotica Caldwell, 1991 también fueron presentados en esta especie (N = 2).
Desarrollo embrionario y comportamiento de renacuajos
En cuanto al tiempo de desarrollo, tres cohortes fueron acompañadas semanalmente en condiciones naturales:
cohorte 1 – el día 28 de noviembre de 2009 encontramos 70 huevos no fertilizados y 17 renacuajos de otra cohorte que estaban también presentes en el lugar. Completaron la metamorfosis el 26 de diciembre de 2009 (29 días);
cohorte 2 – el día 22 de noviembre encontramos 173 renacuajos en una cápsula de castaña y como no fueron depositados huevos tróficos, los primeros renacuajos completaron la metamorfosis en un tiempo mayor (43 días);
cohorte 3 – el 24 de octubre fueron encontrados 21 renacuajos en bambú muerto. Estos fueron fotografiados y siete renacuajos fueron recogidos, quedándose 14. El día 31 de octubre hubo apenas 6 renacuajos (mortalidad de 57.2% a la semana). El 7 de noviembre hubo una deposición de 67 huevos. El 14 de noviembre los renacuajos de la segunda deposición están desarrollándose con los primeros. Desde 21 de noviembre hasta 28 de noviembre se mantuvieron todos y el 5 de diciembre todos los renacuajos del 24 de octubre completaron la metamorfosis después de 49 días.
Fue constatado que los renacuajos de esta especie son caníbales (incluyendo oofagia). Así mismo, fueron encontrados en cinco ocasiones renacuajos de O. castaneicola en tres cápsulas de castaña y en dos oportunidades, en recipientes para colecta de látex ( y 2), en dos de las castañas hubo deposiciones de ovocitos. En algunas de las deposiciones de huevos tróficos, ocasionalmente, también se registró deposiciones de huevos fecundados y renacuajos en desarrollo con pocas chances de supervivencia, debido a que los individuos mayores son caníbales y atacan individualmente o en grupos de hasta cinco renacuajos (). En nidos donde existe mayor presencia de sedimento, esas chances son aumentadas, ya que los renacuajos de mayor tamaño ocasionalmente consumen detritos y los renacuajos de menor tamaño se refugian dentro del sedimento.
Figura 2: A – Vaso para colecta de látex de shiringa con renacuajos. B – Renacuajos de Osteocephalus castaneicola con huevos en el intestino y renacuajo de Ranitomeya sirensis (izquierda) coexistiendo con ellos. C, D y E – Renacuajos de O. castaneicola en vasos de shiringa en diferentes fases. F – Renacuajos de O. castaneicola con patas en desarrollo. G – Metamorfo de O. castaneicola con rodillas y codos blancos, ojos rojos y cola casi totalmente reabsorbida. H – Juvenil de O. castaneicola

Variación fenotípica
La variación fenotípica está presente en la especie, los machos adultos generalmente son menores que las hembras adultas. La longitud hocico-cloaca (LHC) en los machos adultos (–C,E,G,H) varía entre 46.1 y 48.8 mm (47.77 ± 1.17 mm, N = 4) y para las hembras están entre 47.7 y 59.8 mm (53.4 ± 6.64 mm, N = 4) (,F). Una característica que distingue fácilmente machos de hembras, es la presencia de callos nupciales con un tono oscuro en los pulgares de machos adultos y ausente en las hembras.
Figura 3: Variación fenotípica de adultos encontrados en el presente estudio. A y B – machos en reposo. C – Macho activo saltando fuera de un culmo de bambú. D – hembra en reposo. E – Macho vocalizando dentro de un culmo de bambú. F – hembra (UFAC-RB 4798) con coloración más oscura. G – macho vocalizando fuera de un culmo de bambú. H – macho vocalizando en hueco de árbol

Relaciones interespecíficas
En las dos ocasiones en que coexistieron renacuajos de Ranitomeya sirensis Aichinger, 1991 sensu Brown et al. [Citation45], en ninguna vez fue observada el comportamiento predatorio interespecífico. Con respecto a renacuajos de Osteocephalus castaneicola, fue posible observar diferentes estrategias comportamentales para la supervivencia en fitotelma, por ejemplo: la formación de grupos de hasta cinco individuos para la práctica de canibalismo hasta el estado de surgimiento de patas posteriores, el renacuajo se mantiene en el fondo del fitotelma o adherido a la pared interna fuera del agua y no es más observado practicando canibalismo. La variación de comportamiento durante la ontogenia larval puede entonces justificar la sobrevivencia de diferentes cohortes en el mismo ambiente. A pesar de la práctica de canibalismo ser común entre renacuajos de O. castaneicola, en la presencia de uno de los padres los renacuajos no exhiben tal comportamiento [Citation22]. Sugerimos así, que la espera por la deposición de huevos no fertilizados sea la causa para el mantenimiento de una cantidad mínima de individuos en el fitotelma.
Actividad en el sitio de reproducción
Varios machos fueron observados en actividades de vocalización entre los meses de octubre a abril. Los machos empezaban la actividad a las 16:53 h hasta la 1:44 h. El pico de actividad de vocalización fue entre 20:30 h y 22:30 h. La actividad reproductiva ocurre solamente en ese período, demostrando que la especie presenta una reproducción altamente influenciada por la estacionalidad. Osteocephalus castaneicola a pesar de tener su temporada reproductiva estrictamente relacionada a la época lluviosa, fue observada la deposición de dos desovas fuera del agua, estando el fitotelmata apenas húmedo. Este hecho puede sugerir que la pareja en amplexo a veces puede “predecir” los fitotelmata que estarán llenos con agua, o que tal ambiente haya sido utilizado por el macho como un sitio de vocalización o de un apareamiento anterior. Semanalmente, un macho fue acompañado en el sitio de vocalización desde el 30 de enero () hasta el amplexus y deposición de huevos por la hembra el día 28 de febrero, después de cuatro semanas.
Fueron encontrados pocos individuos en las parcelas muestreadas (cuatro machos y tres hembras), mientras que, en áreas adyacentes, fue posible observar la presencia de pequeños agrupamientos con hasta ocho machos vocalizando en un área de aproximadamente una hectárea. En esa área, así como en gran parte de la FEC, es posible encontrar varias castañas y huecos de árboles, que, así como el bambú, proporcionaron fitotelmata. Además, fueron encontradas dos desovas de esta especie en cápsulas de castaña ( y 1D).
Canto de anuncio
Analisamos 117 cantos emitidos por dos machos de O. castaneicola. Presentó una tasa de repetición de 23.4 ± 9.61 (N = 5) cantos por minuto. Esos cantos tuvieron una duración entre 0.267 y 1.115 segundos (0.77 ± 0.22, N = 60) y estaban en intervalos de 0.127 – 5.852 segundos (2.15 ± 1.34, N = 60). Cada canto tuvo entre 2 y 7 notas (4.85 ± 1.35, N = 40), con duraciones entre 74 y 283 milisegundos (103.33 ± 31.57, N = 40) y distanciados por 26 – 996 ms (94 ± 147.94, N = 40). Presenta una frecuencia dominante de 0.486 – 0.904 kHz (0.641 ± 0.113, N = 60) ().
Distribución geográfica
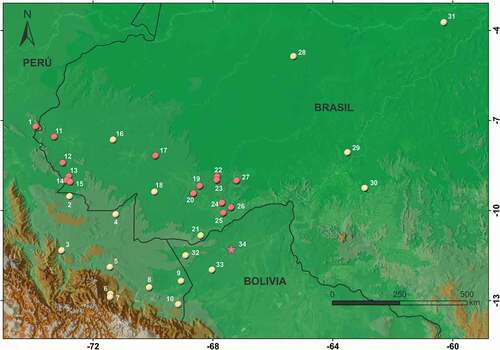
Osteocephalus castaneicola fue descrita para Bolivia y registrado en Brasil para los estados de Amazonas [Citation38,Citation43], Rondônia [Citation39] y Acre [Citation42]. También se reporta esta especie para Perú [Citation23,Citation36,Citation40,Citation41,Citation44,Citation46,Citation58]. Además de los muestreos de campo, ejemplares depositados en la colección herpetológica de la Universidad Federal do Acre y del Museu Nacional do Rio de Janeiro permitieron datos de una gran variedad de ambientes ocupados (). El sitio de la FEC {sitio 25} se ubica 137 km en línea recta desde la localidad tipo en las cercanías del asentamiento San Antonio de Filadelfia {sitio 34} en Bolivia, 257 km al este del registro más cercano en Parque Estadual Chandless {sitio 18}, y en Acre llenando un vacío muestral a 118 km con respecto a Pousada Cachoeira {sitio 21} y 525 km hasta la Flona de Jamari en Rondônia. Nuestros registros expanden la distribución en Perú hasta la Región Loreto, a 287 km noroeste del sitio más próximo en Breu, rio Yuruá {sitio 2}.
Figura 5: Distribución geográfica de Osteocephalus castaneicola. Esfera roja: este estudio; esfera amarilla: otros estudios; estrella: localidad tipo. Sitios: Contamana (1); Puerto Breu (2); Miaria (3); Balta (4); Cocha Cashu (5); Villa Carmen Biological Station (6); Manu (7); Los Amigos (8); Gamitana (9); Quebrada Chocolatillo (10); Juazeiro, Mâncio Lima (11); Casa de Farinha, Porto Walter (12); Minas Gerais, Marechal Thaumaturgo (13); Auzira, Marechal Thaumaturgo (14); Caminho do Arara, Marechal Thaumaturgo (15); Reserva Extrativista do Rio Gregório (16); Jurupari, Feijó (17); Parque Estadual Chandless, Manuel Urbano (18); Colônia Shekinah/Água Viva, Sena Madureira (19); Fazenda São Jorge/Triunfo, Sena Madureira (20); Seringal Cachoeira (21); Manitiã, Boca do Acre (22); São José, Boca do Acre (23); Reserva Florestal Humaitá, Porto Acre (24); Fazenda Experimental Catuaba, Senador Guiomard (25); Colônia do Marquinho, Senador Guiomard (26); Bode Preto, Boca do Acre (27); Porto Urucu (28); Estação Ecológica do Cuniã (29); Floresta Nacional do Jamari (30); Careiro da Várzea (31); Santo Antonio del Matti (32); El Tigre (33); Santo Antonio de Filadelfia (34)
Discusión
El tipo y tamaño del fitotelmata influencian en el comportamiento y estrategias reproductivas de varias especies [Citation2,Citation47]. Aunque la competencia interespecífica y depredación sean menores en este tipo de ambiente, la escasez de nutrientes para el desarrollo de los renacuajos ha permitido algún tipo de oferta para la prole [Citation48], evidenciando un cuidado parental facultativo en Osteocephalus castaneicola siendo restricto a la disponibilidad de huevos.
Brown et al. [Citation49] mostraron que el canibalismo de embriones no ocurre en Ranitomeya variabilis (Zimmermann & Zimmermann, 1988), sin embargo, los machos adultos depositan renacuajos en fitotelma que contienen embriones, y estos a su vez, son carnívoros que incluyen en la dieta a los renacuajos de Ranitomeya imitator (Schulte, 1986). Aunque haya este tipo de parasitismo reproductivo, renacuajos de R. variabilis no consumen huevos tróficos proporcionados por R. imitator [Citation49]. Contradiciendo esta lógica común entre dendrobatídeos, los renacuajos de O. castaneicola son caníbales con oofagia y no depredan renacuajos de R. sirensis. No es conocido hasta el momento el mecanismo adoptado por ambas especies para evitar predación, mientras tanto, son predadores de los huevos de Rhinella castaneotica. Los mecanismos que permiten esta predación son desconocidos, ya que los bufónidos constituyeron uno de los grupos donde ha evolucionado la impalatabilidad de sus huevos [Citation50] y su fase larval [Citation50–52]. No obstante, Caldwell [Citation53] en un experimento sobre predación ha encontrado que el tamaño poblacional es fundamental para la supervivencia de Rhinella castaneotica cuando coexiste con renacuajos de Adelphobates castaneoticus (Caldwell & Myers, 1990) y otros predadores invertebrados, donde el tiempo de desarrollo larval es tal vez el factor importante.
Osteocephalus planiceps Cope, 1874 divide su desova según la cantidad de huevos depositados como adaptación reproductiva para maximizar su fitness [Citation16]. Dicho comportamiento, no puede ser acompañada en O. castaneicola, ya que esta por poseer una menor longitud hocico-cloaca (LHC) presenta una proporción menor en su desova, similar a lo reportado por [Citation2] en una comunidad de anuros en el Ecuador mostrando una relación directamente proporcional entre la LHC de hembras y el tamaño de desovas.
Para el uso de fitotelma, algunas adaptaciones morfológicas y comportamentales son necesarias [Citation23,Citation54,Citation55,Citation56], en las cuales los machos de estas especies poseen un tamaño relativamente menor comparado a individuos del mismo género que poseen modos menos especializados de reproducción como O. leprieurii (Duméril & Bibron, 1841) y O. taurinus Steindachner, 1862 [Citation14]. Las especies oofagas poseen menos desovas [Citation55] porque están directamente relacionadas al tamaño corpóreo y al tipo de cuidado parental [Citation2]. En las especies de Osteocephalus que son fitotelmata, el saco vocal es gular (a veces semicircular), tornando posible la vocalización en ambientes con espacios reducidos [Citation23]. Osteocephalus castaneicola además de todas esas adaptaciones, es la primera especie del género conocida por no tener saco vocal ni pliegues vocales, lo que posiblemente justifica su canto en baja frecuencia (0.486 – 0.904 kHz), aprovechando los huecos de árboles y culmos de bambú como cajas de resonancia, contrastando con otras especies del clado de O. planiceps que utilizan bromelias [Citation23]. Otras características encontradas para estas especies fitotelmata, son la ausencia de aglomeraciones cuando cada macho vocaliza desde su propio sitio de reproducción, lo que justifica su fidelidad con un máximo de ocho individuos de O. castaneicola vocalizando simultáneamente. La fidelidad del sitio de vocalización en culmos de bambú es un hecho nuevo para O. castaneicola, similar a lo reportado en huecos de árboles para Trachycephalus resinifictrix (Goeldi, 1907) [Citation9] y para O. vilarsi (Melin, 1941) [Citation57], también se conoce la fidelidad de sitio en bromelias para O. deridens Jungfer, Ron, Seipp, & Almendáriz, 2000 [Citation55].
Debido a la alta tasa de mortalidad del bambú [Citation26] por factores naturales no se pudo testear la preferencia entre alturas de oviposición en los bambús, por lo tanto, no fue posible inferir si existe o no, diferencias significativas en la altura de los sitios reproductivos para una población de O. castaneicola en el sureste de Perú [Citation25]; de esta manera, nuestras observaciones no pueden refutar o afirmar estadísticamente los registros obtenidos en Whittaker et al. [Citation25]. Todos los tratamientos de alturas en nidos experimentales puestos a disposición no fueron utilizados por O. castaneicola. Creemos que es más importante el ángulo y el espacio apropiado para la pareja y el tamaño de la apertura en el culmo, basado en nuestras observaciones registradas en vasos para látex ( – F), similar a lo reportado en Ranitomeya sirensis [Citation61].
Es necesario mencionar que en tres ocasiones encontramos renacuajos en nidos de bambú vivos, todas las otras deposiciones de huevos y desarrollo de renacuajos fueron en bambús muertos. Como los nidos proporcionados fueron dispuestos verticalmente, el espacio se torna más reducido y probablemente esto no sea lo más adecuado para todo el ritual de cortejo. La quiebra del bambú vivo o muerto es un importante factor para la selección del sitio de oviposición de la prole, reduciendo el esfuerzo energético de esta tarea en los individuos adultos.
Muestreos en cápsulas de castaña son necesarias para testear el efecto de competición con otras especies a lo largo de su distribución. Hasta el momento, ninguna otra especie de Osteocephalus utiliza este recurso para la reproducción [Citation26, Citation27], y en el área de la FEC, apenas Allobates hodli Simões, Lima & Farias, 2010, Ameerega hahneli (Boulenger, 1884), Ameerega trivittata (Spix, 1824) y Rhinella castaneotica las utilizan para desarrollo de renacuajos.
La gran plasticidad ecológica de Osteocephalus castaneicola le ha permitido ocupar desde bosques abiertos con bambú, bosques densos hasta regiones submontanas, en gran parte del Arco Fitzcarrald y la llanura amazónica. De esta manera, esta especie puede ocupar varios sitios de reproducción, ya que sus desovas presentan una amplia variedad de fitotelmata a diversos estratos, habiendo registros oportunistas en nidos artificiales tales como trampas de caída (pitfall traps) [Citation58] y recipientes plásticos para colecta de látex (este estudio). Su reproducción también ocurre en estratos más altos del sotobosque, donde raramente alcanza el dosel, probablemente evitando competencia interespecífica por huecos de árboles con Trachycephalus cunauaru Gordo, Toledo, Suárez, Kawashita-Ribeiro, Ávila, Morais & Nunes, 2013.
Conclusiones Finales
Algunos de los factores que contribuyen en el mantenimiento de las poblaciones de Osteocephalus castaneicola son: 1) desovas grandes (hasta 170 huevos); 2) desarrollo relativamente rápido (diez días para eclosión de renacuajos y seis semanas para metamorfosis); 3) alta tasa de capacidad de retención de agua en los culmos de bambú durante la estación lluviosa; 4) deposición de múltiples desovas en el mismo fitotelmata debido a la fidelidad de los machos en los sitios reproductivos.
Por lo tanto, mayor cantidad y variedad de sitios de reproducción favorecen las chances para el aumento en las poblaciones de O. castaneicola, disminuyendo la competencia intraespecífica al no mostrar preferencias por alturas en la deposición de renacuajos. Una mejor comprensión sobre el uso de fitotelmata para reproducción de anuros en bosques neotropicales será obtenido con un aumento en el esfuerzo muestral, principalmente por encima del alcance de las manos de los herpetólogos y con uso de otras metodologías [Citation59,Citation60], incluyendo muestreos específicos en el dosel.
Material Testigo
Osteocephalus castaneicola (N = 32) BRASIL: Acre: Feijó: Jurupari UFAC-RB 4437, 4443, 4493. Mâncio Lima: Juazeiro UFAC-RB 1662; Porto Walter: Casa de Farinha UFAC-RB 1864. Manoel Urbano: Parque Estadual Chandless T7 UFAC-RB 4517-18. Marechal Thaumaturgo: Minas Gerais UFAC-RB 1966; Caminho do Mato Grosso UFAC-RB 2197-98; Caminho do Arara UFAC-RB 2468; Auzira UFAC-RB 2652, 2654. Sena Madureira: Colônia Água Viva (Shekinah) UFAC-RB 4706, 4726. Senador Guiomard: Colônia do Marquinho UFAC-RB 5753; Fazenda Experimental Catuaba MNRJ 91672, UFAC-RB 4586, 4587, 4588, 4589, 4590, 4591, 4598, 5197, 5652-53. Porto Acre: Reserva Florestal Humaitá UFAC-RB 5756-57. Amazonas: Boca do Acre: UFAC-RB 4149. PERU: Loreto: Contamana: UFAC-RB 3598-99, 3605.
Additional information
Funding
REFERENCIAS BIBLIOGRÁFICAS
- Duellman WE, Trueb L. Biology of Amphibians. Baltimore: Johns Hopkins University Press; 1994.
- Crump ML. Reproductive Strategies in a Tropical Anuran Community. Misc. Publ. Mus. Univ. Kansas. 1974;61:1–68.
- Hödl W. Reproductive diversity in Amazonian lowland frogs. In: Hanke W, editor. Fortschritte der Zoologie, Band/Vol. 38. Biology and Physiology of Amphibians Stuttgart and New York: Gustav Fischer Verlag; 1990. p. 41–60.
- Haddad CFB, Prado CPA. Reproductive modes in frogs and their unexpected diversity in the Atlantic Forest of Brazil. Bioscience. 2005;55(3):207–217.
- Lehtinen RM, Lannoo MJ, Wassersug RJ. Phytotelm-breeding anurans: past, present and future research. Miscellaneous Publications, Museum of Zoology, University of Michigan. 2004;193:1–9.
- Lehtinen RM, Nussbaum RA. Parental care: a phylogenetic perspective. Reproductive biology and phylogeny of Anura. 2003;2:343–386.
- Summers K, McKeon CS. The evolutionary ecology of phytotelmata use in Neotropical poison frogs. IN: Lehtinen RM (Ed.), Ecology and Evolution of phytotelm-breeding anurans. Miscellaneous Publication Museum of Zoology of the University of Michigan. 2004;193:55–73.
- Duellman WE, Trueb L. The systematic status and relationships of the hylid frog Nyctimatis rugiceps Boulenger. Occasional Papers of the Museum of Natural History University of Kansas. 1976;58:1–14.
- Schiesari LC, Gordo M, Hödl W. Treeholes as calling, breeding, and developmental sites for the Amazonian canopy frog, Phrynohyas resinifictrix (Hylidae). Copeia. 2003;(2):263–272.
- Crump ML. Anuran reproductive modes: evolving perspectives. Journal of Herpetology. 2015;49:1–16.
- Souza MB. Anfíbios: Reserva Extrativista do Alto Juruá e Parque Nacional da Serra do Divisor, Acre. IFCH: Campinas; 2009.
- Frost DR. Amphibian Species of the World: an Online Reference. Version 6.1 (31 May 2020). Electronic Database accessible at https://amphibiansoftheworld.amnh.org, index.php.American Museum of Natural HistoryNew York, USA; 2020. https://doi.org/https://doi.org/10.5531/db.vz.0001
- AmphibiaWeb. https://amphibiaweborg, University ofCalifornia,BerkeleyCA, USA; 2020. Accessed 31 May 2020.
- Trueb L, Duellman WE. A synopsis of neotropical hylid frogs, genus Osteocephalus. Occ. Pap. Mus. Nat. Hist. Univ. Kansas. 1971;1:1–47.
- Jungfer KH, Schiesari LC. Description of a new Central Amazonian and Guianan treefrog, genus Osteocephalus (Anura, Hylidae), with oophagous tadpoles. Alytes. 1995;13(1):1–13.
- Haugen L. Privation and uncertainty in the small nursery of Peruvian laughing frogs: larval ecology shapes the parental mating system. Tesis Doctoral no publicada, Norman: University of Oklahoma; 2002.
- Duellman WE, Mendelson III JR. Amphibians and reptiles from northern Departamento Loreto, Peru: taxonomy and biogeography. Univ. Kansas Sci. Bull. 1995;55:329–376.
- Ron SR, Toral E, Venegas PJ, et al. Taxonomic revision and phylogenetic position of Osteocephalus festae (Anura, Hylidae) with description of its larva. ZooKeys. 2010;70:67–92.
- Ron SR, Venegas PJ, Toral E, et al. Systematics of the Osteocephalus buckleyi species complex (Anura, Hylidae) from Ecuador and Peru. ZooKeys. 2012;229: 1–52.
- Faivovich J, Haddad CFB, Garcia PCA, et al. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History. 2005;294:1–240.
- Jungfer K.-H. The taxonomic status of some spiny-backed treefrogs, genus Osteocephalus (Amphibia: Anura: Hylidae). Zootaxa. 2010;2407:28–50.
- Jungfer K-H, Weygoldt P. Biparental care in the tadpole-feeding Amazonian treefrog Osteocephalus oophagus. Amphibia-Reptilia. 1999;20:235–249.
- Jungfer K-H, Faivovich J, Padial JM, et al. Systematics of spiny-backed treefrogs (Hylidae: Osteocephalus): an Amazonian puzzle. Zoologica Scripta. 2013;42:351–380.
- Moravec J, Aparicio J, Guerrero-Reinhard M, et al. A new species of Osteocephalus (Anura: Hylidae) from Amazonian Bolivia: first evidence of tree frog breeding in fruit capsules of the Brazil nut tree. Zootaxa. 2009;2215:37–54.
- Whittaker L, Whitworth A, Fowler A, et al. Bamboo traps as refugia for Pristimantis olivaceus (Anura: Craugastoridae) and as breeding site for Osteocephalus castaneicola (Anura: Hylidae). Phyllomedusa. 2015;14:157–161.
- Silveira M. A floresta aberta com bambu no sudoeste da Amazônia: padrões e processos em múltiplas escalas. Edufac: Rio Branco; 2005.
- Souza VM, Souza MB, Morato EF. Efeitos da sucessão florestal sobre a anurofauna (Amphibia: Anura) da Reserva Catuaba e seu entorno, Acre, Amazônia sul-ocidental. Revista Brasileira de Zoologia. 2008;25:49–57.
- Cardoso AJ, Souza MB. Distribuição temporal e espacial de anfíbios anuros no Seringal Catuaba, Estado do Acre-Brasil. In: Pérfaur JE. (Ed.) Herpetologia Neotropical - Actas del II Congreso latino Americano de Herpetologia. Universidad de Los Andes. Consejo de Publicaciones y Consejo de Desarrollo Científico, Humanistico y Tecnológico. Mérida. 1996; p. 271–292.
- Crump ML, Scott Jr NJ. Standard techniques for inventory and monitoring. Visual Encounter Surveys: 84–92. Measuring and monitoring biological diversity. Standard methods for amphibians. Smithsonian Institution Press: Washington and London; 1994.
- Boersma P, Weenink D. Praat: doing phonetics by computer (version 6.0.37); 2018.
- Bioacoustics Research Program. Raven Pro: interactive sound analysis software (version 1.6.1). Ithaca (NY): The Cornell Lab of Ornithology; 2019.
- R Development Core. Team. R: A language and environment for statistical computing (version 3.6.3). Vienna (Austria): R Foundation for Statistical Computing; 2019.
- Sueur J, Aubin T, Simonis C. Seewave, a free modular tool for sound analysis and synthesis. Bioacoustics. 2008;18:213–226.
- Ligges U, Krey S, Mersmann O, et al. tuneR: analysis of music. R package. 2018.
- Köhler J, Jansen M, Rodríguez A, et al. The use of bioacoustics in anuran taxonomy: theory, terminology, methods and recommendations for best practice. Zootaxa. 2017;4251(1):1–124.
- Duellman WE, Thomas R. Anuran amphibians from a seasonally dry forest in southeastern Peru and comparisons of the anurans among sites in the upper Amazon basin. Occasional papers of the Natural History Museum, the University of Kansas. 1996;180:1–34.
- Aguilar-Kirigin AJ. Osteocephalus castaneicola Moravec, Aparicio, Guerrero-Reinhard, Calderón, Jungfer & Gvozdík, 2009 (Anura: Hylidae). Extensión de su distribución geográfica y nuevo registro para el departamento de La Paz, Bolivia. Cuadernos de Herpetología. 2012;26:107–109.
- Pantoja D, de Fraga R. Herpetofauna of the Reserva Extrativista do Rio Gregório, Juruá Basin, southwest Amazonia, Brazil. Check List. 2012;8:360–374.
- Meneghelli D, Entiauspe-Neto OM. New records from Brazil and first record from the state of Rondônia of Osteocephalus castaneicola Moravec, Aparicio, Guerrero-Reinhard, Calderón, Jungfer & Gvoždík, 2009 (Anura: Hylidae) with an update on its geographical distribution. Check List. 2014;10:957–959.
- Padial JM, Gagliardi-Urrutia G, Chaparro JC, et al. Diversidad de anfibios y reptiles en el Parque Nacional Alto Purús, la Reserva Comunal Purús, y sus áreas de influencia. Diversidad biológica del sudeste de la Amazonia Peruana: avances en la investigación (C. Germaná and JL Mena Alvarez, eds.). Consorcio Purús-Manu: WWF, CARE Perú, ProNaturaleza, ProPurús, Sociedad Zoológica de Francfort, ORAU, Lima. 2015;105–121.
- López LK, Ruiz JA. Parque Nacional del Manu, Madre de Dios, Perú. Anfibios de la Estación Biológica Cocha Cashu. Field Museum, Chicago. 2016;1–6.
- Silva DP, Ramalho WP, de Matos LRA, et al. First record of Osteocephalus castaneicola Moravec, Aparicio, Guerrero-Reinhard, Calderón, Jungfer & Gvoždík, 2009 (Anura: Hylidae) for Acre, Brazil. Check List. 2016;12:1–3.
- Carvalho M, Peloso PLV, Sturaro MJ. On the distribution of Osteocephalus castaneicola Moravec, Aparicio, Guerrero-Reinhard, Calderón, Jungfer & Gvoždík, 2009 (Anura: Hylidae), with new records for Amazonian Brazil. Herpetology Notes. 2017;10:593–596.
- Russell ID, Larson JG, von May R, et al. Widespread chytrid infection across frogs in the Peruvian Amazon suggests critical role for low elevation in pathogen spread and persistence. PloS One. 2019;14.
- Brown, JL, Twomey E, Amézquita A, et al. A taxonomic revision of the Neotropical poison frog genus Ranitomeya (Amphibia: Dendrobatidae). Zootaxa 2011;3083:1–120.
- Venegas PJ, Crnobrna B. Reptiles y anfibios: La lista de especies de herpetofauna del Parque Nacional Bahuaja Sonene. Wildlife Conservation Society: Lima; 2013.
- Summers K. The effects of cannibalism on Amazonian poison frog egg and tadpole deposition and survivorship in Heliconia axil pools. Oecologia. 1999;119:557–564.
- Caldwell JP, de Oliveira VR. Determinants of biparental care in the spotted poison frog, Dendrobates vanzolinii (Anura: Dendrobatidae). Copeia. 1999;565–575.
- Brown JL, Twomey E, Morales V, et al. Phytotelm size in relation to parental care and mating strategies in two species of Peruvian poison frogs. Behaviour. 2008;1139–1165.
- Buxton V, Sperry J. Reproductive decisions in anurans: a review of how predation and competition affects the deposition of eggs and tadpoles. BioScience. 2017;67:26–38.
- Azevedo-Ramos C, Magnusson W. Tropical tadpole vulnerability to predation: association between laboratory results and prey distribution in an Amazonian savanna. Copeia. 1999;58–67.
- Karraker N. Are toad tadpoles unpalatable: evidence from the behaviour of a predatory dragonfly in South China. Amphibia-Reptilia. 2011;32(3):413–418.
- Caldwell JP. Brazil nut fruit capsules as phytotelmata: interactions among anuran and insect larvae. Canadian Journal of Zoology. 1993;71:1193–1201.
- Lynch JD. A new species of the genus Osteocephalus (Hylidae: Anura) from the western Amazon. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 2002;26:289–293.
- Jungfer K-H, Ron S, Seipp R, et al. Two new species of hylid frogs, genus Osteocephalus, from Amazonian Ecuador. Amphibia-Reptilia. 2000;21(3):327–340.
- Jungfer K-H, Hödl W. A new species of Osteocephalus from Ecuador and a redescription of O. leprieurii (Duméril & Bibron, 1841) (Anura: Hylidae). Amphibia-Reptilia. 2002;23: 21–46.
- Ferrão M, Moravec J, Moraes LJ, et al. Rediscovery of Osteocephalus vilarsi (Anura: Hylidae): an overlooked but widespread Amazonian spiny-backed treefrog. PeerJ. 2019;7:e8160.
- Villacampa J, Serrano-Rojas S, Whitworth A. Amphibians of the Manu Learning Centre and other areas of the Manu region. The Crees Foundation: Cusco, Peru; 2016.
- Lynch JD. Discovery of the richest frog fauna in the world–an exploration of the forests to the north of Leticia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 2005;29:581–589.
- Guayasamin JM, Ron SR, Cisneros-Heredia DF, et al. A new species of frog of the Eleutherodactylus lacrimosus assemblage (Leptodactylidae) from the western Amazon Basin, with comments on the utility of canopy surveys in lowland rainforest. Herpetologica. 2006;62:191–202.
- von May R, Medina-Müller M, Donnelly MA, Summers K. Breeding-site selection by the poison frog Ranitomeya biolat in Amazonian bamboo forests: an experimental approach. Canadian Journal of Zoology. 2009;87:453–463.