ABSTRACT
Riparian forests provide high amounts of leaf litter to tropical headwater streams (1–3 order) and its decomposition is controlled by interactions between leaf quality and macroinvertebrate activity. However, few studies have been conducted in North Andean streams. We conducted a leaf litter decomposition experiment using three native tree species (Heliocarpus americanus, Nectandra sp., and Cecropia telealba) in two headwater streams in the Colombian Coffee-growing Eco-Region. The interactive roles of intrinsic factors (quality) and extrinsic factors (presence/absence of macroinvertebrates) on decomposition rates were tested. Three single-species treatments, a species-mixture treatment, and an artificial substrate treatment were incubated in either coarse-pore mesh or fine-pore mesh bags to allow or exclude macroinvertebrate colonization, respectively. Bags were removed from the streams 7, 14, 28 and 56 days after starting the study. Toughness and chemical quality of senescent leaves of each species were determined in order to test their effect on the decomposition rates. The k-values for the three single-species and the species-mixture treatments indicated that decomposition occurred at medium to fast rates (0.009–0.01 day−1). H. americanus showed the greatest mass loss at the end of the trial, followed by C. telealba and Nectandra sp. Leaf toughness was positively correlated with carbon-to-nitrogen ratio (C: N) and carbon-to-phosphorus ratio (C: P) and, in turn, the three characteristics were negatively correlated with breakdown rate. A total of 3876 individuals from 13 orders, 35 families, and 47 genera colonized leaf-litter bags. Chironomidae, Lumbriculidae, and Hydropsychidae were the families with the highest abundance. The abundance and richness of macroinvertebrates in the leaf-litter bags showed no correlation with the descriptors of intrinsic characteristics (leaf quality). These results indicate that among the three tree-species in the study, the intrinsic characteristics of senescent leaves determine their mass loss rates, while the macroinvertebrate abundance or richness play a secondary role, probably due to the fact that shredders were not abundant.
Resumen
Los bosques ribereños aportan grandes cantidades de hojarasca a las corrientes tropicales de bajo orden (1-3) y su descomposición está controlada por las interacciones entre la calidad de la hoja y la actividad de macroinvertebrados. Sin embargo, se han realizado pocos estudios en quebradas del norte de los Andes. Llevamos a cabo un experimento de descomposición de la hojarasca en el que se utilizaron tres especies de árboles nativos (Heliocarpus americanus, Nectandra sp. y Cecropia telealba) en dos arroyos de cabecera en la Eco-Región Cafetera de Colombia. Se probaron las funciones interactivas de los factores intrínsecos (calidad) y los factores extrínsecos (presencia/ausencia de macroinvertebrados) en las tasas de descomposición. Tres tratamientos de una sola especie, un tratamiento de mezcla de especies y un tratamiento de sustrato artificial se incubaron en bolsas de malla de poro grueso y malla de poro fino. Se retiraron las bolsas de las corrientes 7, 14, 28 y 56 días después de comenzar el estudio. La dureza y la calidad química de las hojas senescentes de cada especie se determinaron para probar su efecto sobre las tasas de descomposición. Los valores de k para las tres especies individuales y la mezcla de especies indicaron que la descomposición se produjo a tasas medias a rápidas (0.009-0.01 día−1). H. americanus mostró la mayor pérdida de masa, seguido de C. telealba y Nectandra sp. La dureza se correlacionó positivamente con la relación carbono-nitrógeno (C: N) y la relación carbono-fósforo (C: P) y, a su vez, las tres características se correlacionaron negativamente con la velocidad de descomposición. Un total de 3876 macroinvertebrados de 13 órdenes, 35 familias y 47 géneros colonizaron los paquetes de hojas. Chironomidae, Lumbriculidae e Hydropsychidae fueron las familias con mayor abundancia. La abundancia y riqueza de macroinvertebrados en las bolsas de hojarasca no mostró correlación significativa con los descriptores de las características intrínsecas (calidad de la hoja). Los resultados indican que las características intrínsecas de las hojas determinan sus tasas de pérdida de masa, mientras que la abundancia o riqueza de macroinvertebrados juegan un papel secundario, probablemente por su baja abundancia.
Introducción
La descomposición de la hojarasca es la base trófica en las quebradas o riachuelos de cabecera (orden 1–3 [Citation1]) donde la sombra limita la productividad primaria, debido a los doseles cerrados [Citation2,Citation3]. En la trasformación de la hojarasca foliar participan en gran medida descomponedores acuáticos como bacterias, hongos y macroinvertebrados fragmentadores [Citation4]. Sin embargo, el proceso de descomposición depende en gran medida de factores intrínsecos como las características físicas y químicas de las hojas senescentes, y factores extrínsecos como la composición de especies de los macroinvertebrados acuáticos, que a su vez pueden responder al disturbio por actividades humanas, tales como la deforestación o cambios de uso de suelo en las zonas ribereñas, lo cual afecta la calidad del agua de los ambientes acuáticos [Citation4–10].
Después de que las hojas senescentes ingresan a las corrientes de agua, pasan por tres etapas o procesos sucesivos principales: lixiviación, acondicionamiento y fragmentación [Citation11]. Durante la lixiviación ocurre una disminución de la masa inicial por la pérdida de compuestos solubles. Durante el acondicionamiento los microorganismos, principalmente bacterias y hongos, inician el proceso de descomposición en la superficie de las láminas haciéndolas palatables para otros organismos [Citation12]. Durante la fragmentación, los macroinvertebrados acuáticos fragmentadores rasgan o ingieren partes más grandes de los tejidos, produciendo trozos más finos que son consumidos por otros grupos de organismos aguas abajo, principalmente los recolectores [Citation13–20]. De esta manera la energía es trasferida en el ecosistema desde el dosel de la vegetación ribereña hacia aguas abajo en las quebradas [Citation21].
La vegetación ribereña representa una conexión importante entre las zonas terrestre y acuática [Citation4], tiene una alta influencia en la disponibilidad o cantidad del material alóctono que ingresa a las quebradas, del cual depende la cadena trófica y los macroinvertebrados que participan en su fragmentación [Citation22, Citation32]. Por otra parte, las zonas ribereñas tanto naturales como las alteradas por actividades humanas, tienen una estructura florística que se traduce en características particulares de cada especie como la físico-química foliar, que influye en diferentes tasas de descomposición [Citation23]. Adicionalmente, la concentración de nutrientes y sedimentos suspendidos, la temperatura media del agua, y otras características físico-químicas influyen sobre las tasas de descomposición de las hojas senescentes que se acumulan en los lechos [Citation8,Citation24–26]
Aunque algunos estudios han planteado que las tasas de descomposición a corto plazo (ca. 30–60 días) en la zona tropical no difieren de las zonas templadas [Citation27,Citation28], la velocidad con que se degrada la hojarasca foliar depende de sus características intrínsecas como la concentración de nutrientes y dureza, particulares de la especie de árbol [Citation21]. Las hojas senescentes con tejidos fácilmente degradables logran descomponerse más rápido, pues confieren un mayor valor alimenticio para los macroinvertebrados y microorganismos [Citation4,Citation11,Citation18,Citation29, Citation4]. Sin embargo, esto puede variar ampliamente en la zona tropical aun a escalas locales o regionales, donde la concentración de lignina, taninos, ceras y otras moléculas, que proporcionan dureza a las hojas o les sirven de defensas químicas ante la herbivoría terrestre, los cual es característico principalmente de esta región [Citation30], reduce la palatabilidad por parte de los macroinvertebrados fragmentadores en el agua y, por ende, las tasas descomposición [Citation21,Citation31,Citation32].
La mayoría de estudios sobre descomposición de hojarasca foliar se han realizado en zonas templadas y existen muchos vacíos geográficos que impiden la comprensión del proceso en la zona tropical tal como ha sido revisado por Wantzen et al. [Citation4], Ramírez et al. [Citation33] y Boyero et al [Citation34]. En Colombia, aunque ha crecido el interés por realizar estudios sobre descomposición de las hojas senescentes, la mayoría están restringidos a pocas especies y no se han explorado los efectos entre ellas más allá de la identidad taxonómica y su origen (nativa vs. exótica) [Citation35–41]. Solamente en un estudio se ha explorado la relación entre la calidad físico-química de la hoja y su pérdida de masa [Citation23]. Adicionalmente, hay vacíos de información en varias regiones y ecosistemas (zonas de vida o biomas). Ejemplo de ello son las cuencas de cabecera en paisajes ganaderos del Eje Cafetero de Colombia, donde la actividad afecta la extensión o la presencia de bosques ribereños, principalmente por la deforestación, lo cual implica un cambio en la composición de especies y la estructura de la vegetación aledaña a las fuentes, y con esto potencialmente se afecta a las comunidades acuáticas que participan en el proceso de descomposición de la hojarasca [Citation42–44].
Este trabajo tuvo como objetivo evaluar las tasas de descomposición de hojas senescentes de tres especies nativas de árboles frecuentes en la zona ribereña de quebradas andinas de cabecera del Eje Cafetero de Colombia y cómo responde el proceso a las características intrínsecas (calidad de la hoja) y extrínsecas (macroinvertebrados).
Materiales y métodos
Sitos de estudio
Para el estudio, se seleccionaron dos quebradas de cabecera inmersas en un paisaje dominado por ganadería intensiva para la producción de leche, ubicado en el municipio de Salento, Quindío, Colombia, a una altura de 2400 msnm, en las coordenadas 4°38ʹ 27.7”N y 75°32ʹ 49.6”W. La composición de especies en la zona ribereña ha sido simplificada en alguna medida por la intervención antrópica ejercida por la proximidad de la actividad ganadera y pastoreo desarrollada en el área de captación de las quebradas, evidenciándose la presencia de especies pioneras como Heliocarpus americanus (Malvaceae, nombre común en la región: Balso), Cecropia telealba (Urticacea, n.c: Yarumo blanco), Nectranda sp. (Lauraceae, n.c: Laurel), Baccharis sp (Asteraceae), entre otras. La zona ribereña de las quebradas en estudio estuvo conformada, además, por especies pertenecientes a las familias Fabaceae, Piperaceae, Araliaceae, Asteraceae y Moraceae, y por pasto Kikuyo (Cenchrus clandestinus).
Diseño experimental
Se recolectaron hojas en estado senescente de tres de las especies de árboles más frecuentes en las franjas ribereñas de la zona de estudio (C. telealba, H. americanus, Nectandra sp.), de acuerdo a una caracterización realizada en cinco fragmentos de bosque ribereños en la región por Giraldo [Citation45]. La hojarasca fue secada a temperatura ambiente por un periodo de ocho días antes de ser llevada a las quebradas [Citation46].
Se prepararon paquetes con la hojarasca de las tres especies seleccionadas (factor intrínseco), usando bolsas de malla de poro grueso (1,5 cm de poro) para permitir la entrada de macroinvertebrados y malla de poro fino (200 μm de poro) para excluir los mismos (bolsas de polipropileno de 15 × 15 cm) (factor extrínseco). Además, se preparó una mezcla de las especies con el fin de determinar si la heterogeneidad del material lo hacía más atractivo para los macroinvertebrados y por ende había mayor pérdida de masa (efecto interactivo según Lecerf [Citation28]).
Cada paquete fue preparado con 5 g de hojarasca por especie y, en el caso de la mezcla, en iguales proporciones hasta completar la cantidad usada. Adicionalmente, se acondicionaron paquetes con sustrato artificial, que consistió en láminas de plástico de similares dimensiones y textura a la hojarasca usada en el experimento, con el fin de determinar el uso de las mismas por parte de los macroinvertebrados. Los paquetes de sustrato artificial sólo fueron incubados en bolsas de malla de poro grueso [Citation47].
Los paquetes de hojarasca fueron instalados en pozas o zonas de corriente lenta atadas a una cuerda de alambre, la cual fue sujetada a varillas y piedras del lecho de las quebradas. En cada cuerda se ubicaron bolsas que fueron retiradas después de cuatro periodos de exposición (7, 21, 28 y 56 días) similar a lo indicado por Wantzen y Wagner [Citation37]. En total fueron incubados 96 paquetes de hojarasca en cada quebrada, asignados de la siguiente manera: dos tamaños de poro de malla, tres repeticiones por periodo, cuatro tipos de paquetes (Sp1, Sp2, Sp3, mezcla), además de 12 muestras con láminas de plásticos (). El experimento se realizó una vez, abarcando la transición ente época lluviosa a época seca (descenso de las aguas) marzo-abril.
Figura 1. Esquema de experimento de descomposición de hojas de árboles nativos en bosques ribereño en una zona ganadera del Eje Cafetero de Colombia
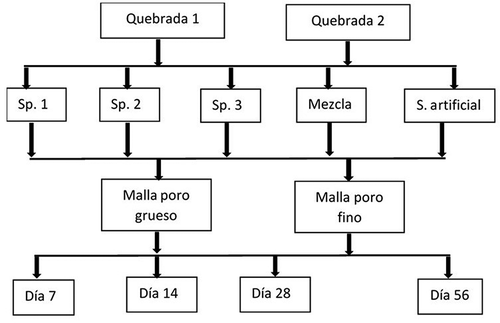
En cada periodo (7, 14, 28 y 56 días), tres paquetes por tipo de hojarasca de cada quebrada fueron retirados aleatoriamente de las cuerdas, almacenados en bolsas plásticas y conservadas en neveras con hielo. En el laboratorio, el mismo día de retiradas las bolsas de las quebradas, fue lavada la hojarasca usando un tamiz para impedir la pérdida de macroinvertebrados, los cuales fueron preservados en viales con alcohol al 80%, para su posterior identificación. La hojarasca fue secada inicialmente a temperatura ambiente y posteriormente en un horno a 60°C por un periodo de 48 horas y pesada en una balanza analítica (Ohaus® AR214, 0.0001 g).
Debido a que la temperatura del agua es una de las variables que influye de manera relevante en los procesos de descomposición de la hojarasca, en cada quebrada se instaló un termómetro de medición automática modelo Onset marca HOBO, para su registro en intervalos de una hora, por el periodo máximo del experimento (56 días). Además, se evaluaron algunas características de las quebradas como caudal, parámetros fisicoquímicos del agua y variables geomorfológicas.
Factores extrínsecos: Macroinvertebrados colonizadores
Los macroinvertebrados que colonizaron los paquetes de hojarasca y el substrato artificial, fueron identificados hasta el menor nivel taxonómico posible usando un estéreo microscopio y claves taxonómicas especializadas para cada grupo [Citation48–53]. Los insectos fueron asignados a grupos funcionales (depredadores, raspadores, fragmentadores, colectores,) de acuerdo a la clasificación propuesta por Tomanova et al. [Citation54], Chará-Serna et al. [Citation55] y Ramírez y Gutiérrez-Fonseca [Citation56].
Factores intrínsecos: Dureza y calidad química de las hojas
Se estimó la dureza de las hojas, lo cual se define como la fuerza necesaria para penetrar una muestra de hoja usando un penetrómetro [Citation57]. Para esto, se cortaron discos de hojas usando una plantilla circular de metal y se fijaron al penetrómetro. Antes de realizar la prueba, se verificó que el sitio de perforación, no tocara ninguna de las venas principales de la lámina foliar. Se ubicó un vaso de plástico sobre la pieza de perforación y se llenó con agua hasta que se alcanzó un valor crítico con el cual la pieza de perforación rompió el disco de la hoja [Citation57].
Por otra parte, con el fin de determinar la concentración de fósforo (P), nitrógeno (N) y carbono (C) de la hojarasca, se realizó un análisis químico a las tres especies seleccionadas para el estudio en el laboratorio de Aguas y Suelos, facultad de Ciencias Agrarias de la Universidad Nacional de Colombia, sede Bogotá. El contenido total de N en las hojas se determinó mediante el método Kjeldahl, el P total se determinó por digestión de tejido vegetal fresco en un microondas, el C total se cuantificó utilizando el método de Walkley Black.
Análisis de datos
Las tasas de descomposición de las hojas se calcularon utilizando el modelo exponencial negativo propuesto por Petersen y Cummins [Citation11], mediante la siguiente ecuación:
Mt = Mi e -kt
Donde Mt es la masa remanente en el tiempo t, Mi es la masa inicial, – k es el coeficiente exponencial de descomposición y t el lapso de tiempo durante el cual se observa el proceso.
La pérdida de masa de cada especie y de la mezcla de ellas se comparó en función del tipo de malla y de las dos quebradas mediante un Análisis de Covarianza (ANCOVA), después de comprobar supuestos estadísticos. Posteriormente se realizó un análisis de varianza (ANOVA) de dos vías, para establecer diferencias de la masa remanente entre tratamientos del factor intrínseco en función del tipo de malla y el tiempo. Un modelo lineal fue usado para explicar las tasas de descomposición (k) en función de los factores intrínseco y extrínseco.
La abundancia de macroinvertebrados y de los grupos funcionales se compararon mediante un ANOVA de dos vías considerando la interacción entre el factor intrínseco y el tiempo. Dentro de los análisis realizados con los macroinvertebrados que colonizaron los paquetes de hojarasca, no se incluyó el día 28, debido a que hubo pérdida del material biológico en un evento de transporte del material al laboratorio.
La dureza, C:N y C:P se correlacionaron con el porcentaje de pérdida de masa y con la abundancia y riqueza de macroinvertebrados, mediante un Análisis de Correlación de Pearson. Los análisis fueron realizados con los programas estadísticos R versión 3.5.2 (disponible en: www.r-project.org) e Infostat 2018.
Resultados
Pérdida de masa de las hojas
Las dinámicas de pérdida de masa de las hojas para las tres especies y la mezcla de ellas se muestran en la . Los paquetes de hojas presentaron un porcentaje de descomposición entre el 4% y 17% en los primeros siete días de exposición en los sitios de estudio. Heliocarpus americanus fue la especie con mayor descomposición (peso perdido neto y tasa de pérdida) para el tratamiento de malla de poro grueso (k = 0,01 dia−1; 45,1% de masa remanente), lo cual resultó significativamente diferente con respecto a las demás especies (ANOVA, F3,15 = 19,56, P < 0,005). Nectandra sp. fue la especie que obtuvo la menor tasa de descomposición en todo el experimento para el mismo tratamiento (malla de poro grueso) (k = 0,009 dia−1, 75,5% de masa remanente) ().
Tabla 1. Tasa de descomposición (k) de hojas de tres especies de árboles nativos presentes en bosques ribereños de quebradas en un paisaje ganadero del Eje Cafetero de Colombia. Se incluye como tratamiento adicional una mezcla de las tres especies. Se indican los promedios y rangos. n = número de paquetes de hojarasca por especie
Figura 2. Dinámica de la masa remanente (promedio ± DE) en hojas de tres especies de árboles nativos asociados a bosques ribereños de dos quebradas en un paisaje ganadero del Eje Cafetero de Colombia. Se incluyó un tratamiento que mezcló las especies. a) malla de poro fino y b) malla de poro grueso
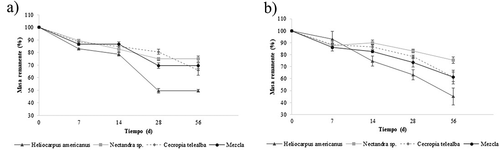
El ANCOVA no mostró diferencias significativas en el porcentaje de pérdida de masa de las especies entre las dos quebradas estudiadas (ANCOVA, F1,15 = 0,80; P > 0,05). El tipo de malla (Poro fino y poro grueso), tampoco tuvo efecto significativo sobre dicha variable (ANCOVA; F1,15 = 2.60, P > 0,05). Por el contrario, se encontraron diferencias significativas en el porcentaje de descomposición de las especies en función del factor intrínseco (ANOVA; F3,15 = 22.16, P < 0,005).
Macroinvertebrados acuáticos
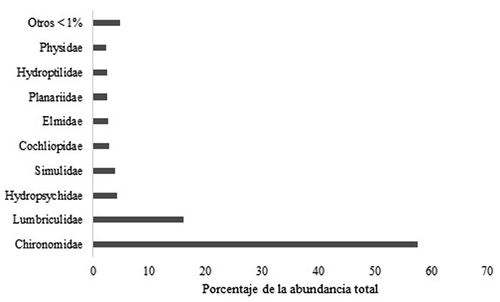
Un total de 3876 organismos, pertenecientes a 13 órdenes, 35 familias y 47 géneros colonizaron los paquetes de hojarasca (). Insecta fue la clase dominante con el 75% de los organismos colectados, seguida de Clitellata con el 16%. Las familias con mayor abundancia relativa durante todo el experimento fueron Chironomidae, Lumbriculidae e Hydropsychidae con el 57,6%, 16% y 4,3% respectivamente, del total de individuos colectados ().
Tabla 2. Macroinvertebrados asociados a paquetes de hojarasca (tres especies individuales y una mezcla) y sustrato artificial evaluados en quebradas de un paisaje ganadero en el Eje Cafetero de Colombia
Figura 3. Abundancia relativa de familias de macroinvertebrados que colonizaron hojas de tres especies de árboles nativos presentes en bosques ribereños de quebradas en un paisaje ganadero del Eje Cafetero de Colombia
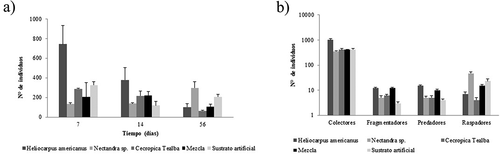
Del total de organismos que colonizaron los paquetes de hojarasca, el mayor porcentaje se registró en H. americanus (34,6%). seguido por la mezcla de las tres especies (16,9%), Nectandra sp. (16,4%) y C. telealba (15,1%), En los primeros días de exposición de los paquetes se presentó una tendencia a tener mayor abundancia de organismos, que fue disminuyendo hasta el día 56 (). Sin embargo, no se observaron diferencias significativas entre los periodos de incubación (ANOVA; F3,18 = 2,53, P > 0,05). En el sustrato artificial colonizaron 587 individuos, que corresponde al 16,7% de la abundancia total, lo cual no resultó significativamente diferente con respecto al material foliar (ANOVA; F4,18 = 0,91, P > 0,05).
La mayor riqueza se obtuvo en H. americanus con 35 taxones, seguido de Nectandra sp. con 34, la mezcla con 31 y C. telealba con 30. En el sustrato artificial colonizaron 26 taxones. Los grupos funcionales encontrados en los paquetes de hojarasca corresponden a colectores, raspadores, predadores y fragmentadores (). El primer grupo obtuvo la mayor abundancia relativa con el 70% del total de la muestra, lo cual resultó significativamente diferente respecto a los demás grupos (ANOVA; F4,12 = 17,69, P < 0,005). Por su parte, los fragmentadores obtuvieron la menor abundancia con el 1% y ésta no varió significativamente entre las tres especies de hojas, la mezcla y el substrato artificial (ANOVA; F4,12 = 0,63, P > 0,05). Además, la riqueza de fragmentadores fue similar en todas las especies con tres taxones, incluido el sustrato artificial donde se encontraron los géneros Anchytarsus, Atopsyche, Tipula, aunque en menor proporción (20%) con respecto a los substratos orgánicos.
Figura 4. Macroinvertebrados que colonizaron hojas de tres especies de árboles nativos presentes en bosques ribereños de quebradas en un paisaje ganadero del Eje Cafetero de Colombia. Se incluyeron como tratamientos una mezcla de las tres especies y un substrato artificial. (Promedio ± DE). a) Colonización en días, b) Grupos funcionales (el eje Y se presenta en escala logarítmica)
Dureza y calidad de las hojas
C. telealba presentó la mayor dureza y mayores relaciones C:N y C:P, seguida de Nectandra sp y H. americanus (). La dureza y las relaciones C:N y C:P se correlacionaron positivamente (). En los paquetes donde se permitió la entrada de macroinvertebrados, se encontraron correlaciones negativas entre la dureza de las hojas (r2 = −0,86, P = 0,06) y relaciones C:N y C:P (r2 = −0,92, P = 0,04; r2 = −0,96, P = 0,01) con el porcentaje de descomposición . La relación C:P también tuvo una correlación negativa y cercana a la significancia con el porcentaje de descomposición en paquetes donde se excluyeron los macroinvertebrados (r2 = −0,84, P = 0,07) ().
Tabla 3. Características químicas y físicas de la hojarasca de tres especies usadas en un experimento de descomposición en quebradas del Eje Cafetero, Colombia. (Valores promedio ± desviación estándar)
Tabla 4. Coeficiente de correlación de Pearson de las variables de calidad de hoja, descomposición de hojarasca y macroinvertebrados acuáticos (p-valor en la diagonal superior)
Discusión
Este estudio sugiere que las tasas de descomposición acuática de la hojarasca de especies de árboles pioneros en la zona ribereña de quebradas de un paisaje ganadero del Eje Cafetero en Colombia, puede estar influenciada en mayor medida por factores intrínsecos como la dureza y calidad (i.e. C:N, C:P), más que por factores extrínsecos como diferencias en la abundancia y riqueza de los macroinvertebrados, particularmente de fragmentadores que fueron escasos en los paquetes. Lo anterior señala la importancia de evaluar los efectos específicos de las especies arbóreas ribereñas en los procesos de degradación del material alóctono aportado al ambiente acuático.
Según el modelo de descomposición exponencial descrito por Bärlocher [Citation46], las tres especies de hojarasca evaluadas se degradaron de manera intermedia a rápida (k = 0,01) [Citation11]. Otros estudios han encontrado resultados variables, por ejemplo, para el caso particular del género Cecropia, donde han sido clasificadas como de degradación intermedia [Citation41] y de degradación lenta [Citation38,Citation40]. Sin embargo, las especies pueden tener diferentes dinámicas de descomposición debido a las particularidades de las hojas, las concentraciones de diferentes compuestos químicos [Citation58–60] y en una escala más amplia, por las condiciones climáticas, altitud, geología de las zonas de estudio; características propias de ambientes acuáticos e influencia del uso del suelo que pueden incidir en cambios de la composición de la fauna acuática, variaciones en la temperatura del agua, aumento de nutrientes, efecto abrasivo, entre otras [Citation61–64].
Por otro lado, la descomposición de la mezcla fue similar al promedio de las tasas de cada una de las especies por separado, lo que indica que su degradación es independiente de la heterogeneidad en la mezcla empleada o que no hubo efectos interactivos (aditivos o substractivos). Sin embargo, es necesario ampliar el número de especies en la mezcla, las posibles combinaciones entre ellas y diferentes proporciones para poder establecer la ocurrencia o no de efectos interactivos, tal como fue estudiado por Kominosky y colaboradores [Citation65], quienes encontraron incremento en las proporciones de C:N en la mezcla de algunas de las especies utilizadas; pocos efecto de la mezcla en la pérdida de masa de especies individuales y cambios en la diversidad microbiana con la heterogeneidad de los recursos. En el presente trabajo, Heliocarpus americanus presentó el mayor porcentaje de descomposición, la menor dureza de hojas y relaciones bajas de C:P y de C:N, lo que posiblemente facilitó la actividad microbiana [Citation27,Citation36,Citation66].
Las rápidas tasas de descomposición en el Neotrópico han sido atribuidas a las altas y estables temperaturas registradas en el agua a lo largo de todo el año (i.e. Costa Rica [Citation67], Colombia [Citation36], Costa Rica [Citation68], México [Citation69]). En este estudio, a pesar de ser una zona andina de elevación intermedia, se presentaron temperaturas del agua relativamente altas. La información generada por los termómetros instalados para el registro diario de la temperatura en el agua, mostraron un promedio de 17°C, lo que pudo influir de manera importante en el proceso de descomposición de la hojarasca por la actividad microbiana. Los sitios de estudio, presentaron además un caudal promedio de 16 l/seg, predominancia de canto rodado en el sustrato (34%), profundidad promedio de 20 cm, pH de 8,03, concentración de nitrógeno total de 2,4 mg/l y de sólidos suspendidos de 2,3 mg/l.Estos factores propios de las corrientes de agua como el régimen de caudal, la geomorfología y las características fisicoquímicas del agua, no se pueden descartar en la influencia de la descomposición de la hojarasca [Citation61,Citation62,Citation70–72].
Con respecto a las características intrínsecas de las hojas, éstas permitieron establecer una correlación negativa, entre las tasas de descomposición con la dureza y las proporciones C:N y C:P. La dureza medida en gramos osciló entre 361,8 para H. americanus y 407,4 para C. telealba, lo cual las ubica en valores intermedios con respecto a otros trabajos que han encontrado durezas en el rango de 15 a 915,7 g [Citation73,Citation74]. Los resultados del presente estudio fueron consistentes con lo encontrado en otras investigaciones, tanto en la zona tropical como en zonas templadas, particularmente lo referente a la influencia negativa de la dureza sobre las tasas de descomposición (e.g [Citation23,Citation68,Citation73,Citation74].). La dureza, y las proporciones C:N y C:P también influyeron negativamente sobre la abundancia y riqueza de los macroinvertebrados con una correlación alta, pero no significativa, posiblemente por la variabilidad de los datos. Esto indica de alguna manera, lo poco atractivo que puede resultar el recurso para alimentación de los macroinvertebrados, por lo que es posible que la asociación entre las características intrínsecas y las tasas de descomposición no se deban a un mecanismo trófico si no a uno relacionado con la actividad microbiana. Por ejemplo, se ha encontrado que la calidad de las hojas puede influir en la biomasa de hongos [Citation59,Citation75].
En general, se obtuvo un bajo porcentaje de insectos fragmentadores (tanto en abundancia como riqueza), lo que pudo obedecer a que la mala calidad de la hojarasca en términos de la proporción C:N (> 20); esto hace que no sea atractiva para los organismos acuáticos como recurso alimenticio [Citation18,Citation76], pues implica una baja palatabilidad o una alta resistencia al daño mecánico. Las altas concentraciones de lignina, taninos y la alta dureza de las hojas debido a la alta concentración de celulosa, como defensa contra la herbivoría terrestre, puede reducir la palatabilidad para los consumidores [Citation21,Citation30,Citation31]. El grupo de los fragmentadores, representado por Tipula (Tipulidae), Philloicus (Calamoceratidae), Anchytarsus (Ptilodactylidae) y Atopsyche (Hydrobiosidae), sólo representó el 1% del total de la muestra mientras los colectores fueron dominantes (70% de abundancia relativa). Esto resultados coinciden con otros estudios realizados en el Neotrópico que han reportado un bajo número de fragmentadores en experimentos de descomposición de hojarasca y mayor representación de colectores [Citation23,Citation35,Citation36,Citation41,Citation69].
Se ha discutido que la baja abundancia y riqueza de insectos acuáticos fragmentadores en la zona tropical podría deberse a factores locales que influyen en la presencia de estos organismos (contaminación, deforestación, etc) [Citation6,Citation8,Citation10] o a factores biogeográficos históricos [Citation77,Citation78]. Algunos estudios han encontrado menor abundancia y riqueza de este grupo trófico [Citation34,Citation79,Citation80], mientras en otras investigaciones han sido importantes en términos de biomasa [Citation81,Citation82]. En muestreos generales en las quebradas de este estudio, el 17% de los macroinvertebrados identificados fueron fragmentadores [Citation45]. Sin embargo, otros trabajos como los realizados por Chará-Serna et al. [Citation55] encontraron en paquetes de hojarasca 22 taxones fragmentadores de 53 géneros identificados y Longo & Blanco [Citation83] reportaron en su estudio 35 taxones fragmentadores.
Lo que sí parece más general es la baja calidad de las hojas de las especies tropicales. En un estudio reciente realizado por Boyero y colaboradores, en varias regiones tropicales del mundo [Citation32], encontraron que la calidad de la hojarasca disminuye cuando las especies de árboles se acercan al Ecuador, debido a que los suelos son generalmente más empobrecidos en fósforo [Citation84]. La baja calidad de las hojas, restringe la descomposición por insectos fragmentadores y aumenta la influencia de los descomponedores microbianos.
La mayor abundancia de insectos colectores, puede estar dada porque en general los macroinvertebrados aprovechan la hojarasca como refugio o como sitio de alimentación, pues en la superficie de las láminas se acumulan algas y materia orgánica particulada fina [Citation47]. Nuestra hipótesis sobre el uso del recurso acumulado en la superficie del material, se explica, además, por la colonización que también se registró en el sustrato artificial. Los insectos de las familias Chironomidae y Simuliidae, han sido más abundantes que otros grupos en láminas artificiales [Citation41].
Los paquetes de hojarasca estuvieron colonizados en mayor porcentaje por Orthocladiinae, Chironominae (Chironomidae), Lumbriculus (Oligochaeta) y Simuliium (Simulidae). Chironomidae es la familia con mayor abundancia en paquetes de hojarasca evaluados en diferentes ambientes acuáticos en zonas templadas y en el Neotrópico [Citation29,Citation36,Citation85–88]. Por otro lado, los oligoquetos, se encuentran asociados principalmente a sedimento fino y pueden alcanzar altas densidades en parches de arena [Citation89]. Martins y colaboradores [Citation90], encontraron en paquetes de hojarasca evaluados en un ambiente léntico en Brasil, una colonización de oligoquetos del 40,5% respecto del total de la muestra. Por otro lado, Los simúlidos, normalmente exigen sustratos sólidos para su fijación, y en este caso usan las hojas como soporte desde donde obtienen alimento suspendido en el medio [Citation91].
Los resultados de este estudio proveen información valiosa sobre los mecanismos particulares que influyen en el proceso de descomposición foliar, de árboles asociados a bosques ribereños en paisajes ganaderos. Al demostrar una mayor importancia de las propiedades físico-químicas de las hojas asociadas con su identidad taxonómica y el papel secundario de los macroinvertebrados acuáticos sobre la descomposición, sugiere que la restauración de los relictos de bosque aledaños a los ambientes acuáticos en paisajes agropecuarios, deberían considerar la calidad de la hojarasca que se produce y que eventualmente será procesada dentro de los cauces. Esto podría tener repercusiones en servicios ecosistémicos derivados de los ambientes acuáticos como el mantenimiento de la abundancia y riqueza de macroinvertebrados, los cuales juegan papeles muy importantes en los procesos ecológicos de dichos ecosistemas (función de sostenimiento) y el transporte y retención de la materia orgánica y el carbono (función de regulación).
Por lo tanto, se sugiere considerar los efectos de proyectos de restauración de la vegetación ribereña, futuros y ya establecidos, sobre los ecosistemas acuáticos, donde se evalúe el ciclo de la materia orgánica como un indicador de la función ecosistémica y servicios ambientales.
Agradecimientos
Este trabajo se realizó en el marco del proyecto de tesis de doctorado de la primera autora titulado “Efecto de la vegetación ribereña sobre la dinámica de la materia orgánica particulada gruesa e insectos fragmentadores en quebradas de paisajes ganaderos (Eje cafetero de Colombia), realizado en la Universidad de Antioquia, Colombia. Se contó con el apoyo de Minciencias y el Patrimonio Autónomo Francisco José de Caldas a LP Giraldo mediante la convocatoria 567 y a CIPAV a través del contrato 80,740–006-2020, así como del proyecto Ganadería Colombiana Sostenible. Agradecemos a Hugo Rafael Fernández de la Universidad de Tucumán, Argentina y Néstor Aguirre de la Universidad de Antioquia, Colombia, por sus valiosos aportes en el desarrollo de la investigación. A los productores por permitir el acceso a las fincas para la realización de los experimentos.
Disclosure statement
No potential conflict of interest was reported by the author(s).
Additional information
Funding
Referencias
- Horton RE. Erosional development of streams and their drainage basins; hydrophysical approach to quantitative morphology. Geol Soc Am Bull. 1945;56(3):275–370.
- Vannote RL, Minshall GW, Cummins KW, et al. The river continuum concept. Can J Fisheries Aquat Sci. 1980;37(1):130–137.
- Webster JR, Meyer JL, editors. Stream organic matter budgets. Journal of the North American Benthological Society.1997.Vol. 16 3–161.
- Wantzen KM, Yule CM, Mathooko JM, PringleCM. Organic Matter Processing in Tropical Streams. In D. Dudgeon (ed.). Tropical Stream Ecology. Elesvier, London. 2008. p. 43 – 64
- Webster JR, Benfield EF, Ehrman TP, et al. What happens to allochthonous material that falls into streams? A synthesis of new and published information from Coweeta. Freshwater Biol. 1999;41(4):687–705.
- Young RG, Matthaei CD, Townsend CR. Organic matter breakdown and ecosystem metabolism: functional indicators for assessing river ecosystem health. J North Am Benthological Soc. 2008;27(3):605–625.
- Tank JL, Rosi-Marshall EJ, Griffiths NA, et al. A review of allochthonous organic matter dynamics and metabolism in streams. J North Am Benthological Soc. 2010;29(1):118–146.
- Torres PJ, Ramírez A. Land use effects on leaf litter breakdown in low-order streams draining a rapidly developing tropical watershed in Puerto Rico. Revista De Biología Tropical. 2014;62:129–142.
- Rincón J, Covich A. Effects of insect and decapod exclusion and leaf litter species identity on breakdown rates in a tropical headwater stream. Revista De Biología Tropical. 2014;62:143–154.
- Silva-Junior EF, Moulton TP, Boëchat IG, et al. Leaf decomposition and ecosystem metabolism as functional indicators of land use impacts on tropical streams. Ecol Indic. 2014;36:195–204.
- Petersen RC, Cummins KW. Leaf Processing in a Woodland Stream. Freshwater Biol. 1974;4(4):343–368.
- Giller PS, Malmqvist B. The biology of Streams and Rivers. New York: USA. Oxford University Press Inc; 1998. p. 296.
- Anderson NH, Sedell JR. Detritus processing by macroinvertebrates in stream ecosystems. Annu Rev Entomol. 1979;24(1):351–357.
- Cummins KW, Klug MJ. Feeding ecology of stream invertebrates. Annu Rev Ecol Syst. 1979;10(1):147–172.
- Wallace JB, Merrit RW. Filter- Feeding ecology of aquatic insects. Annu Rev Entomol. 1980;25(1):103–132.
- Webster JR, Benfield EF. Vascular plants breakdown in freshwater ecosystems. Annu Rev Ecol Syst. 1986;17(1):567–594.
- Wallace JB, Webster JR. The role of macroinvertebrates in stream ecosystem function. Annu Rev Entomol. 1996;41(1):115–139.
- Graça MAS. The role of invertebrates on leaf litter decomposition in streams – a review. Int Rev Hydrobiol. 2001;86(4–5):383–393.
- Gulis V, Suberkropp K. Leaf litter decomposition and microbial activity in nutrient-enriched and unaltered reaches of a headwater stream. Freshwater Biol. 2003;48(1):123–134.
- Cheshire KL, Boyero L, Pearson RG. Food webs in tropical Australian Streams: shredders are not scare. Vol. 50. Freshwater Biology; 2005. p. 748–769.
- Gessner MO, Chauvet E, Dobson MA. Perspective on Leaf Litter Breakdown in Streams. Oikos. 1999;852(2):377–384.
- Lecerf A, Richardson JS. Litter decomposition can detect effects of high and moderate levels of forest disturbance on stream condition. For Ecol Manage. 2010;259(12):2433–2443.
- Blanco JF, Gutiérrez-Isaza N. Leaf litter mass loss rates and associated fauna of tree species commonly used in neotropical riparian reforestation. Acta Biológica Colombiana. 2014;19:91–100.
- Ardón M, Stallcup LA, Pringle C. Does leaf quality mediate the stimulation of leaf breakdown by phosphorus in Neotropical streams? Freshwater Biol. 2006;51(4):618–633.
- Medeiros AO, Callisto M, Graça M, et al. RS, Gonçalves Jr. JF. Microbial colonisation and litter decomposition in a Cerrado stream are limited by low dissolved nutrient concentrations. Limnetica 2015;2:283–292.
- Ferreira V, Chauvet E. Synergistic effects of wáter temperature and dissolved nutrients on litter decomposition and associated fungi. Glob Chang Biol. 2011;17(1):551–564.
- Ardón M, Pringle CM. Do Secondary Compounds Inhibit Microbial- and Insect-Mediated Leaf Breakdown in a Tropical Rainforest Stream, Costa Rica? Oecologia. 2008;155(2):311–323.
- Lecerf A, Risnoveanu G, Popescu G, et al. Decomposition of diverse litter mixtures in streams. Ecology. 2007;88(1):219–227.
- Abelho M. Effects of Leaf Litter Species on Macroinvertebrate Colonization during Decomposition in a Portuguese Stream. Internat. Int Rev Hydrobiol. 2008;93(3):358–371.
- Marquis RJ, Ricklefs RE, Abdala-Roberts L. Testing the low latitude/high defense hypothesis for broad-leaved tree species. Oecologia. 2012;169(3):811–820.
- Hättenschwiler S, Coq S, Barantal S, et al. Leaf traits and decomposition in tropical forests: revisiting some commonly held views and towards a new hypothesis. New Phytol. 2011;189(4):950–965.
- Boyero L, Graça MAS, Tonin AM, et al. Riparian plant litter quality increases with latitude. Sci Rep. Sci Rep. 2017;7 (1):10562.
- Ramírez A, Ardón M, Douglas MM, et al. Tropical freshwater sciences: an overview of ongoing tropical research. Freshwater Sci. 2015;34(2):606–608.
- Boyero L, Pearson RG, Gessner MO, et al. Leaf-litter breakdown in tropical streams: is variability the norm? Freshwater Sci. 2015;34(2):759–769.
- Chará J, Baird D, Telfer T, et al. Study of Leaf Breakdown of Three Native Tree Species in a Slowly-Flowing Headwater Stream in the Colombian Andes. Int Rev Hydrobiol. 2007a;92(2):183–198.
- Mathuriau C, Chauvet E. Breakdown of litter in a neotropical stream. J North Am Benthol. 2002;21(3):384–396.
- Wantzen KM, Wagner R. Detritus processing by invertebrate shredders: a neotropical-temperate comparison. J North Am Benthological Soc. 2006;25(1):216–232.
- Rueda-Delgado G, Wantzen KM, Leaf-Litter BM. Decomposition in an Amazonian Floodplain Stream: effects of Seasonal Hydrological Changes. J North Am Benthological Soc. 2006;25(1):233–249.
- Gonzáles-Ortega M. Comparación de la tasa de descomposición de hojas de Pteridium aquilinum y Miconia latifolia en dos quebradas con diferentes condiciones de nutrientes (Reserva Forestal Caminos de Santa Ana, Bogotá). Tesis Pregrado. Pontificia Universidad Javeriana, Facultad de Estudios Ambientales y Rurales. Bogotá. 2009.
- Eyes-Escalante M, Rodríguez-Barrios J, Gutiérrez-Moreno LC. Descomposición de la hojarasca y su relación con los macroinvertebrados acuáticos del río Gaira (santa marta – colombia). Acta Biológica Colombiana. 2012;17:77–92.
- Zúñiga-Céspedes B, Zúñiga MC, Chará J. The effect of macroinvertebrate exclusion on leaf breakdown rates in two upland Colombian streams. Revista De Biología Tropical. 2018;66(1):457–467.
- Chará J, Pedraza G, Giraldo LP, et al. Efecto de corredores ribereños sobre el estado de quebradas en la zona ganadera del río La Vieja, Colombia. Revista Agroforestería De Las Américas. 2007b;45:72–78.
- Giraldo LP, Chará JD, Zúñiga MC, et al. Impacto del uso del suelo agropecuario sobre macroinvertebrados acuáticos en pequeñas quebradas de la cuenca del río La Vieja (Valle del Cauca, Colombia). Revista Biología Tropical. 2014;63:203–219.
- Chará-Serna AM, Chará J, Giraldo LP, et al. Understanding the impacts of agriculture on Andean stream ecosystems of Colombia: a causal analysis using aquatic macroinvertebrates as indicators of biological integrity. Freshwater Sci. 2015;34(2):727–740.
- Giraldo LP. Efecto de la vegetación ribereña sobre la dinámica de la materia orgánica particulada gruesa e insectos fragmentadores en quebradas de paisajes ganaderos (Eje Cafetero de Colombia). PhD Diss, 2019. Universidad de Antioquia, Medellín, Colombia.
- Bärlocher F. Leaf Mass Loss Estimated by Litter Bag Technique. In: Graça MAS, Bärlocher F, Gessner MO, editors. Methods to Study Litter Decomposition Practical Guide. Dordrecht, The Netherlands: Springer; 2005. p. 37–42.
- Dudgeon D, Wu KY. Leaf litter in a tropical stream: food or substrate for macroinvertebrates? Fundamental and Applied Limnology. 1999;146(1):65–82.
- Machado-Cartagena TA, Rincón J. Distribución ecológica e identificación de los coleópteros acuáticos en diferentes pisos altitudinales del departamento de Antioquia. In: Universidad de Antioquia, Facultad de Ciencias Exactas y Naturales. Medellín: Departamento de Biología; 1989. p. 324.
- Muñoz De Hoyos P, Miranda D. Simulidos (Diptera: simuliidae) presentes entre las vertientes magdalenense y orinocense, en un sector al centro de Colombia. Vol. 19. Caldasia 1995.297–310
- Posada-García JA, Roldán-Pérez G. Clave ilustrada y diversidad de larvas de Trichoptera en el Nor-Occidente de Colombia. Caldasia. 2003;25:169–192.
- Domínguez E, Fernández H. Macroinvertebrados bentónicos sudamericanos, Sistemática y biología. In: San Miguel Tucumán: fundación Miguel Lillo. 2009. p. 656.
- Springer M. Capítulo 7. Trichoptera. En: Springer M, Ramírez A, Hanson P,Eds. Macroinvertebrados de agua dulce de Costa. Revista de Biología Tropical. 2010. Vol. 58 151–198.
- Gaviria E, Gaviria-Melo S. Guía de laboratorio sobre los Oligochaeta. Tunja: Universidad Pedagógica y Tecnológica de Colombia UPTC; 2013.
- Tomanova S, Goitia E, Helešic J. Trophic levels and functional feeding groups of macroinvertebrates in neotropical streams. Hydrobiologia. 2006;556(1):251–264.
- Chará-Serna AM, Chará J, Zúñiga MDC, et al. Diets of leaf litter-associated invertebrates in three tropical streams. Annales De Limnologie - Int J Limnol. 2012;48(2):139–144.
- Ramírez A, Gutiérrez-Fonseca PE. Functional feeding groups of aquatic insect families in Latin America: a critical analysis and review of existing literature. Revista De Biología Tropical. 2014;62:155–167.
- Graça MAS, Zimmer M. Leaf Toughness. In: Graça MAS, Bärlocher F, Gessner MO. Eds. Methods to Study Litter Decomposition Pratical Guide. Dordrecht, The Netherlands; Springer. 2005. p. 121–125.
- Wantzen KM, Wagner R, Suetfel R, et al. How do plant-herbivore interactions of trees influence coarse detritus processing by shredders in aquatic ecosystems of different latitudes? Verhandlungen Des Internationalen Verein Limnologie. 2002;28:815–821.
- Gonçalves JFJ, Martins RT, Ottoni BMP, et al. Uma visao Sobre a Decomposicao Foliar em Sistemas Aqua´ticos Brasileiros. In: Hamada N, Nessimian JL, Querino RB, editors. Insetos Aqua´ticos: biologia, Ecologia e Taxonomia. Manaus: Editora INPA; 2014. p. 89–116.
- Cornelissen JHC. An Experimental Comparison of Leaf Decomposition Rates in a Wide Range of Temperate Plant Species and Types. J Ecol. 1996;84(4):573–582.
- Yoshimura M. Effects of forest disturbances on aquatic insect assemblages. Entomol Sci. 2012;15(2):145–154.
- Sponseller RA, Benfield EF. Influences of land use on leaf breakdown in southern Appalachian headwater streams: a multiple-scale analysis. J North Am Benthological Soc. 2001;20(1):44–59.
- Pozo J, Casa J, Menéndez M, et al. Leaf-litter decomposition in headwater streams: a comparison of the process among four climatic regions. J North Am Benthological Soc. 2011;30(4):935–950.
- Bruder A, Salis RK, McHugh NJ, et al. Multiple-stressor effects on leaf litter decomposition and fungal decomposers in agricultural streams contrast between litter species. Functional Ecolog. 2016;30(7):1257–1266.
- Kominoski JS, Hoellein TJ, Kelly JJ, et al. Does mixing litter of different qualities alter stream microbial diversity and functioning on individual litter species? Oikos. 2009;118(3):457–463.
- Gonçalves JFJ, Martins RT, Ottoni BMP, Couceiro SRM. Uma visão sobre a decomposição foliar em sistemas aquáticos Brasileiros. In Hamada, N., J. L. Nessimian& R. B. Querino (eds), Insetos Aquáticos: Biologia, Ecologia e Taxonomia. Editora INPA, Manaus: 2014; p. 89–116.
- Benstead JP. Macroinvertebrates and the processing of leaf litter in a tropical stream. Biotropica. 1996;28(3):367–375.
- Ardón M, Pringle CM. Does leaf chemistry differentially affect breakdown in tropical versus temperate streams? Importance of standardized analytical techniques to measure leaf chemistry. J North Am Benthological Soc. 2009;28(2).
- Astudillo M, Ramírez A, Novelo-Gutiérrez R, et al. Descomposición de hojarasca en seis arroyos de Bosque Mesófilo de Montaña en la cuenca alta del río La Antigua, Veracruz, México. Revista Biología Tropical. 2014;62:111–127.
- Wallace JB, Eggert SL, Meyer JL, et al. Multiple trophic levels of a forest stream linked to terrestrial litter inputs. Science. 1997;277(5322):102–104.
- Wright MS, Covich AP. The effect of macroinvertebrate exclusion on leaf breakdown rates in a tropical headwater stream. Biotropica. 2005;37(3):403–408.
- Leroy CJ, Marks JC. Litter quality, stream characteristics and litter diversity influence decomposition rates and macroinvertebrates. Freshwater Biol. 2006;51(4):605–617.
- Graça MAS, Cressa C. Leaf quality of some tropical and temperate tree species as food resource for stream shredders. Int Rev Hydrobiol. 2010;95(1):27–41.
- Martins RT, Melo AS, Junior JFG, et al. Leaf-litter breakdown in urban streams of Central Amazonia: direct and indirect effects of physical, chemical, and biological factors. Freshwater Sci. 2015;34(2):716–726.
- Gonçalves JJF, Couceiro SRM, Rezende RS, et al. Factors controlling leaf litter breakdown in Amazonian streams. Hydrobiologia. 2017;792(1):195–207.
- Rincón J, Martínez I. Food quality and feeding preferences of Phylloicus sp. (Trichoptera:Calamoceratidae). J North Am Benthological Soc. 2006;25(1):209–215.
- Boyero L, Ramírez A, Dudgeon D, et al. Are tropical streams really different? J North Am Benthological Soc. 2009;28(2):127–133.
- Boyero L, Pearson RG, Dudgeon D, et al. Global distribution of a key trophic guild contrasts with common latitudinal diversity patterns. Ecology 2011;92:1839–1848.
- Gonçalves JF, MAF G, Callisto M. Leaflitter breakdown in 3 streams in temperate, Mediterranean, and tropical Cerrado climates. J North Am Benthological Soc. 2006;24(2):344–355.
- Boyero L, Ramírez A, Dudgeon D, et al. ¿Are tropical streams really different? J North Am Benthological Soc. 2009;28(2):397–403.
- Camacho R, Boyero L, Cornejo A, et al. Local variation in shredder distribution can explain their oversight in tropical streams. Biotropica. 2009;41(5):625–632.
- Yule CM, Leong MY, Liew KC, et al. Shredders in Malaysia: abundance and richness are higher in cool upland tropical streams. J North Am Benthological Soc. 2009;28(2):404–415.
- Longo M, Blanco JF. Shredders are abundant and species-rich in tropical continental-island low-order streams: gorgona Island, Tropical Eastern Pacific, Colombia. Revista De Biología Tropical. 2014;62:85–105.
- Reich PB, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proc Natl Acad Sci U S A. 2004;101(30):11001–11006.
- Carvalho E, Uieda V. Colonização por macroinvertebrados bentõnicos em substrato artificial e natural em um riacho da serra de Itatinga, São Paulo, Brasil. Revista Brasileira De Zoologia. 2004;21(2):287–293.
- Nessimian J, Henriques-Oliveira A. Colonização do “litter” de Eleocharis sellowiana Kunth. (Cyperaceae) por larvas de Chironomidae (Diptera) em um brejo no litoral do Estado do Rio de Janeiro. Entomología Y Vectores. 2005;12:159–172.
- Callisto M, Gonçalves J, Graça MAS. Leaf litter as a possible food source for chironomids (Diptera) in Brazilian and Portuguese headwater streams. Revista Brasileira De Zoologia. 2007;24(2):442–448.
- Carvalho E, Uieda V, Motta R. Colonization of rocky and leaf pack substrates by benthic macroinvertebrates in a stream in Southeast Brazil.Bioikos, Campinas 2008.Vol. 22 37–44.
- Annelida Oligochaeta MM, En: Domínguez E, Fernández H, Eds. Macroinvertebrados bentónicos sudamericanos, Sistemática y biología. San Miguel Tucumán. Fundación Miguel Lillo; 2009. p. 551–565.
- Martins RT, Silveira LS, Alves RG. Colonization by oligochaetes (Annelida: clitellata) in decomposing leaves of Eichhornia azurea (SW.) Kunth (Pontederiaceae) in a neotropical lentic system. Annales De Limnologie - Int J Limnol. 2011;47(4):339–346.
- Coscarón-Arias C. Simuliidae. En: Domínguez E, Fernández H, Eds. Macroinvertebrados bentónicos sudamericanos, Sistemática y biología. San Miguel Tucumán. Fundación Miguel Lillo. Fundación Miguel Lillo; 2009. p. 365–381.
