Figures & data
Fig. 1 Stereomicroscope micrographs of cross section of Crithmum maritimum mature fruit. (A) The mericarp is composed of a spongy outer coat, a secretory envelope, delimiting the large endosperm, and the rudimentary embryo. (B) A detailed view of the embryo region showing the endosperm micropylar and the embryo. Fig. 1 Micrographie réalisée suite à l’observation à la loupe binoculaire d’une coupe transversale du fruit de Crithmum maritimum: (A) Aspect général du fruit qui montre la graine entouré de l’enveloppe spongieuse et qui contient un large albumen et un embryon de taille réduite. (B) Détail de la partie embryonnaire montrant l’albumen micropylaire et l’embryon.

Fig. 2 Crithmum maritimum seed germination (%) over time of imbibition in distilled water or 200mM NaCl (means ± SE). Fig. 2 Cinétique de germination chez les graines de Crithmum maritimum en présence d’eau distillée ou d’une solution à 200mM NaCl (moyennes ± ES).
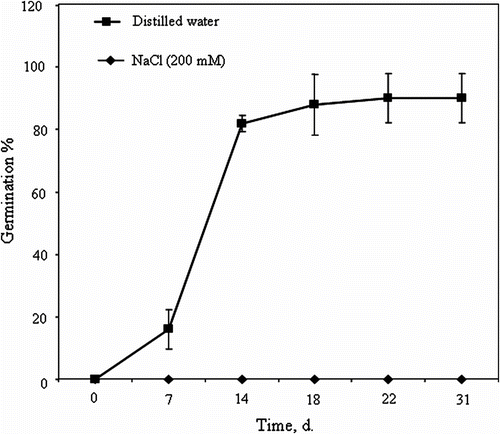
Fig. 3 Crithmum maritimum embryo growth within the seeds during imbibition in distilled water or 200mM NaCl. (A) Cotyledon growth over time. (B) Axis growth over time (means ± SE). Fig. 3 Croissance de l’embryon à l’intérieur de la graine durant l’imbibition des graines de Crithmum maritimum en présence d’eau distillée ou d’une solution de 200mM NaCl. (A) Croissance des cotylédons au cours de temps. (B) Croissance des l’axe embryonnaire (moyennes ± ES).
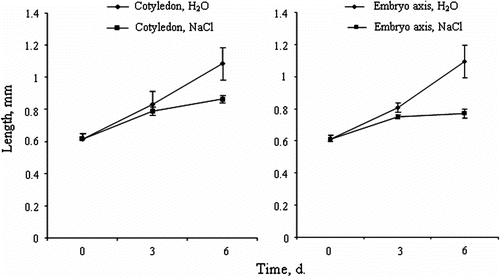
Fig. 4 SEM micrographs showing the endosperm degradation during imbibition: (A) Endosperm of non imbibed seeds (control). (B) Seed imbibed in distilled water for 3 days. (C) Seed imbibed in distilled water for 6 days. (D) Seed imbibed in distilled water during 3 days. (E) Seed imbibed in 200mM NaCl for 3days. (F) Seed imbibed in 200 mM NaCl for 6 days. (G) Seed imbibed in 200 mM NaCl for 3 days. All sections were realized at the same level of upper quarter of seed. Cot: cotyledon; End: endosperm; Ea: embryo axis. Fig. 4 Micrographies obtenues par microscopie électronique à balayage, illustrant la dégradation de l’albumen au cours de l’imbibition des graines de Crithmum maritimum (A) Coupe d’une graine sèche non imbibée. (B) Coupe d’une graine imbibée pendant 3 jours dans l’eau. (C) Coupe d’une graine imbibée pendant 6 jours dans l’eau. (D) Détails de la zone adjacente aux cotylédons d’une graine imbibée pendant 3 jours dans l’eau. (E) Coupe d’une graine imbibée en présence d’une solution de 200 mM NaCl pendant 3 jours. (F) Coupe d’une graine imbibée dans 200 mM NaCl pendant 6 jours. (G) Graine imbibée pendant 3 jours en présence d’une solution de 200 mM NaCl.
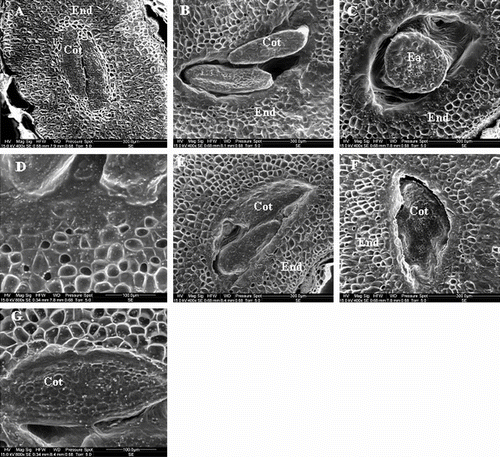
Fig. 5 Stereomicroscope micrographs showing the in situ activity of esterase and peroxidase. (A) Localization of esterase activity in seeds imbibed in distilled water for 6 days. ∗ embryo cavity ∗∗ lateral endosperm. (B) Localization of esterase activity in seeds imbibed in 200mM NaCl for 6 days. (C) Localization of peroxidase activity in seeds imbibed in distilled water for 6 days. (D) Localization of peroxidase activity in endosperm seeds imbibed in 200mM NaCl for 6 days. Fig. 5 Micrographies obtenues sous loupe binoculaire, montrant l’activité enzymatiques de l’ésterase et de la peroxydase. (A) Localisation de l’activité estérase dans les graines imbibées dans l’eau distillée. ∗ cavité embryonnaire, ∗∗ l’albumen latéral. (B) Localisation de l’activité estérase dans les graines imbibées dans une solution de 200 mM NaCl pendant 6 jours (C) Localisation de l’activité peroxydase dans les graines imbibées dans de l’eau distillée. ∗ cavité embryonnaire, ∗∗ l’albumen latéral. (D) Localisation de l’activité peroxydase dans les graines imbibées dans une solution de 200 mM NaCl pendant 6 jours.
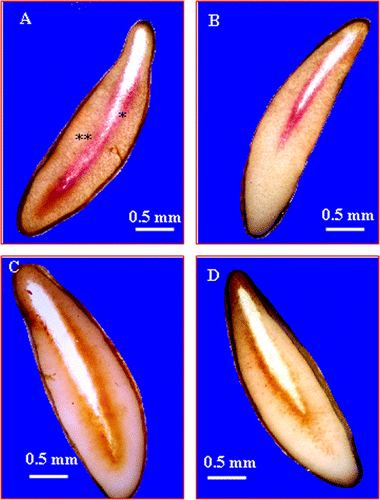
Fig. 6 (A) Light microscope micrograph of Crithmum maritimum showing the esterase activity at the vicinity of embryo cavity (ec). (B) Detail of light microscope micrograph showing the esterase activity in the oil globoid (og) at the vicinity of embryo cavity (ec). Fig. 6 Micrographie par microscope photonique, montrant l’activité estérase dans l’albumen des graines imbibées pendant 6 jours dans l’eau distillée (A) au niveau de la cavité embryonnaire (ec) et de l’albumen périphérique. (B) Micrographie par microscopie photonique montrant la localisation de l’activité estérase au niveau des globules lipidiques (og).
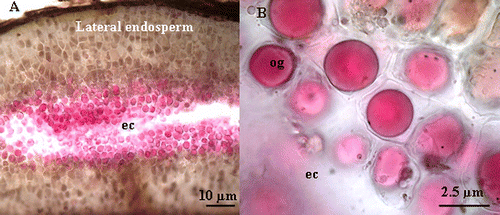
Fig. 7 Light microscope micrographs showing the peroxidase activity in the endosperm of Crithmum maritimum L. (A) localization of peroxidase activity at the vicinity of embryo cavity in the reserve globoids. (B) Localization of peroxidase activity in an intermediary zone (iz) between the lateral endosperm and the embryo cavity (ec). Note that the activity is mainly located in intercellular space. (C) Details of an oil globoid showing the peroxidase activity (arrows). (D) Localization of peroxidase activity in cell wall of lateral endosperm (arrow). (E) and (F) localization of peroxidase activity in lateral endosperm; the white arrow indicates the activity in the cell wall (cw) and the black arrow indicates the activity in the plasma membrane. Fig. 7 Micrographie obtenue par microscopie photonique, montrant l’activité de péroxydase dans l’albumen des graines imbibées pendant 6 jours dans l’eau distillée. (A) Au niveau des globules lipidiques (flèche) tout près de la cavité embryonnaire (ce) et (B) au niveau du milieu intercellulaire dans une zone intermédiaire (iz) entre la cavité embryonnaire et l’albumen périphérique. (C) Détail d’un globule lipidique montrant une forte activité peroxydasique (flèche) tout près de la cavité embryonnaire. (D) et (E) localisation de l’activité de péroxydase au niveau du milieu intercellulaire et de la paroi cellulaire de l’albumen périphérique (flèche).
