RESUMEN
La morbimortalidad causada por infecciones vinculadas a la atención sanatoria ha llevado a cuestionar si los métodos de desinfección convencionales son inadecuados y se requieren métodos complementarios, como la fumigación de la habitación y la irradiación ultravioleta. Ello ha dado lugar a la preocupación por que estos métodos alternativos puedan poner en riesgo al personal sanitario y a los pacientes.
Objetivos. (1) Determinar la eficacia de la lámpara ultravioleta C germicida portátil para la desinfección de superficies, (2) evaluar el cambio de la humedad relativa (HR) y las distintas distancias específicas en las tasas de letalidad bacteriana, y (3) evaluar los posibles problemas a que conlleva la exposición.
Métodos. En el presente estudio se investiga si una lámpara germicida portátil puede desinfectar de forma eficaz superficies tratadas con esporulación o germinación bacteriana y se evalúa el efecto de condiciones ambientales cambiantes, como la humedad relativa (HR), la posición y las distancias específicas, en las tasas de letalidad germicida.
Resultados. Se constató una mejor tasa de letalidad con una HR de 40–65% y en un rango de temperatura de 21–24°C. Tanto la HR alta como la HR baja interfirieron con la capacidad de la radiación UV-C para inactivar la germinación microbiana. En el caso de la esporulación bacteriana, el aumento del secado de la superficie fue el factor de mayor importancia para aumentar la tasa de letalidad.
Conclusiones. En esta investigación se demostró la eficacia de la radiación UV-C bajo condiciones óptimas, irradiación directa y una distancia específica corta (12.7 cm). Sin embargo, cuando es utilizada en condiciones que no son óptimas existen limitaciones. El aumento de la distancia y los ángulos de irradiación indirecta resultaron en tasas de letalidad más bajas. Cabe señalar que durante su uso es importante minimizar la exposición innecesaria de pacientes y personal sanitario.
Introducción
Las infecciones asociadas a la atención sanatoria (IAAS) son un importante factor de morbilidad, mortalidad y costos en los centros sanitarios.[Citation1–4] Klevens et al. estimaron que en 2002 hubo 1.7 millones de IAAS y 98,987 fallecimientos. Scott estimó el costo de las IAAS en 28.4 a 33.8 miles de millones de dólares después del ajuste a dólares ocurrido en 2007. En la investigación se demostró que el costo asociado a cepas resistentes es de 27,000 a 127,000 dólares superior que el costo ligado a cepas no resistentes.[Citation5] La cuestión del costo ha sido una preocupación especial para la industria de la atención médica, porque en 2008 los Centros para los Servicios de Medicare y Medicaid comenzaron a denegar pagos para el tratamiento de las IAAS.[Citation6] El problema del costo de las IAAS es complejo y en él influyen muchos factores, entre los que se incluyen el tipo de procedimiento aplicado al paciente y el tipo de microorganismo infeccioso. En un estudio realizado en 2011 por Umscheild et al. se halló que el porcentaje prevenible de IAAS oscilaba entre 45% y 69%.[Citation7] Esto podría resultar en hasta 134,800 infecciones menos y 3,100 fallecimientos menos, así como en un ahorro al sistema de atención médica del país de 160 a 630 millones de dólares anuales.
El esfuerzo por combatir las IAAS aumentó el interés en el uso de desinfectantes más fuertes o en la implementación de estrategias de desinfección alternativas.[Citation8,Citation9] Algunos de los nuevos desinfectantes líquidos contienen agua oxigenada, mezclas de ácido paracético y agua oxigenada, así como agua superoxidada (electrolizada). Entre las estrategias de desinfección alternativas se incluyen la fumigación del lugar y la desinfección de superficies con radiación ultravioleta C (UVC).[Citation10,Citation11] La preocupación por el entorno como causa de las IAAS y la percepción de que los métodos actuales de limpieza y desinfección de superficies son ineficaces ha llevado a que en los centros sanitarios se empleen desinfectantes líquidos más fuertes, a la fumigación química del lugar y la irradiación germicida con radiación UVC. Es importante recordar que los desinfectantes químicos germicidas no solo tienen potencial para inactivar a los microbios, sino también para causar daño a los pacientes y el personal sanitario. Una cuestión fundamental tiene que ver con el hecho de que tanto el empleado que usa el germicida químico como los pacientes que se encuentren en el lugar poco tiempo después de la limpieza puedan quedar expuestos. Además de ser más susceptibles a daños, debido a enfermedades asociadas a la inmunodepresión, estos pacientes pueden llegar a estar expuestos de manera continua mientras están hospitalizados. Asimismo, cabe señalar que la exposición a radiación ultravioleta puede provocar daño en la piel, los ojos y el sistema inmunitario.[Citation12] Además, está bien comprobado que todas las formas de radiación ultravioleta, incluida la luz UVC, pueden causar cáncer de piel.[Citation13,Citation14] Desde el lado positivo, se sabe que de las bandas UV la radiación UVC es la que tiene menor posibilidad de producir cáncer de piel, gracias a su penetración relativamente baja, lo que permite que la radiación sea absorbida por la capa externa de células muertas de la piel.[Citation15]
El Staphylococcus aureus resistente a la meticilina (EARM) y otras bacterias grampositivas se han convertido en un problema cada vez más común en los entornos de atención sanatoria.[Citation16–18] Otra preocupación importante se relaciona con el aumento de la incidencia de infecciones causadas por Clostridium difficile (C. difficile).[Citation19] Hoy en día se considera que la esporulación de este organismo es la causa más importante de IAAS diarreicas.[Citation20] El Acinetobacter baumannii es otro microorganismo implicado en las IAAS que se ha vinculado a la contaminación ambiental.[Citation21–23] También el norovirus, principalmente una enfermedad de origen alimentario, se está convirtiendo en un problema grave de IAAS en los centros de atención médica, porque sobrevive en las superficies y es altamente contagioso.[Citation24] Uno de los microbios que genera preocupación, de aparición más reciente, es el Enterobacteriaceae resistente a los carbapenémicos (ERC), que involucra especialmente al Klebsiella pneumoniae.[Citation25,Citation26] El ERC se está volviendo prevalente en los hospitales de EE.UU., debido a que es difícil de tratar y su tasa de letalidad puede exceder el 40%.[Citation27] Considerando los aspectos positivos, los microorganismos ERC son menos resistentes a la desinfección ambiental que otros microorganismos, como aquellos con esporulación.
Nuestro conocimiento sobre los microbios que causan más morbilidad y mortalidad, así como sobre los costos que involucran continúa evolucionando. Se ha asumido que el C. difficile es uno de los patógenos más peligrosos, por su resistencia al entorno y su alta prevalencia en hospitales. Sin embargo, Stewart y Hollenbeak consideran que, a raíz del sesgo de notificación, se ha sobrestimado la contribución del C. difficile a los costos y la mortalidad.[Citation28] En este sentido, encontraron que, al momento de estimar los costos totales del C. difficile para los sistemas de atención sanatoria, los investigadores no habían controlado las diferencias entre tipos de hospitales, poblaciones de pacientes y presencia de comorbilidades como la diabetes. Esta es una consideración fundamental si se considera que la preocupación por limitar la propagación de infecciones causadas por el C. difficile ha sido una de las principales razones para buscar modalidades de desinfección alternativas.
Hasta hace poco era común suponer que el factor de riesgo más importante para las IAAS era la propagación por contacto directo entre un portador y el paciente o la autoinfección del paciente ocasionada por la presencia de microorganismos colonizadores.[Citation29,Citation30] De acuerdo con los Centros para el Control y Prevención de Enfermedades (Centers for Disease Control and Prevention, CDC), existen pocos informes que documenten la “causa y efecto” de la contaminación e infección ambientales.[Citation31] En los último años se han realizado diversos estudios que indican que el entorno desempeña un papel relevante en las IAAS.[Citation18, Citation21, Citation30,Citation32–44] Los factores que contribuyen a la contaminación de los entornos de atención sanatoria son diversos. Los pacientes infectados con EARM y otras enfermedades contagiosas pueden propagar estos microorganismos y posiblemente sean una fuente que provoca las IAAS.[Citation33,Citation37,Citation39,Citation45–48] Tomando en cuenta que el C. difficile es un microorganismo de esporulación, podría esperarse que sea viable durante meses.[Citation49] Desde hace mucho tiempo se sabe que el entorno del paciente es un reservorio de infecciones causadas por el C. difficile.[Citation50] Incluso las batas quirúrgicas y los guantes usados para proteger al trabajador de atención sanatoria se consideran contaminados y sirven como vehículos de transmisión.[Citation51] Una preocupación especial proviene del hecho de que los textiles hospitalarios, como ropa de cama, paños quirúrgicos, uniformes, ropa del paciente y muchos otros, pueden desempeñar un papel en la transmisión de infecciones.[Citation52] Aunado a ello, existe evidencia de que el entorno afecta la supervivencia de ciertos tipos de especies o cepas de microorganismos. Por ejemplo, las cepas de A. baumannii sobreviven mejor a la desecación que otros Acinetobacter sp.[Citation45,Citation53] En el caso del C. difficile, la evidencia muestra que la cepa de Tipo 027/NAP1 ha mutado y ahora produce más toxinas, tiene mayor patogenicidad y eficacia.[Citation19,Citation54] Akerlund et al. se refieren a este microorganismo mutado como “hipervirulento”.
Aunque la evidencia de que ciertos microbios pueden sobrevivir en el entorno por largos periodos de tiempo es amplia, la suposición de que el entorno ocasionó la infección se ha basado principalmente en estudios de correlación. En realidad, aún no se conoce bien el mecanismo concreto de transferencia del microorganismo infeccioso al paciente. Un estudio observacional a gran escala intentó identificar los tipos de contactos entre pacientes, personal de atención sanatoria y visitantes que tienen riesgo de contraer IAAS.[Citation55] Los investigadores hallaron que en 21.6% de las interacciones entre paciente y proveedor de atención médica no hubo contacto con el paciente ni con el entorno. La interacción más frecuente fue el contacto del paciente con el entorno solamente (33.5%), seguida por el contacto con la piel sana del paciente (27.1%). La interacción con mayor potencial para la transmisión de la infección radicó en el contacto con la sangre o las secreciones corporales del paciente (17.8%). Se prestó especial atención al uso adecuado de los guantes mientras se tocaba la sangre o las secreciones corporales. El estudio reveló que los proveedores de atención sanatoria cumplían con este requisito durante más de 94% del tiempo, mientras que solo 33% de los visitantes lo cumplían. Este es un aspecto que debe considerarse, pues el incumplimiento en la higiene de las manos y la política de uso de guantes por los visitantes puede aumentar de manera importante la probabilidad de transmisión de infecciones.
El uso de radiación UV en los centros de atención sanatoria tiene una larga historia. En este sentido, durante muchos años se ha empleado radiación UVA para el curado de resinas plásticas y como luz ultravioleta. Asimismo, se han utilizado luces ultravioletas para identificar la presencia de plagas de roedores y realizar demostraciones de higiene de manos (Glo Germ). Recientemente, los servicios ambientales han aplicado este método para evaluar la calidad de la desinfección de superficies.[Citation56] Durante más de 100 años se ha utilizado radiación UVC para la desinfección de las vías respiratorias altas en el control de la tuberculosis u otras enfermedades respiratorias.[Citation15] El procedimiento más efectivo implica la colocación de las lámparas germicidas en la parte superior del lugar, protegiéndolas para disminuir la exposición humana. Otro método eficaz es la colocación de las lámparas UVC en el conducto del sistema de extracción o la desinfección de las espirales de enfriamiento del sistema de ventilación.[Citation57–59] Para ser más eficiente, el diseño del extractor de ventilación por dilución debe llevar los patógenos respiratorios hasta la proximidad más cercana de las lámparas germicidas UVC. Chang y Young hallaron que, en situaciones en que la radiación UVC es alta, la turbulencia del aire es alta y las velocidades del aire son bajas, lo que reduce la eficacia germicida.[Citation60] Al respecto, enfatizan en la importancia de realizar estudios de muestras de turbulencia seleccionadas antes de considerar el uso de luz UVC germicida, de modo de asegurar que los microorganismos respiratorios sean conducidos hacia la proximidad de las lámparas.
Aunque existe una larga historia de uso de luz UVC para la desinfección de las vías respiratorias altas, su utilización para la desinfección de superficies constituye un desarrollo relativamente reciente.[Citation8 ,Citation61–65] Un posible uso importante de la lámpara UVC germicida portátil podría ser la desinfección de superficies de contacto frecuente, por ejemplo, el teclado, las barandas de la cama del paciente, las mesas de noche e incluso los celulares. Recientemente ha surgido preocupación en torno al hecho de que los teléfonos móviles puedan servir como reservorio de infecciones hospitalarias.[Citation66] Los investigadores hallaron que 100% de los teléfonos del personal de atención sanatoria estaban contaminados con microbios debido a una desinfección e higiene de manos inadecuada. La lámpara UVC germicida podría ser una alternativa eficaz a los desinfectantes líquidos para desinfectar estos fómites. Existen diversos desafíos respecto al uso de esta modalidad germicida porque, en general, es más fácil inactivar a los microbios en el aire que en las superficies. Desafortunadamente, la investigación actual no ha considerado ciertos factores que limitan la eficacia de la luz UVC, como la fotorreactivación, la humedad relativa (HR), la estabilidad de la emisión de radiación y el ángulo de radiación, en la determinación de las tasas de letalidad microbiana.[Citation67–70] Nuestra investigación explora los efectos de la HR, la emisión de radiación y el ángulo de radiación en la eficacia de la luz UVC, con la finalidad de determinar los usos adecuados y las limitaciones que conlleva esta tecnología.
Materiales y métodos
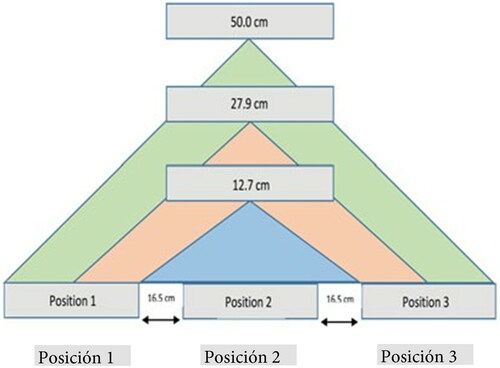
Los procedimientos se realizaron en una sala de laboratorio especializada que contaba con controles termostáticos y sin humidificación de la sala. Debido a que normalmente la humedad relativa de la sala es de 30%, se utilizó un humidificador portátil para ajustar los niveles de humedad. Además, se empleó una caja cuadrada de Plexiglas de 61 × 61 cm para todas las pruebas, así como una plataforma ajustable para variar la fuente de emisión a ciertas distancias específicas (véase la ). La luz UVC germicida de administró con una lámpara ultravioleta ColePalmer (modelo HV-09813-00). Esta unidad funciona a 254 nm y produce 2,400 microvatios/cm2 a 12.7 cm con una lámpara de 40.6 cm de largo. Se realizaron mediciones de la intensidad para varios intervalos de tiempo de exposición con un medidor de luz UVC digital General UV512, diseñado para medir la luz ultravioleta en el rango de 220-275 nm. Se utilizó una cepa de germinación bacteriana, Staphylococcus epidermidis (S. epidermidis) de la Colección Estadounidense de Cultivos Microbianos de Referencia (American Type Culture Collection, ATCC) 12228 (nivel de bioseguridad 1) y una cepa de esporulación bacteriana Bacillus subtilis (B. subtilis), subespecie spizizenii ATCC 6633 (nivel de bioseguridad 1) como sustitutos del EARM y el C. difficile. Cada prueba de irradiación de UV-C se repitió por triplicado e implicó los siguientes pasos.[Citation8]
Se rehidrató un gránulo liofilizado comercial (Microbiologics KWIK-STIK) de cada microorganismo y se incubó durante la noche en una placa de agar con sangre ovina a 37 °C. Los organismos se colocaron en placas y se incubaron dos veces durante la noche para permitir su estabilización. Empleando una técnica estéril, se realizaron suspensiones de cada microorganismo en caldo de triptona de soja (trypticase soy broth, TSB), en un rango de 104 o 105 concentraciones, con el uso de un densitómetro diseñado para medir la turbidez de la disolución de suspensiones bacterianas. Se sembraron en estrías cuatro superficies de láminas cubiertas de vinilo (7.5–10 cm de tamaño) con 10 microlitros de concentraciones de 104 o 105 del microbio, extendidos en un círculo de 7.6 cm con una espátula bacteriana estéril (Cole-Palmer). Para inocular cada placa, se utilizaron dispositivos Microbiologics KWIK-STIK. Cada unidad de KWIK-STIK contenía gránulo liofilizado de un microorganismo que fue reconstituido, colocado en placas y cultivado durante 24 horas. Se realizó una dilución en caldo de triptona de soja (TSB) con el microorganismo en desarrollo. Se inocularon 10 µl de la dilución en las superficies de las láminas y se extendieron en un círculo de tres pulgadas. Cada superficie de prueba se dejó secar durante 10 o 30 min. Antes de iniciar cada procedimiento se calentó la lámpara UVC. Tomó aproximadamente tres minutos que esta alcanzara la intensidad máxima, que luego disminuyó a un ritmo constante hasta aproximadamente 30% de esa intensidad durante un periodo de 30 minutos. Transcurridos los mismos, la emisión se mantuvo relativamente estable y lista para ser usada. El fotómetro se colocó en las posiciones 1, 2 y 3, de izquierda a derecha, como lo muestran las y ; las posiciones 1 y 3 estaban a 16.5 cm del centro, como se muestra en la y la lámpara UVC se colocó a 12.7, 27.9 y 50 cm por encima de la posición 2. Las lecturas se registraron como µWs/cm2 (intensidad en µW/cm2 veces la exposición en segundos). En las series analíticas del S. epidermidis, el fotómetro se colocó horizontalmente contra la superficie de prueba. Debido a que el sensor estaba ubicado a aproximadamente un centímetro debajo de la superficie de la sonda del fotómetro, esta orientación resultó en un cálculo demasiado bajo de la intensidad de radiación esparcida. Durante las pruebas del B. subtilis, la orientación del sensor del fotómetro en las posiciones 1 y 3 se modificó a una distancia específica de 12.7 cm, colocando la sonda en un ángulo de 90 grados frente a la lámpara UVC. Esto aumentó la radiación esparcida en aproximadamente 2½ veces. Las tres superficies de las láminas contaminadas se colocaron bajo la lámpara UVC durante 5 segundos, 10 segundos, 30 segundos o 5 minutos en las posiciones 1–3, como lo muestra la ; la superficie de prueba 4 se utilizó como control para fines comparativos.
La recolección de muestras se realizó en placas BBL preparadas con envoltura aislante para el monitoreo ambiental, de Becton, Dickinson y Company, agar neutralizante D/E, detección y recuento de microorganismos replicados (Replicate Organism Detection and Counting, RODAC). Las placas de RODAC se estructuraron con medios de cultivo en agar elevado, de forma que se pudiera presionar sobre una superficie para recolectar las muestras de contaminación microbiana. Tras la exposición a la luz UVC, cada una de las placas de RODAC fue presionada suavemente sobre las superficies de las láminas contaminadas durante 10 segundos. De inmediato, las placas de RODAC se incubaron a 37°C durante 24 a 48 horas y se registró el número de unidades formadoras de colonias (UFC).
Después de cada serie analítica se desinfectaron las superficies de prueba con toallitas germicidas. El procedimiento original requirió el uso de un desinfectante de amonio cuaternario. Cuando fue evidente que el desinfectante de amonio cuaternario residual no estaba neutralizado de forma adecuada y exhibía propiedades bacteriostáticas, se cambió a isopropanol al 70%. Realizada la desinfección, las superficies de prueba se colocaron en un recipiente cubierto para ser reutilizadas. Se inocularon las placas de agar con TSB con el fin de revisar la pureza de la cepa en cada nueva dilución. Una vez desinfectadas, y antes de ser inoculadas con microorganismos, las placas de agar con TSB de control de esterilidad se inocularon con hisopos secos frotados en cada superficie de la lámina. Cada placa fue incubada durante 24 horas para verificar su contaminación y su pureza.
Se supervisaron la temperatura y la HR con un psicrómetro digital Amprobe THWO-3; ambas fueron registradas durante todas las series analíticas. Se notificaron los promedios y las desviaciones estándar. Luego se aplicaron métodos de análisis estadístico, como la prueba de la t para datos emparejados y un ANOVA para analizar la significación estadística de estos factores ambientales.
El Comité Institucional de Bioseguridad (Institutional Biosafety Committee, IBC, Número 12B-2014) de Illinois State University revisó y aprobó este estudio. Mientras se trabajaba con los microbios y la lámpara UVC se usaron gafas UV, guantes de nitrilo y batas de laboratorio.
Resultados
Se realizó un total de ocho ensayos de 105 concentraciones de S. epidermidis a una distancia específica de 12.7 cm, dos ensayos a 29.7 cm y un ensayo a 50.0 cm, con una humedad que osciló entre 21 y 84% de HR. La muestra las intensidades de luz UVC y UFC en las tres distancias específicas y con HR distintas, así como sus efectos sobre las tasas de letalidad microbiana del S. epidermidis. Como muestra la , a una distancia específica de 12.7 cm, solo la posición 2 estuvo bajo radiación directa. A una distancia específica de 29.7 cm, solo una parte de las superficies de prueba en las posiciones 1 y 3 estuvo expuesta directamente a la radiación y, a la distancia de 50 cm, todas las superficies de prueba estuvieron bajo radiación directa.
Tabla 1. Efectos de la intensidad, ángulo de radiación, distancia específica y HR en las tasas de letalidad sobre el S. epidermidis.a
La muestra que las intensidades más altas de luz UVC y las mayores tasas de letalidad se encontraron en la posición 2 en un rango de HR de 44-65%. En la distancia específica de 12.7 cm en la posición 2, hubo una reducción logarítmica de casi 5 en las UFC durante todas las series de pruebas. En las posiciones 1 y 3, la tasa de letalidad microbiana en la HR alta (≥75%) y HR baja (≤21%) disminuyó a una reducción logarítmica inferior a 4. Las diferencias en las reducciones logarítmicas comparadas bajo radiación directa e indirecta tuvieron importancia estadística a un valor p de 0.01 y, cuando se compararon las posiciones 1 y 2 con una HR baja, la reducción de la tasa de letalidad fue estadísticamente significativa a un valor p de 0.002. En las distancias específicas más altas y con una HR óptima (40–50%), se observó una reducción logarítmica de 3.5 a 4 en las tres posiciones. La intensidad de la UV µW-s disminuyó al aumentar la distancia, de conformidad con la ley del cuadrado inverso.
En la se demuestra que el uso de un inóculo de 104, una distancia específica de 12.7 cm, una HR de 45% y un tiempo de secado de la superficie de prueba de 10 min produjo una reducción logarítmica promedio de 3 (2.7–3.2) en las UFC de B. subtilis en la posición central y una reducción logarítmica de aproximadamente 2 en las posiciones 1 y 3. En las y se demuestra que al incrementar el tiempo de secado a 30 min se observaron tasas de letalidad notablemente más altas. Incluso con humedad alta se constató una reducción logarítmica de 5 en las tres posiciones a la distancia específica de 12.7 cm cuando las superficies de prueba se secaron durante 30 min.
Tabla 2. Efectos del ángulo de radiación, duración de la exposición y la HR en un inóculo de 104 de B. subtilis.
En la se presentan los efectos provocados por el ángulo de radiación y la HR en un inóculo de 105 [sic] de B. subtilis. En la posición 1 y 3 con humedad alta se constató una reducción logarítmica de aproximadamente 4.3 y con humedad baja una reducción logarítmica de 4.1. Estas diferencias no son significativas. En la posición central se registró una reducción logarítmica de aproximadamente 5 en todas las pruebas. Sin embargo, las diferencias en las reducciones logarítmicas comparadas de las exposiciones a la radiación directa e indirecta fueron significativas a un valor p de <0.001.
Tabla 3. Efectos del ángulo de la radiación y de la HR en un inóculo de 103 de B. subtilis a una distancia específica de 12.7 cm, exposición de 5 min y temperatura de 23–24°C.
En la se muestra que a las distancias específicas de 27.9 y 50 cm las tasas de letalidad fueron similares en exposiciones de 5 y 10 segundos. En cada caso se produjo una reducción logarítmica de aproximadamente 3.3 a 3.4 en el recuento de B. subtilis. La exposición de 30 segundos solo aumentó la reducción logarítmica a 3.5 en promedio.
Tabla 4. Efectos del ángulo de radiación, distancia y tiempo de exposición en un inóculo de 105 de B. subtilis en un rango de HR de 46–60% y temperaturas de 22–23°C.
En la se evaluaron los efectos del tiempo de exposición en las tasas de letalidad del B. subtilis. Aunque la colocación de la lámpara UVC a la distancia mínima específica resultó en intensidades más altas, también trató el área más pequeña de superficie. El aumento de las distancias específicas incrementó el área de tratamiento, pero requirió exposiciones más prolongadas. Nuestras pruebas demostraron que, a una distancia específica de 12.7 cm, el tiempo de exposición de 10 segundos resultó en una tasa de letalidad óptima (reducción logarítmica de 4.9) en la posición central. La mejora en la tasa de letalidad al aumentar la duración de la exposición de 5 a 10 segundos tuvo significancia estadística en el valor p < 0.001. El aumento de la exposición a 30 segundos no aumentó la tasa de letalidad.
Tabla 5. Efectos de la duración de la exposición en un inóculo de 105 de B. subtilis en la posición central de prueba a una HR de 44-55% y una temperatura de 23°C.
En cuanto a la exposición del operador, con la ubicación de la lámpara a 12.7 cm por encima de la superficie de prueba, se midió una dispersión de radiación posiblemente peligrosa. Con el fotómetro colocado a 30.5 cm directamente encima de la superficie de prueba, medimos 6 µW/cm2. El valor umbral límite (threshold limit value, TLV) para la radiación ultravioleta con una longitud de onda de 254 nm es de 6 mJ/cm2. Ello significa que si un miembro del personal de atención sanatoria usara la lámpara durante una hora, la cantidad de dispersión de la radiación podría resultar en una exposición de 3.6 veces este límite, mientras que una exposición de 8 horas podría ser 28.8 veces ese límite.[Citation71] La dispersión de la radiación en un ángulo de 90° medido de forma horizontal desde la lámpara fue de 18 µW/cm2 a 30.5 cm y de 4 µW/cm2 a 50.8 cm (en la abertura de la cámara de prueba).
Discusión
La tasa de letalidad microbiana del S. epidermidis fue mayor en un rango de humedad relativa de 40 a 60%. Nuestros resultados confirman que la HR alta interfiere con la capacidad de los sistemas UV para inactivar los patógenos con éxito. Existe poca investigación sobre los efectos de la HR baja (<30%) en la eficacia de la radiación UVC.[Citation72] Hallamos que la HR baja también interfiere con la capacidad de la luz UVC para inactivar al S. epidermidis. Los efectos de la HR sobre las tasas de letalidad del B. subtilis fueron menos pronunciados, constatándose que el principal factor que afecta dichas tasas es el tiempo de secado de las superficies de prueba. Al utilizar un tiempo de secado de la superficie de 10 min, aumentó significativamente la capacidad de sobrevivir a los efectos de la desinfección UV del B. subtilis. Un tiempo de secado de las superficies de prueba de 30 min resultó en una tasa de letalidad notablemente más alta y se determinó que representa una medición más cercana a las condiciones de uso real.
Los resultados corresponden a la ley del cuadrado inverso con la lámpara UVC a 12.7 cm, 27.9 cm y 50 cm de distancia de la superficie de prueba. A distancias específicas más bajas (), las posiciones 1 y 3 solo reciben exposición de radiación indirecta. A la distancia máxima de 50 cm, las posiciones 1 y 3 reciben exposición directa de radiación, proporcionando una tasa de letalidad similar a la de la posición 2. Los efectos de la distancia sobre la intensidad y la geometría de radiación constituyen consideraciones importantes a tener en cuenta al momento de usar luz UVC como agente germicida para superficies. La colocación de la lámpara UVC a la distancia mínima entre la fuente y la distancia específica resultará en la intensidad más alta, pero también tratará un área más reducida de superficie. La colocación de la lámpara a una distancia específica mayor aumentará el área de tratamiento, pero puede ser necesario incrementar el tiempo de exposición para maximizar la tasa de letalidad. Nuestras pruebas demostraron que, a una distancia específica de 12.7 cm, el tiempo de exposición de 10 segundos resultó en una tasa de letalidad óptima (reducción logarítmica de 4.9).
Entre las limitaciones observadas se incluyen: (1) las lámparas UVC de vapor de mercurio pierden intensidad a un ritmo constante durante aproximadamente 30 min antes de la estabilización; (2) no se probó la fotorreactivación. Este es un fenómeno en el que los microbios inactivados reparan el daño celular, recuperándose completamente una vez expuestos a una luz de longitud de onda mayor.[Citation68,Citation69] No podemos descartar que este fenómeno haya afectado algunos de nuestros resultados; (3) la exposición a luz UVC puede provocar efectos oculares o dérmicos. Por lo tanto, es fundamental que todas las personas, especialmente los pacientes, eviten exposiciones innecesarias. Al usar una lámpara desinfectante portátil, se debe utilizar equipo de protección personal para los ojos y la piel.
Conclusiones
Una limitación inherente al uso de la lámpara UVC portátil es que la emisión no es estable. El tiempo de calentamiento de 30 min y la pérdida de intensidad de 30% dificultan el cálculo de las dosis. La distancia de la fuente de emisión a la distancia específica y la geometría de la radiación fueron factores importantes en relación con la intensidad de la radiación y las tasas de letalidad. Asimismo, al considerar la distancia óptima de la fuente de emisión y la distancia específica, se constata un equilibrio. Una distancia específica corta proporciona intensidades y tasas de letalidad más altas, pero trata un área de superficie más pequeña. La humedad tuvo cierto efecto sobre las tasas de letalidad del S. epidermidis, pero no del B. subtilis. En el caso de este último, la sequedad de la superficie constituyó un factor importante. La irradiación de una superficie húmeda tratada con B. subtilis resultó en una reducción importante de la tasa de letalidad. Una limitante de esta investigación radica en que no se probó la fotorreactivación. No podemos descartar que este fenómeno haya afectado algunos de nuestros resultados. Una preocupación crucial es que la exposición a luz UVC puede provocar efectos oculares o dérmicos. Nuestros resultados indican que, al usar la lámpara UVC portátil, es posible la dispersión de cantidades importantes de radiación hacia el miembro del personal sanitario. Por lo tanto, es fundamental que todas las personas que manejen el dispositivo tengan especial cuidado, evitando exponerse o exponer a los pacientes. Al momento de usar una lámpara desinfectante portátil se debe utilizar equipo de protección personal para los ojos y la piel.
La luz UVC germicida está siendo promocionada activamente para su uso en hospitales, sin considerar su eficacia ni los posibles riesgos que conlleva dicho uso. Al entender los riesgos y los beneficios asociados al uso de luz UVC para la desinfección de superficies, los profesionales de salud y seguridad pueden asesorar mejor a los administradores de atención médica acerca de los usos adecuados de esta tecnología.
Financiación
Esta investigación recibió el apoyo del subsidio interno N°. URG FY 2016 de Illinois State University.
Agradecimientos
Los autores desean agradecer a Colin Hendrickson por su ayuda en la investigación. Colin trabaja actualmente para Ameri-Corps en Minot, Dakota del Norte.
Referencias
- Klevens, R.M. et al.: Estimating health care-associated infections and deaths in U.S. hospitals, 2002. Public Health Rep. 122(2):160–166 (2007).
- Scott, R.D.: The Direct Medical Costs of Healthcare- Associated Infections in U.S. Hospitals and the Benefits of Prevention. CS200891-A, 1–13. Atlanta, GA: Centers for Disease Control and Prevention (CDC), 2009.
- De Angelis, G., A. Murthy, J. Beyersmann, S. Harbarth: Estimating the impact of healthcare-associated infections on length of stay and costs. Clin. Microbiol. Infect. 16(12):1729–1735 (2010).
- Graves, N., Harbarth S., Beyersmann J., Barnett, A., Halton K., Cooper B.: Estimating the cost of health care-associated infections: mind your p’s and q’s. Clin. Infect. Dis. 50(7):1017–1021 (2010).
- Neidell, M.J. et al.: Costs of healthcare- and community-associated infections with antimicrobial-resistant versus antimicrobial-susceptible organisms. Clin. Infect. Dis. 55(6):807–815 (2012).
- Stone, P.W. et al.: CMS changes in reimbursement for HAIs: setting a research agenda. Med. Care 48(5):433–439 (2010).
- Umscheid, C.A. et al.: Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect. Control Hosp. Epidemiol. 32(2):101–114 (2011).
- Rutala, W.A., M.F. Gergen, D.J. Weber: Room decontamination with UV radiation. Infect. Control Hosp. Epidemiol. 31(10):1025–1029 (2010).
- Boyce, J.M.: Modern technologies for improving cleaning and disinfection of environmental surfaces in hospitals. Antimicrob. Resist. Infect. Control 5:1–10 (2016).
- Byrns, G., T.P. Fuller: The risks and benefits of chemical fumigation in the health care environment. J. Occup. Environ. Hyg. 8(2):104–112 (2011).
- Byrns, G.: Alternative room disinfection modalities – pros and cons. In The Use of Biocidal Surfaces for Reduction of Healthcare Acquired Infections. G. Borkow (ed.). Springer, 2014. pág. 187–202.
- Lucas, R., T. McMichael, W. Smith, B. Armstrong: Solar ultraviolet radiation: global burden of disease from solar ultraviolet radiation. Environmental Burden of Disease Series, 13:1–250. Geneva: World Health Organization, 2006.
- Ayala, F., M. Palla, T.R. Di, N. Mozzillo, P.A. Ascierto: The role of optical radiations in skin cancer. ISRN. Dermatol. 2013:842359 (2013). doi:https://doi.org/10.1155/2013/842359
- NTP: Report on Carcinogens. 12th ed. Report on Carcinogens. Department of Health and Human Services, 429–534 (2011).
- Reed, N.G.: The history of ultraviolet germicidal irradiation for air disinfection. Public Health Rep. 125(1):15–27 (2010).
- Dancer, S.J., L.F. White, J. Lamb, E.K. Girvan, C. Robertson: Measuring the effect of enhanced cleaning in a UK hospital: a prospective cross-over study. BMC Med. 7:28 (2009).
- Bhalla, A., D.C. Aron, C.J. Donskey: Staphylococcus aureus intestinal colonization is associated with increased frequency of S. aureus on skin of hospitalized patients. BMC Infect. Dis. 7(105):1–7 (2007).
- Oie, S., S. Suenaga, A. Sawa, A. Kamiya: Association between isolation sites of methicillin-resistant Staphylococcus aureus (MRSA) in patients with MRSA-positive body sites and MRSA contamination in their surrounding environmental surfaces. Jpn. J Infect. Dis. 60(6): 367–369 (2007).
- Zilberberg, M.D., G.S. Tillotson, L.C. McDonald: Clostridium difficile infections among hospitalized children, United States, 1997–2006. Emerg. Infect. Dis. 16(4):604–609 (2010).
- Wilcox, M.H., Fawley, W.N., Wigglesworth, N., Parnell, P., Verity, P., Freeman, J., Cooper B.: Comparison of the effect of detergent versus hypochlorite cleaning on environmental contamination and incidence of Clostridium difficile infection. J Hosp. Infect. 54(2):109–114 (2003).
- Denton, M. et al.: Role of environmental cleaning in controlling an outbreak of Acinetobacter baumannii on a neurosurgical intensive care unit. J Hosp. Infect. 56(2):106–110 (2004).
- Baran, G. et al.: Risk factors for nosocomial imipenem resistant Acinetobacter baumannii infections. Int. J Infect. Dis. 12(1):16–21 (2008).
- APIC: Guide to the Elimination of Multidrug-resistant Acinetobacter baumannii Transmission in Healthcare Settings. Washington, D.C.: APIC Headquarters, 2010. págs. 1–58.
- Wikswo, M.E., A.J. Hall: Outbreaks of acute gastroenteritis transmitted by person-to-person contact – United States, 2009–2010. MMWR Surveill Summ. 61(9):1–12 (2012).
- Gupta, N., B.M. Limbago, J.B. Patel, A.J. Kallen: Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention. Clin. Infect. Dis. 53(1):60–67 (2011).
- CDC: Guidance for control of infections with carbapenem-resistant or carbapenemase-producing Enterobacteriaceae in acute care facilities. MMWR Morb. Mortal. Wkly. Rep. 58(10):256–260 (2009).
- Correa, L. et al.: A hospital-based matched case-control study to identify clinical outcome and risk factors associated with carbapenem-resistant Klebsiella pneumoniae infection. BMC Infect. Dis. 13:80 (2013). doi:https://doi.org/10.1186/1471-2334-13-80.:80-13
- Stewart, D.B., C.S. Hollenbeak: Clostridium difficile colitis: factors associated with outcome and assessment of mortality at a national level. J. Gastrointest. Surg. 15(9):1548–1555 (2011).
- Duckro, A.N., D.W. Blom, E.A. Lyle, R.A. Weinstein, M.K. Hayden: Transfer of vancomycin-resistant enterococci via health care worker hands. Arch. Intern. Med. 165(3):302–307 (2005).
- de Lassence, A. et al.: Control and outcome of a large outbreak of colonization and infection with glycopeptide-intermediate Staphylococcus aureus in an intensive care unit. Clin. Infect. Dis. 42(2):170–178 (2006).
- CDC: Guidelines for Environmental Infection Control in Health-Care Facilities: Recommendations of the CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR 52 (No. RR-10), 6-6-2003. Atlanta, GA: Centers for Disease Control and Prevention (CDC), 2003. págs. 1–48.
- Boyce, J.M., G. Potter-Bynoe, C. Chenevert, T. King: Environmental contamination due to methicillin-resistant Staphylococcus aureus: possible infection control implications. Infect. Control Hosp. Epidemiol. 18(9):622–627 (1997).
- Catalano, M., L.S. Quelle, P.E. Jeric, M.A. Di, S.M. Maimone: Survival of Acinetobacter baumannii on bed rails during an outbreak and during sporadic cases. J. Hosp. Infect. 42(1):27–35 (1999).
- Wu, H.M. et al.: A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control Hosp. Epidemiol. 26(10):802–810 (2005).
- Kuijper, E.J., B. Coignard, P. Tull: Emergence of Clostridium difficile-associated disease in North America and Europe. Clin. Microbiol. Infect. 12(Suppl 6):2-18–2-18 (2006).
- Huang, S.S., R. Datta, R. Platt: Risk of acquiring antibiotic-resistant bacteria from prior room occupants. Arch. Intern. Med. 166(18):1945–1951 (2006).
- Huang, R., S. Mehta, D. Weed, C.S. Price: Methicillin-resistant Staphylococcus aureus survival on hospital fomites. Infect. Control Hosp. Epidemiol. 27(11):1267–1269 (2006).
- Sexton, T., P. Clarke, E. O’Neill, T. Dillane, H. Humphreys: Environmental reservoirs of methicillin- resistant Staphylococcus aureus in isolation rooms: correlation with patient isolates and implications for hospital hygiene. J. Hosp. Infect. 62(2):187–194 (2006).
- Boyce, J.M.: Environmental contamination makes an important contribution to hospital infection. J. Hosp. Infect. 65(Suppl 2):50-4–50-54 (2007).
- Boyce, J.M. et al.: Impact of hydrogen peroxide vapor room decontamination on Clostridium difficile environmental contamination and transmission in a healthcare setting. Infect. Control Hosp. Epidemiol. 29(8):723–729 (2008).
- Weaver, L., H.T. Michels, C.W. Keevil: Survival of Clostridium difficile on copper and steel: futuristic options for hospital hygiene. J. Hosp. Infect. 68(2):145–151 (2008).
- Drees, M. et al.: Prior environmental contamination increases the risk of acquisition of vancomycin-resistant enterococci. Clin. Infect. Dis. 46(5):678–685 (2008).
- Barbut, F., D. Menuet, M. Verachten, E. Girou: Comparison of the efficacy of a hydrogen peroxide dry mist disinfection system and sodium hypochlorite solution for eradication of Clostridium difficile spores. Infect. Control Hosp. Epidemiol. 30(6):507–514 (2009).
- Lu, P.L. et al.: Methicillin-resistant Staphylococcus aureus and Acinetobacter baumannii on computer interface surfaces of hospital wards and association with clinical isolates. BMC Infect. Dis. 9:164 (2009).
- Wendt, C., B. Dietze, E. Dietz, H. Ruden: Survival of Acinetobacter baumannii on dry surfaces. J Clin. Microbiol. 35(6):1394–1397 (1997).
- Wagenvoort, J.H., W. Sluijsmans, R.J. Penders: Better environmental survival of outbreak vs. sporadic MRSA isolates. J. Hosp. Infect. 45(3):231–234 (2000).
- French, G.L., Otter, J.A., Shannon, K.P., Adams, N.M., Watling, D., Parks, M.J.: Tackling contamination of the hospital environment by methicillin-resistant Staphylococcus aureus (MRSA): a comparison between conventional terminal cleaning and hydrogen peroxide vapour decontamination. J. Hosp. Infect. 57(1):31–37 (2004).
- Kramer, A., I. Schwebke, G. Kampf: How long do nosocomial pathogens persist on inanimate surfaces? A systematic review. BMC Infect. Dis. 6:130 (2006).
- Wheeldon, L.J., Worthington, T., Lambert, P.A., Hilton, A.C., Lowden, C.J., Elliott, T.S.: Antimicrobial efficacy of copper surfaces against spores and vegetative cells of Clostridium difficile: the germination theory. J. Antimicrob. Chemother. 62(3):522–525 (2008).
- Kim, K.H. et al.: Isolation of Clostridium difficile from the environment and contacts of patients with antibiotic-associated colitis. J. Infect. Dis. 143(1): 42–50 (1981).
- Snyder, G.M. et al.: Detection of methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococci on the gowns and gloves of healthcare workers. Infect. Control Hosp. Epidemiol. 29(7):583–589 (2008).
- Fijan, S., and S.S. Turk: Hospital textiles, are they a possible vehicle for healthcare-associated infections? Int. J. Environ. Res. Public Health. 9(9):3330–3343 (2012).
- Jawad, A., H. Seifert, A.M. Snelling, J. Heritage, P.M. Hawkey: Survival of Acinetobacter baumannii on dry surfaces: comparison of outbreak and sporadic isolates. J. Clin. Microbiol. 36(7):1938–1941 (1998).
- Akerlund, T. et al.: Increased sporulation rate of epidemic Clostridium difficile Type 027/NAP1. J. Clin. Microbiol. 46(4):1530–1533 (2008).
- Cohen, B., S. Hyman, L. Rosenberg, and E. Larson: Frequency of patient contact with health care personnel and visitors: implications for infection prevention. Jt. Comm J. Qual. Patient. Saf. 38(12):560–565 (2012).
- Weese, J.S., T. Lowe, M. Walker: Use of fluorescent tagging for assessment of environmental cleaning and disinfection in a veterinary hospital. Vet. Rec. 171(9):217 (2012).
- Lau, J., W. Bahnfleth, R. Mistrick, D. Kompare: Ultraviolet irradiance measurement and modeling for evaluating the effectiveness of in-duct ultraviolet germicidal irradiation devices. HVAC&R Res. 18(4):626–642 (2012).
- Rudnick, S.N., M.W. First, R.L. Vincent, P.W. Brickner: In-place testing of in-duct ultraviolet germicidal irradiation. HVAC&R Res. 15(3):525–535 (2009).
- Rudnick, S.N., and M.W. First: Fundamental factors affecting upper-room ultraviolet germicidal irradiation – part II. Predicting effectiveness. J. Occup. Environ Hyg. 4(5):352–362 (2007).
- Chang, D., and C. Young: Effect of turbulence on ultraviolet germicidal irradiation. J. Arch. Eng. 13(3):152–161 (2007).
- Jelden, K.C. et al.: Comparison of hospital room surface disinfection using a novel ultraviolet germicidal irradiation (UVGI) generator. J. Occup. Environ. Hyg. 13(9) (2016). doi:https://doi.org/10.1080/15459624.2016.1166369
- Anderson, D.J. et al.: Decontamination of targeted pathogens from patient rooms using an automated ultraviolet C emitting device. Infect. Control Hosp. Epidemiol. 34(5):466–471 (2013).
- Nerandzic, M.M., J.L. Cadnum, K.E. Eckart, C.J. Donskey: Evaluation of a hand-held far-ultraviolet radiation device for decontamination of Clostridium difficile and other healthcare-associated pathogens. BMC Infect. Dis. 12:120 (2012). doi:https://doi.org/10.1186/1471-2334-12-120.
- Moore, G. et al.: Use of UV-C radiation to disinfect non-critical patient care items: a laboratory assessment of the Nanoclave Cabinet. BMC Infect. Dis. 12:174 (2012).
- Jinadatha, C. et al.: Evaluation of a pulsed-xenon ultraviolet room disinfection device for impact on contamination levels of methicillin-resistant Staphylococcus aureus. BMC Infect. Dis. 14:187 (2014).
- Pal, S. et al.: Mobile phones: reservoirs for the transmission of nosocomial pathogens. Adv. Biomed. Res. 4:144 (2015).
- Riley, R.L., and J.E. Kaufman: Effect of relative humidity on the inactivation of airborne Serratia marcescens by ultraviolet radiation. Appl. Microbiol. 23(6):1113–1120 (1972).
- Kim, J.K., V.G. Petin, and I.I. Morozov: Quantitative evaluation of the parameters of bacterial photoreactivation after exposure to ultraviolet light and ionizing radiation. Int. J. Radiat. Biol. 81(1):55–62 (2005).
- Quek, P.H., and J. Hu: Influence of photoreactivating light intensity and incubation temperature on photoreactivation of Escherichia coli following LP and MP UV disinfection. J. Appl. Microbiol. 105(1):124–133 (2008).
- McDevitt, J.J., S.N. Rudnick, and L.J. Radonovich: Aerosol susceptibility of influenza virus to UV-C light. Appl. Environ. Microbiol. 78(6):1666–1669 (2012).
- ACGIH: TLVs and BEIs. American Conference of Governmental Industrial Hygienists: Cincinnati, OH, 2016.
- Bauermeister, A., R. Moeller, G. Reitz, S. Sommer, P. Rettberg: Effect of relative humidity on Deinococcus radiodurans’ resistance to prolonged desiccation, heat, ionizing, germicidal, and environmentally relevant UV radiation. Microb. Ecol. 61(3):715–722 (2011).