ABSTRACT
Estudiamos la diversidad de murciélagos en cinco diferentes coberturas vegetales del Caribe hondureño y nicaragüense: bosque maduro (BM), bosque secundario (BS), bosque ripario (BR), tacotales o guamiles (TG) y áreas abiertas (HA); determinando aspectos ecológicos y de conservación para todo el paisaje. Realizamos un esfuerzo de muestreo de 1.362 horas/red durante el cual se capturaron 2.170 individuos pertenecientes a 57 especies que representan el 39,3% de las especies de murciélagos centroamericanos. La zona evaluada presenta una alta variedad de ecosistemas, que albergan especies propias del Caribe centroamericano, incluyendo especies en riesgo como el murciélago blanco hondureño, Ectophylla alba, catalogada en ambos países como “amenazada” y a nivel mundial como “casi amenazada”. Las coberturas de BM presentaron la mayor riqueza de especies con 41, seguido del BS y el BR con 31 especies cadauna. Las coberturas de TG con 26 especies, y HA con 19 fueron las de menor riqueza. Esto es evidencia de la importancia de las coberturas de bosques maduros para conservar comunidades de murciélagos poco comunes o ausentes en hábitats muy fragmentados de Centroamérica.
Introducción
Centroamérica comprende fisiográficamente las latitudes medias de América, desde el istmo de Tehuantepec en México hasta el istmo de Panamá, con el océano Pacífico al oeste y el mar Caribe al este. La superficie terrestre centroamericana asciende desde la región costera del océano Pacífico a las crestas de la Cordillera Central y desciende gradualmente hacia la costa del mar Caribe, la cual se extiende desde Belice hasta Panamá con aproximadamente 2.740 kilómetros de longitud. El Caribe centroamericano incluye las zonas con mayor precipitación en Centroamérica, que supera en algunos casos los 6.000 mm por año y determina en gran medida la cobertura vegetal que caracteriza el área [Citation1].
Debido a estas características y su origen geográfico, Centroamérica posee una mezcla de especies de murciélagos de origen Neártico (provenientes de Norteamérica) y de origen Neotropical (provenientes de Suramérica), con 32 especies endémicas para la región [Citation2]. La diversidad de murciélagos en Guatemala, Honduras, El Salvador, Nicaragua, y Costa Rica alberga 145 especies, 9 familias y 66 géneros [Citation3–8], esto constituye el 10,31% de la riqueza mundial, y debido a ello Centroamérica es considerada una de las regiones con mayor cantidad de géneros de murciélagos en el mundo [Citation5,Citation8]. Turcios-Casco et al. [Citation4] mencionan una riqueza de 113 especies de murciélagos en Honduras, y Medina-Fitoria & Martínez-Fonseca [Citation6] y Saldaña Tapia et al. [Citation7] refieren 111 para Nicaragua. Ambos países suman una diversidad de 129 especies, de las cuales aproximadamente 95 son compartidas.
Por su importancia ecológica en los ecosistemas, la evaluación de poblaciones de murciélagos es esencial en la valoración de áreas para conservación, especialmente en bosques húmedos. Esto contribuye en la identificación de tipos de coberturas o sitios prioritarios para la investigación, cuyos datos a través del tiempo aportan al desarrollo de estrategias de manejo ante cambios eventuales en el ecosistema, principalmente cuando se requiere conservar especies amenazadas [Citation9]. Por lo que en un sistema complejo como es el Caribe centroamericano, donde las afectaciones humanas son cada vez mayores (e.g. ganadería extensiva, narco-actividades, cultivo de especies exóticas), es una necesidad conocer aspectos básicos del uso del hábitat, que determinen sitios o coberturas vegetales de mayor interés para la conservación y/o restauración.
No obstante, para lograr estos objetivos, es necesario llenar vacíos de información que presentan grupos esenciales (e.g. murciélagos) en esta parte de Centroamérica, destacando el poco conocimiento sobre el estado de conservación o situación poblacional de la mayoría de las especies de murciélagos. En este contexto, y como línea base para priorizar estrategias de conservación en el área de estudio, caracterizamos las comunidades de murciélagos en el Caribe de Honduras y Nicaragua de acuerdo con el tipo de cobertura vegetal, determinando aspectos biológicos y ecológicos de las especies. Finalmente, actualizamos las ocurrencias de especies relevantes en ambos países, que en algunos casos representan nuevos registros de distribución o confirman su presencia después de muchos años de no ser reportadas.
Métodos
Área de estudio
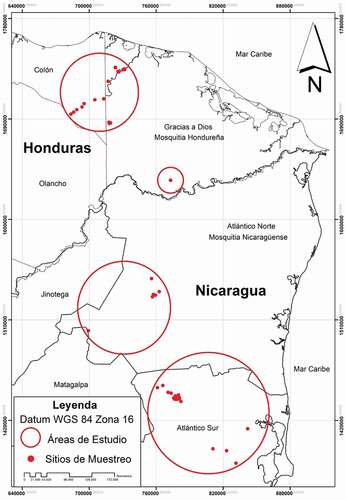
Estudiamos murciélagos desde los departamentos de Colón, Gracias a Dios y Olancho en Honduras, hasta la Laguna de Perlas y la cuenca baja del Río Grande de Matagalpa en la Región Autónoma del Caribe Sur (RACS) de Nicaragua (). El área comprende las cuencas del Río Tinto-Negro, Río Plátano, Río Patuca, Río Coco o Segovia (cuenca compartida por ambos países), Río Prinzapolka, Río Kukalaya, Río Grande de Matagalpa, y Río Kurinwas [Citation1,Citation10,Citation11].
Figura 1. Área de estudio y sitios de muestreo en el Caribe de Honduras y Nicaragua. Las 68 localidades se describen de forma específica en el Apéndice 1
Considerando a los sistemas de las zonas de vida de Holdridge [Citation10] y de la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (con sus siglas en inglés UNESCO), el Caribe centroamericano se ubica en la zona tropical del hemisferio norte, con una región tropical que se extiende desde Panamá hasta el norte de Nicaragua, continuando con una región subtropical desde Guatemala hasta Belice. El ecosistema de mayor cobertura en el área de estudio es el muy húmedo subtropical caliente que abarca áreas por debajo de los 500 msnm (metros sobre el nivel del mar), desde el Caribe norte de Nicaragua hasta Belice; incluyendo todo el Caribe hondureño. Este tipo de ambiente cubre el 22,6% del territorio Centroamericano (117,240 km2) y se distribuye en un rango de temperatura de 22–28ºC, con precipitaciones anuales entre 2.500 y 4.100 mm. En la actualidad su cobertura se ha reducido a un 51% debido a la deforestación, por lo que se encuentran en estado de peligro. La principal formación natural de este ecosistema es el bosque húmedo, el cual en su estado natural está compuesto por árboles con diámetros superiores a los 100 cm [Citation12].
Muestreo
Evaluamos cinco coberturas vegetales en el noreste del Caribe hondureño y nicaragüense, haciendo uso de la clasificación propuesta para la evaluación biológica de paisajes fragmentados en Centroamérica (proyecto Fragment 2002–2005). La cual fue diseñada a través de la fotointerpretación por la Universidad de Göttingen y el Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), y ha sido utilizada en los estudios de murciélagos en paisajes fragmentados de bosques húmedos de Nicaragua y Costa Rica [Citation13–15].
Con base en la clasificación anterior, definimos cinco coberturas vegetales de acuerdo a las siguientes características: (1) bosque maduro (BM): cobertura vegetal con al menos dos estratos definidos, dosel mayor a 20 m y con árboles emergentes; (2) bosque ripario (BR): con vegetación boscosa influenciada directamente por ríos perennes a 10 m en ambos lados del cauce del río y con dosel mínimo de 10 m; (3) bosque secundario (BS): cobertura vegetal sin estratos definidos con altura de dosel entre 10 y 20 m; (4) tacotales o guamiles (TG): cobertura vegetal con altura promedio entre 3 y 9 m; y (5) hábitat abierto (HA): compuesto de agroecosistemas; y pastizales con árboles dispersos (cobertura arbórea no mayor al 20%).
En cada uno de los sitios, estudiamos la comunidad de murciélagos utilizando de cuatro a ocho redes de niebla de medida estándar (12 x 2.5 m) con ojo de malla de 35 mm. Seguimos a Kunz & Kurta [Citation16] para la posición y colocación de las redes de acuerdo con la vegetación, topografía y cuerpos de agua. Realizamos esfuerzos de muestreos de cuatro a 20 horas/red por noche, entre las 17:30 y 02:00 h, y definimos una hora/red como la unidad de esfuerzo según Ralph et al. [Citation17].
El tiempo en el que las redes permanecieron abiertas fue determinado de acuerdo con las condiciones climáticas, por lo que no todos los tipos de coberturas presentan el mismo esfuerzo de muestreo, logrando acumular un mínimo de 122 horas/red y un máximo de 674 horas/red en las diferentes coberturas. Adicionalmente, realizamos caminatas diurnas por los senderos cercanos a los puntos de muestreo para la búsqueda e identificación de colonias y/o refugios de murciélagos.
Identificación taxonómica
Seguimos a Timm et al. [Citation18], Medellín et al. [Citation19], Reid [Citation20] y Medina-Fitoria [Citation21] para la identificación de especies. Todas las medidas morfológicas fueron tomadas en vida, utilizando un calibrador Mitutoyo (506–675) con precisión de 0.01 mm, y la masa corporal se tomó con pesolas de 10, 50, 100 o 300 g, dependiendo del tamaño del murciélago. Utilizamos un lente de aumento de 10x para confirmar características morfométricas o morfológicas (por ejemplo: ausencia o número de incisivos, o coloración de las bandas en el pelaje). Consideramos a Kunz et al. [Citation22] para determinar el sexo, la edad biológica (juvenil o adulto) y el estado reproductivo (hembras preñadas o lactantes y machos escrotados).
Se sacrificaron y recolectaron sólo a los individuos cuyos registros eran importantes para el área de estudio, según las pautas de la Sociedad Americana de Mastozoología para el uso de mamíferos silvestres en investigaciones [Citation23]. Para ello se utilizaron los permisos correspondientes de colecta extendidos por el Ministerio del Ambiente de Nicaragua (autorización de investigación científica DGB–IC), y del Instituto Nacional de Conservación y Desarrollo Forestal, Áreas Protegidas y Vida Silvestre (ICF) de Honduras (permiso de investigación y de colecta DE–MP–064–2017). Las muestras se prepararon según los métodos convencionales de Rabinowitz et al. [Citation24] y Kingston [Citation25], y fueron depositadas en el Museo de Zoología de Nicaragua, en la colección de zoología de la Escuela Agrícola Panamericana (EAP) de Honduras, y en el Museo de Historia Natural “Biodiversidad y Ciencia” de la Universidad Nacional Autónoma de Honduras en el Valle de Sula (UNAH-VS).
Seguimos a Baker et al. [Citation26] para la clasificación de la familia Phyllostomidae con algunas modificaciones a propuestas más recientes: aceptamos al género Gardnerycteris para la especie G. keenani [Citation27] y Mimon para M. cozumelae [Citation28]. Consideramos al género Tonatia para la especie T. bakeri [Citation29], y Lophostoma para las especies L. brasiliense, L. evotis y L. silvicolum [Citation30,Citation31]. Reconocemos al género Dermanura como un género diferenciado de Artibeus [Citation32,Citation33], y Vampyriscus de Vampyressa para la especie V. nymphaea [Citation34]. Aceptamos los cambios del género Uroderma [Citation35], considerando para este estudio a la especie U. convexum, los cambios del género Sturnira [Citation36], y del género Vampyrodes reconocemos a V. major [Citation37]. También los cambios propuestos para el género Pteronotus [Citation38,Citation39]. Debido a que la mayoría de los registros fueron previamente a los nuevos arreglos taxonómicos del género Rhogeessa propuestos por Baird et al. [Citation40,Citation41], no reconocemos los cambios de este género para este estudio por lo que consideramos a la especie R. tumida para toda el área de estudio. Reconocemos los cambios para Myotis pilosatibialis como la especie válida para Honduras y Nicaragua [Citation42].
Análisis de datos
Determinamos el número de especies de murciélagos, el número de individuos por especie y el esfuerzo de muestreo para toda el área de estudio y por tipo de cobertura vegetal. Con los resultados del esfuerzo de muestreo y la cantidad de individuos, calculamos tasas de capturas expresadas como el número de individuos capturados por hora/red [Citation43].
Estimamos el número de especies esperadas con el programa estadístico EstimateSMac 910 con 100 aleatorizaciones [Citation44–46], y como resultado se muestran curvas de acumulación de especies utilizando los índices de Chao 1, Chao 2, ACE y Bootstrap, así como curvas de rango-abundancia de cada especie según los cinco tipos de cobertura vegetal. La diversidad fue estimada con base al Índice de Diversidad Verdadera para toda el área de estudio, siguiendo a García-Morales et al. [Citation47] y Moreno et al. [Citation48], por medio del exponencial del índice de entropía de Shannon [Citation49].
Comparamos la riqueza de especies entre tipos de cobertura vegetal realizando curvas de rarefacción, tomando en cuenta la media del número de especies a través de submuestras repetidas al azar con intervalos de confianza de 1.000 interacciones [Citation50]. Además, elaboramos un clúster de similitud de Jaccard para comparar la composición de especies entre los tipos de cobertura vegetal [Citation51]. Para ambos análisis utilizamos el Programa BioDiversity bdpro32 versión 2 [Citation52].
Las especies fueron clasificadas según su gremio trófico: frugívoros, nectarívoros, hematófagos, omnívoros, carnívoros e insectívoros [Citation20,Citation53]. También por su estado de conservación, según la lista roja global de fauna silvestre de la Unión Internacional para la Conservación de la Naturaleza (UICN), y las listas rojas nacionales de murciélagos de Honduras y Nicaragua (hechas por los Programas de Conservación de Murciélagos de ambos países [Citation54–56]). Finalmente por su dependencia de hábitat, en especies típicas o dependientes del bosque húmedo tropical [Citation2,Citation20,Citation21]. Con base en la clasificación anterior y los nuevos registros, determinamos las especies prioritarias para su conservación.
Por último, realizamos una exhaustiva revisión bibliográfica referente a los murciélagos de esta región, con lo cual logramos actualizar la distribución de algunas especies. Comenzamos con una búsqueda de literatura empleando los siguientes términos clave en el motor de búsqueda de Google Académico: murciélagos + Nicaragua/Honduras + Caribe/La Mosquitia. También se incluyeron algunas frases adicionales, menos sistemáticas pero relacionadas (e.g. registros + mamíferos voladores + Chiroptera). Todas las publicaciones de la búsqueda fueron revisadas y leídas cuidadosamente para separar, recopilar y analizar aquellas que mencionan a los murciélagos de la región. Adicionalmente, consultamos los sitios web de museos norteamericanos con colecciones de murciélagos de Honduras o Nicaragua; esto incluyó revisar informes y bases de datos de Global Biodiversity Information Facility (https://www.gbif.org), University of Kansas Biodiversity Institute (https://biodiversity.ku.edu/), Museum of Texas Tech University (http://www.nsrl.ttu.edu/search/index.htm), American Museum of Natural History (https://www.amnh.org/) y Museum of Comparative Zoology, Harvard University (https://mczbase.mcz.harvard.edu/).
Resultados
Entre 2003 y 2018 estudiamos 68 sitios en el Caribe de Honduras y Nicaragua, con 34 sitios de muestreo por país (Apéndice 1), y un esfuerzo de muestreo total de 1.362 horas/red. El 67% del esfuerzo fue consignado a la época lluviosa y el 33% a la época seca. Todos los meses fueron muestreados a excepción de julio y diciembre, siendo septiembre el mes en el cual se registró la mayor cantidad de capturas, con el 43,6% del total de individuos. El 73% de los individuos fueron capturados en época lluviosa y el 27% en época seca.
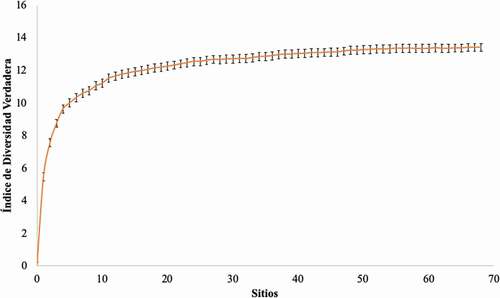
Contabilizamos 2.170 individuos (58,3% hembras y 41,7% machos), con una tasa de captura de 1.6 individuos por hora/red. Estos pertenecen a siete familias, 40 géneros y 57 especies (Apéndice 2), los cuales representan el 60,6% de géneros y el 39,3% del total de especies para Centroamérica. Las estimaciones con relación a las especies capturadas señalan que entre el 89,9% y 97,4% de las especies esperadas fueron registradas, considerando Bootstrap (índice estimado más alto) y Chao 1 (índice estimado más bajo), con una riqueza estimada para toda el área de estudio de 58 a 63 especies (). Por lo que el esfuerzo de este trabajo es considerado aceptable, con relación a los estimadores de riqueza de especies y las especies esperadas mayor al 89%. La riqueza de especies encontradas y esperadas sustentan una alta complejidad en la estructura de las comunidades, expresada por un alto valor del Índice de Diversidad Verdadera de 12,81 ().
Figura 2. Curvas de acumulación de especies de murciélagos de acuerdo con la abundancia de las especies en el Caribe de Honduras y Nicaragua
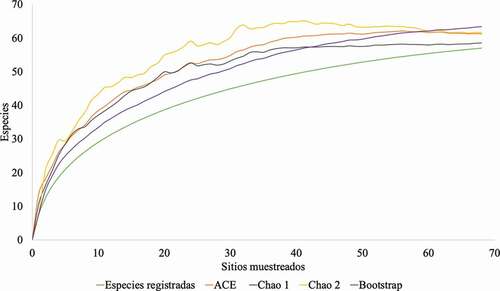
Figura 3. Curva de acumulación del Índice de Diversidad Verdadera con intervalos de confianza al 95% en el Caribe hondureño y nicaragüense, en donde el valor acumulado fue de 12,81
Identificamos a todos los gremios tróficos, siendo los insectívoros los que presentaron la mayor riqueza de especies con 28, seguidos de los frugívoros con 17. Sin embargo, fueron estos últimos los que mostraron la mayor abundancia con 1.827 individuos, representando el 84,1% del total de capturas ().
Tabla 1. Riqueza de especies de murciélagos, número de individuos y porcentajes por gremio trófico y familias en el Caribe de Honduras y Nicaragua
El ensamblaje taxonómico muestra a la familia Phyllostomidae como la de mayor cantidad de especies con 39, y la mayor cantidad de individuos con el 93,1% de las capturas; seguido de Vespertilionidae con siete especies y el 2,5% de los individuos. Mormoopidae, Noctilionidae y Thyropteridae fueron representadas por una sola especie y reúnen el 2,3% de las capturas ().
Las cinco especies más abundantes fueron frugívoras (Phyllostomidae) y agrupan el 67,1% del total de individuos. La más común fue Carollia perspicillata con el 31,9% de las capturas, seguida de Artibeus jamaicensis con el 12,1%, C. sowelli con el 9,0%, A. lituratus con el 7,7%, y Dermanura watsoni con el 6,4%. No obstante, siete especies fueron representadas por un individuo, Bauerus dubiaquercus (Vespertilionidae), Cormura brevirostris (Emballonuridae), Molossus alvarezi (Molossidae); y cuatro especies de Phyllostomidae: Glossophaga leachii, Micronycteris hirsuta, Vampyrodes major y Trachops cirrhosus (Apéndice 2).
Diez especies son típicas de las tierras bajas caribeñas, Chiroderma gorgasi, Cormura brevirostris, Cyttarops alecto, Ectophylla alba, Gardnerycteris keenani, Hylonycteris underwoodi, Mimon cozumelae, Molossus bondae, Thyroptera tricolor y Vampyriscus nymphaea. Siete especies presentan límites de distribución mundial en el área de estudio, C. gorgasi, E. alba, Lophostoma evotis, M. bondae y V. nymphaea, alcanzan su límite en el Caribe de Honduras, mientras que C. brevirostris y C. alecto se presentan hasta el Caribe de Nicaragua [Citation2,Citation20,Citation21,Citation53,Citation57,Citation58].
El estatus de conservación de las especies indica que Bauerus dubiaquercus, Mimon cozumelae, Ectophylla alba, Hylonycteris underwoodi y Phylloderma stenops se encuentran en listas rojas de especies amenazadas, ya sea a nivel mundial según la UICN [Citation54] o a nivel nacional según los programas de conservación de murciélagos de ambos países [Citation5,Citation55,Citation56]. Estas especies agrupan el 0,97% del total de individuos capturados, siendo el BM la cobertura con la mayor cantidad de individuos amenazados, con el 61,9% (, Apéndice 2).
Tabla 2. Especies en riesgo y uso de hábitat en el Caribe de Honduras y Nicaragua de acuerdo con las listas rojas de la UICN y comentarios de iniciativas nacionales
Aspectos reproductivos
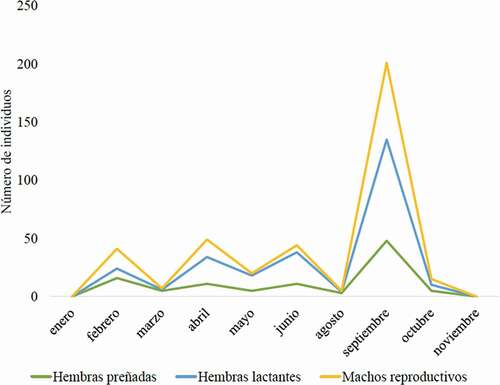
Un total de 383 individuos (17,6%) de 30 especies se encontraron en estado reproductivo, contabilizando 115 machos sexualmente activos y 268 hembras, de las cuales 105 estaban preñadas y 163 lactando. La especie C. perspicillata presentó la mayor cantidad de individuos activos, con el 30,0% del total ().
Tabla 3. Especies y número de individuos de murciélagos en estado reproductivo (hembras preñadas o lactando, y machos sexualmente activos) en el Caribe de Honduras y Nicaragua
Los individuos reproductivos se registraron entre febrero y octubre (excepto julio), con un pico muy acentuado a finales de la estación lluviosa, siendo septiembre el mes con la mayor cantidad de individuos activos sexualmente, con el 52,5% del total. Una fase reproductiva menos pronunciada, pero más o menos constante, se registró en febrero, abril y junio (desde mediados de la estación seca hasta el comienzo de la época lluviosa). Este comportamiento muestra un patrón estacional, siendo más productivo cuando las precipitaciones son máximas en esta región, y mínimo durante la transición de la época lluviosa a seca, entre noviembre y enero ().
Comparación entre tipos de cobertura vegetal
La riqueza de especies y el número de individuos fue mayor en BM, con 41 especies (72,0%) y 904 individuos (41,6%). Además, presentó la menor tasa de captura con 1,34 individuos por hora/red. Por el contrario, HA fue la cobertura vegetal con la menor cantidad de especies con 19 (33,3%) e individuos con 170 (7,8%); siendo el TG la cobertura que presentó la mayor tasa de captura con 2,19 individuos por hora/red ( y Apéndice 2). Un total de 18 especies fueron registradas en un solo tipo de cobertura, de las cuales 17 fueron exclusivas del BM y BR; por el contrario, un equivalente de 15 especies (26,3%) se encontraron en los cinco tipos de coberturas evaluadas (Apéndice 2).
Tabla 4. Matriz de similitud de la composición de especies de murciélagos entre tipos de coberturas del Caribe de Honduras y Nicaragua, y riqueza de especies, número de individuos y tasas de captura por tipo de cobertura. Para un total de 1.362 hora/red se capturaron 1,6 individuos por hora/red
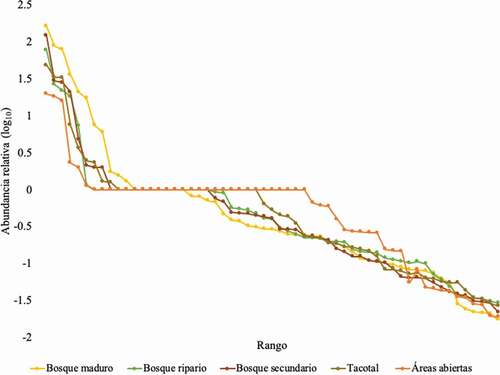
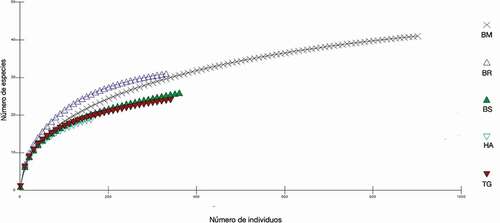
Basado en muestras estándar de individuos para las diferentes coberturas vegetales, las curvas de rarefacción muestran diferencias en los valores de riqueza de especies observadas, principalmente entre las coberturas más conservadas (BM y BR), y alteradas (HA, TG, BS). En este caso no se observa una superposición clara de los intervalos de confianza (95%) en el punto en que las muestras mayores (BM y BR) igualan a la muestra menor (HA). Según el gráfico, las coberturas BS y TG no mostraron mayor diferencia en la riqueza de especies (). La tendencia específica de especies muestra la probabilidad de añadir nuevas especies conforme aumente el muestreo, ya que, aunque las curvas muestran tendencia a la horizontalidad, estas aún no alcanzan la asíntota ().
Figura 5. Clúster de similaridad de Jaccard sobre la composición de especies de murciélagos entre tipos de coberturas del Caribe de Honduras y Nicaragua
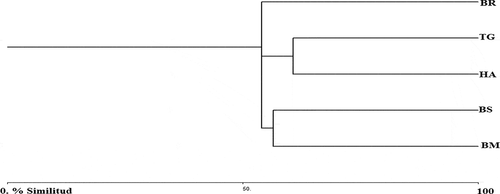
Figura 6. Curvas de rarefacción que presentan la riqueza de especies para una muestra estándar en diferentes coberturas vegetales en el Caribe del noreste de Honduras y Nicaragua
El índice de similitud de Jaccard indica que los tipos de cobertura vegetal presentan una reciprocidad media en cuanto a la composición de especies de murciélagos. Según este análisis, el valor máximo de similitud se encuentra en las coberturas más alteradas, TG y HA, las cuales comparten el 60,71% de su composición de especies. Un segundo grupo es el BS y el BM, compartiendo un 56,52%. Separado del resto, el BR se presenta como la cobertura más disímil en comparación con las otras coberturas ( y ).
Actualización de especies con nuevas localidades en el área de estudio
Cyttarops alecto Thomas, 1913
El registro de esta especie es el más norteño, lo cual representa una ampliación de su rango mundial en aproximadamente 94 km desde su límite conocido en el municipio de Bluefields en el Caribe sur de Nicaragua [Citation59], y nunca ha sido registrada en Honduras. Dos individuos (♀ adultas sin evidencia reproductiva) fueron capturados entre 2015 y 2016 en el municipio de la Cruz de Río Grande en el Caribe sur de Nicaragua, representando la quinta localidad de Cyttarops alecto para este país. El primer individuo fue capturado en septiembre de 2015 en la cobertura HA, con predominancia de pastizales a unos 100 metros de un fragmento de BS con un curso de agua permanente (776718, 1438987; 71 msnm). Un segundo individuo (MZN-169) fue capturado en abril de 2016 en la cobertura TG, a la orilla de un pequeño curso de agua permanente (776977, 1439232; 72 msnm), aproximadamente a un kilómetro al norte del reporte anterior [Citation60].
Thyroptera tricolor Spix, 1823
Se confirma la presencia de T. tricolor en ambos países. En Honduras ha sido registrada en Tegucigalpa, departamento de Francisco Morazán [Citation61] y Cortés [Citation62]. Sin embargo, Reid [Citation20] la reporta desde el occidente de Honduras hasta el departamento de Olancho, y Tavares & Mantilla [Citation63] incluyen la misma distribución en el mapa de la especie, pero sin localidades precisas. En febrero de 2017 se registraron dos refugios de esta especie en prefoliaciones de Heliconia rostrata (Heliconiaceae), una de ellas con cinco individuos (718041, 1686640; 250 msnm) y la otra con siete (717993, 1686682; 238 msnm) de los cuales se examinaron a seis debido a que un individuo escapó. Estos registros en la cuenca alta del Río Patuca en el departamento de Gracias a Dios describen la tercera localidad conocida para el país y el primer reporte para el Caribe hondureño representando un nuevo límite de distribución al oriente de Honduras. La primera colonia se registró en la cobertura BM y la otra colonia en BR. Tres individuos fueron recolectados y depositados en el Museo de Historia Natural de “Biodiversidad y Ciencia” de la UNAH (UVS-V-02532, UVS-V-02525, UVS-V-02533). En Nicaragua un individuo (♂ adulto) fue capturado en enero de 2013, en el Caribe norte, municipio de Bonanza (755855, 1546994; 391 msnm) que constituyó la segunda localidad conocida en el país [Citation64]; posteriormente fue capturado en septiembre de 2016 un individuo (♂ adulto) de una colonia de al menos cinco individuos en el Caribe sur, municipio La Cruz de Río Grande (779907, 1439868; 43 msnm), lo cual constituye la primera localidad en el Caribe norte de Nicaragua. Recomendamos ver Medina-Fitoria et al. [Citation64] y Turcios-Casco & Medina-Fitoria [Citation65] para mayor discusión sobre la ocurrencia de T. tricolor.
Hylonycteris underwoodi Thomas, 1903
McCarthy et al. [Citation66] no reportan esta especie para Honduras; Reid [Citation20] la incluye para el país, pero sin localidad precisa. Estrada-Villegas et al. [Citation67] la reportan por primera vez para el noroccidente en el departamento de Cortés, y Mérida & Cruz [Citation68] la reportan para el departamento de Atlántida. Hernández [Citation55] la ubica en los bosques secos del sur del país; Portillo-Reyes et al. [Citation69] la reportan para el departamento de Olancho; y Mora et al. [Citation70] la incluyen en el listado de los murciélagos de Honduras sin mencionar localidades. Sin embargo, ninguno de los autores previamente mencionados confirma la presencia de la especie por medio de algún individuo depositado en alguna colección científica. Confirmamos la presencia de esta especie en el Caribe hondureño (departamento de Gracias a Dios) a través de seis individuos adultos capturados entre junio de 2008 y febrero de 2017 [2008: ♂ adulto, 683640, 1694337 (212 msnm); 2 ♀ adultas y ♂ adulto, 695459, 1703823 (200 msnm); ♀ adultas, 704981, 1707212 (192 msnm); y una ♀ adulta: 2017 (718124, 1686478: 225 msnm)] que fue recolectada y se encuentra en el Museo de Historia Natural de “Biodiversidad y Ciencia” de la UNAH-VS con código de registro: UVS-V-02527. De los seis individuos registrados, cinco fueron capturados en la cobertura BM y uno en BS. Aunque Turcios-Casco & Medina-Fitoria [Citation65] mencionan la confirmación de la especie con la hembra adulta capturada y recolectada en 2017, aquí se proporcionan cinco registros previos que sustentan su distribución en Honduras.
Chiroderma gorgasi Handley, 1960
Su distribución incluye ahora desde Gracias a Dios en el noreste de Honduras y Tortuguero en el noreste de Costa Rica [Citation2], hasta el noroeste de Ecuador, oeste de Colombia y Panamá [Citation71]; no ha sido registrada para Nicaragua [Citation6]. En Centroamérica ha sido registrada en Costa Rica y Panamá [Citation2,Citation18,Citation20,Citation72]. En febrero de 2017, en la cobertura BM se capturaron dos individuos (♂ adultos, 718135, 1686533; 250 msnm) en la cuenca alta del Río Patuca en el departamento de Gracias a Dios, siendo estos los primeros individuos reportados para Honduras, lo cual determina un nuevo límite de distribución a nivel mundial con una ampliación aproximada de 527 km. Uno de estos individuos fue recolectado y se encuentra en el Museo de Historia Natural de “Biodiversidad y Ciencia” de la UNAH-VS con código de registro: UVS-V-02529. Esta especie [Citation73] y Natalus lanatus [Citation4] han sido las únicas reportadas recientemente como nuevas para Honduras, sin embargo, la ocurrencia de C. gorgasi podría representar una población disyunta ya que no se ha registrado en Nicaragua.
Trachops cirrhosus (Spix, 1823)
En Honduras se ha registrado en los departamentos de Lempira (Gracias) [Citation61], Atlántida (Lancetilla) [Citation74], y Cortés (Parque Nacional Cusuco) [Citation67]. Marineros & Martínez [Citation75] la describen para Río Tinto en el departamento de Gracias a Dios, sin embargo, ese registro es en Sico, departamento de Colón, de cuatro individuos recolectados por B. H. Gaskell en 1982. Además, existen otros registros de individuos recolectados en 1967 en Catacamas, departamento de Olancho [Citation76]. En septiembre de 2017 capturamos un ♂ adulto (código de registro: UVS-V-02072) en la cobertura BM, a las 15:00 h en una cueva artificial de aproximadamente 10 metros de profundidad horizontal (la temperatura de la cueva fue 27°C y la humedad relativa de 64%), ubicada en Brus Laguna, departamento de Gracias a Dios (726620, 1732231; 88 msnm). En la cueva también se registró una colonia de más de 200 individuos de C. perspicillata, de los cuales encontramos hembras lactando y machos escrotados. Desde el 2007 no existen registros oficiales, por lo tanto, este registro representa una sexta localidad para el país, y la primera para el departamento de Gracias a Dios.
Lophostoma evotis (Davis & Carter, 1978)
Se confirma una tercera localidad de esta especie para Honduras, la cual fue registrada para este país por Davis & Carter [Citation77], producto de un individuo procedente de Puerto Lempira, departamento de Gracias a Dios. Además, existe un registro de un individuo recolectado por R. D. Bradley en 1991 en Lancetilla, departamento de Atlántida [Citation76]. Desde entonces la especie ha sido mencionada en algunos trabajos [Citation20,Citation55,Citation58,Citation66,Citation70,Citation71,Citation75], pero sin nuevas localidades. Dos individuos (♂ adultos) fueron capturados en junio de 2008 en Río Plátano, en el departamento de Colón (718487, 1686343; 233 msnm), en la cobertura BM. Esta especie no ha sido registrada para Nicaragua y es esperada para el Caribe norte del país [Citation6,Citation21].
Bauerus dubiaquercus (Van Gelder, 1959)
En Nicaragua esta especie ha sido reportada para las montañas altas del norte, y fue reportada por primera vez en Jinotega, con un segundo informe en el cerro Mogotón en Nueva Segovia [Citation21,Citation78]. En septiembre de 2016 en la cobertura BM capturamos a un individuo (♂ adulto) en el Río Grande de Matagalpa, municipio de La Cruz de Río Grande (777121, 1438906; 52 msnm). Este reporte describe la tercera localidad para Nicaragua y la primera para el Caribe nicaragüense. En Honduras esta especie es rara y se conoce únicamente para el occidente del país, en el departamento de Lempira (Parque Nacional Celaque) [Citation79] y Cortés (Parque Nacional Cusuco) [Citation67]. Además, existe el registro de dos individuos recolectados por D. C. Carter en 1967, en Catacamas, departamento de Olancho [Citation76].
Eptesicus brasiliensis (Desmarest, 1819)
En Nicaragua esta especie había sido reportada una sola vez, en la zona central, departamento de Chontales [Citation64]. Tres individuos más han sido capturados entre septiembre de 2015 (♂ adulto) y septiembre de 2016 (♀♀ adultas) en el Río Grande Matagalpa, municipio de La Cruz de Río Grande (777308, 1441889; 58 msnm), uno en la cobertura TG y otro en HA. Estos nuevos reportes describen la segunda localidad para Nicaragua y la primera para el Caribe nicaragüense. En Honduras esta especie es rara y solo se conoce para el sur del país, en el departamento de Choluteca, sin embargo, no hay ningún espécimen depositado en algún museo que confirme su presencia en Honduras [Citation70,Citation80].
Molossus bondae J.A. Allen, 1904
Esta especie presenta su límite septentrional en el área de estudio, en Brus Laguna, departamento de Gracias a Dios, Honduras [Citation57,Citation81,Citation82]; estos reportes son los únicos que se conocen para el país [Citation61,Citation66], además de un registro por R. W. Adams de 1963, en Río Coco, departamento de El Paraíso [Citation76], y dos reportes históricos para Nicaragua en la zona del sureste, en Río San Juan [Citation83] y en Bluefields [Citation81]. De manera que dos individuos capturados en 2017 confirman la especie en ambos países, un primer individuo (♂ adulto) fue capturado en marzo en Nicaragua en el municipio de La Cruz de Río Grande (Río Izica/Apawás: 773367, 1444328; 41 msnm), y amplía el rango de distribución conocido en el Caribe nicaragüense; el segundo individuo (♂ adulto) fue capturado en Honduras en septiembre de 2017 en Ciudad Blanca, en el departamento de Gracias a Dios (718135, 1686887; 300 msnm), lo cual constituye la tercera localidad conocida para este país.
Discusión
La diversidad del área refleja la importancia de la zona en conservar coberturas vegetales típicas del Caribe centroamericano, especialmente los bosques maduros, siendo la complejidad de especies el principal atributo que justifica la conservación del ecosistema muy húmedo subtropical caliente de esta región. Las 57 especies registradas representan casi la mitad de la riqueza descrita para ambos países y un tercio de las especies centroamericanas, con el potencial de conservar más del 50% de las especies para ambos paises. Las predicciones obtenidas en este estudio concuerdan con otras localidades neotropicales de acuerdo al número de especies registradas y el estado de conservación de los ecosistemas [Citation84–87].
De manera general, el paisaje estudiado en el Caribe de Honduras y Nicaragua presenta un ensamblaje básico de murciélagos que contiene todos los gremios tróficos, esenciales en la preservación de los bosques al asegurar procesos vitales como el consumo de insectos, dispersión de semillas y polinización [Citation86]. Las condiciones también permiten ciclos reproductivos congruentes con los patrones de poliestría bimodal propios de murciélagos neotropicales, los cuales en su gran mayoría se reproducen estacionalmente, de modo que los picos coinciden con la abundancia de frutos y flores que básicamente son influenciados por los regímenes de lluvias [Citation88,Citation89].
El ensamblaje de murciélagos en el Caribe de Honduras y Nicaragua conserva una alta diversidad de especies típicas de hábitats poco alterados, registrando más de la cuarta parte de las especies de las subfamilias Glyphonycterinae, Micronycterinae y Phyllostominae que son indicadoras de bajos niveles de perturbación [Citation9,Citation90]. Sin embargo, estas especies presentaron bajas abundancias en el paisaje con menos del 4% de las capturas, y prácticamente no se registraron en las coberturas de HA.
Esto influyó en que coberturas conservadas como el BM y el BR presentaran una mayor riqueza al retener especies típicas del bosque original, aunque muchas de ellas fueron raras en la muestra (registradas en un solo tipo de cobertura). En contraste, coberturas perturbadas como HA y TG, se caracterizaron por especies comunes, principalmente frugívoros de los géneros Carollia, Artibeus y Dermanura (presentes en la mayoría de las coberturas); lo que hizo que las áreas menos conservadas también presentaran el mayor porcentaje de similitud en cuanto a la composición de especies.
Las diferencias muestran un proceso de fragmentación a través del paisaje que ha afectado la presencia y dispersión de especies de murciélagos en algunas áreas, lo que indica que algunas coberturas podrían mostrarse hostiles a algunas de ellas, principalmente para las especies propias del bosque. Según Cuarón [Citation87], los cambios del uso del suelo afectan la disponibilidad de recursos para muchas especies, al disminuir considerablemente los refugios, fuentes de alimentación, la población y finalmente la extinción local de la especie. Al respecto, estudios en la Guyana Francesa han demostrado como el impacto de la deforestación ha disminuido el número de especies de murciélagos, principalmente de Phyllostominae de bosques conservados [Citation91].
Estos indicadores señalan que, aunque el paisaje estudiado en Honduras y Nicaragua aún muestra un ensamblaje básico de murciélagos, éste podría interrumpirse si la fragmentación continúa en la zona; principalmente por la pérdida de ecosistemas. Harvey et al. [Citation92,Citation93], señalan que la fragmentación del paisaje es uno de los principales factores que influye en la abundancia, diversidad y distribución de organismos con capacidades diferentes de dispersión, entre ellos los murciélagos; y estudios en México [Citation9], Nicaragua [Citation13] y Costa Rica [Citation92] demuestran que la cobertura vegetal es una de las variables más importantes para sus poblaciones.
El proceso de fragmentación ha sido documentado en ambos países, lo cual está ligado principalmente a la deforestación que causa el avance de la frontera agrícola y ganadera Según el Ministerio del Ambiente y Recursos Naturales de Nicaragua [Citation94], para finales del siglo pasado, el 74% de las tierras del país ya se encontraban bajo producción agropecuaria, siendo las pasturas la cobertura predominante, extendiéndose cada vez más hasta los pocos remanentes de bosques que quedan en el caribe nicaragüense [Citation95]. Por su parte, en el Caribe de Honduras la pérdida de cobertura vegetal es también la principal amenaza, con el aumento de las coberturas de pasto y cultivos como la palma africana (Elaeis guineensis), las cuales adquieren cada vez más territorio en esta región [Citation96].
Como resultado, los cambios parecen estar dándose de una manera muy rápida en las coberturas naturales del bosque húmedo, que influyen de diversas maneras en los patrones poblacionales de murciélagos, principalmente en su distribución a través del paisaje con respecto al espacio y el tiempo [Citation65,Citation97]. Aunque la magnitud de estos cambios en el Caribe de Honduras y Nicaragua es difícil de estimar aún con los datos disponibles actualmente Es necesario ensayar programas de monitoreo a largo plazo y actividades de conservación integrales en ambos países; que indiquen a futuro patrones cuantitativos de variación en el ecosistema, lo cual es básico para determinar el manejo que requeriría cada tipo de cobertura a diferentes escalas geográficas [Citation97].
Por ejemplo, altas abundancias de especies frugívoras son esenciales para la recuperación de coberturas alteradas a través de la regeneración natural, debido a que estos murciélagos se especializan en la dispersión y polinización de plantas pioneras como son los géneros Cecropia, Piper y Ficus. Según Janzen [Citation98] al menos 68 especies de plantas de crecimiento secundario se han determinado en la dieta de C. perspicillata. Por lo que, la frugivoría tiene un papel importante al garantizar el proceso de reposición de especies arbóreas en la recuperación y sostenibilidad ecológica de los bosques del Neotrópico.
Además, las estrategias de monitoreo deberán dar seguimiento a aquellas especies relevantes con fines de conservación y/o investigación (especies consideradas en riesgo, especies exclusivas del bosque húmedo o especies cuyo límite mundial de distribución es en el área de estudio). En este caso, consideramos relevantes a las especies: Bauerus dubiaquercus, Chiroderma gorgasi, Ectophylla alba, Hylonycteris underwoodi, Lophostoma evotis, Mimon cozumelae, Phylloderma stenops, Thyroptera tricolor y Tonatia bakeri; las cuales recomendamos dar seguimiento a sus poblaciones y refugios (e.g. termiteros para T. bakeri [Citation99]), y se debe considerar su inclusión en un programa específico de conservación que incluya todas las localidades de ambos países, sean estas en áreas protegidas o fuera de ellas [Citation90]. Finalmente, recomendamos la reevaluación de especies consideradas amenazadas en Honduras, ya que hay especies con una mayor prioridad de conservación que no se conocen desde sus registros históricos en el país (e.g. Macrophyllum macrophyllum).
Agradecimientos
Al Museo de Zoología de Nicaragua, al Museo de Historia Natural “Biodiversidad y Ciencia” de la Universidad Nacional Autónoma de Honduras en el Valle de Sula (UNAH-VS) y a la colección de Zoología de la Escuela Agrícola Panamericana (EAP) por recibir especímenes en sus colecciones; al ICF, MARENA, y a Conservation International (CI). Los autores, especialmente DIOM, quieren hacer una dedicatoria especial a Dilcia Teresa Mazier Casaña, quien descansa en paz, y fue un ejemplo a seguir y motivo de inspiración para todos nosotros. Finalmente, agradecemos a Sara Álvarez y a dos revisores anónimos por sus comentarios para mejorar el manuscrito.
Disclosure statement
No potential conflict of interest was reported by the authors.
References
- McKay AA. Geografía de la región centroamericana. Vol. 1. San José (Costa Rica): Coordinación Educativa y Cultural Centroamericana (CECC/SICA); 2008.
- LaVal RK, Rodríguez-H B. Murciélagos de Costa Rica. Santo Domingo de Heredia (Costa Rica): Instituto Nacional de Biodiversidad (INBio); 2002.
- Kraker-Castañeda C, Pérez SG, Cajas-Castillo JO, et al. Lista actualizada de los murciélagos (Mammalia, Chiroptera) de Guatemala. Rev Mex Biodivers. 2016;87:409–416.
- Turcios-Casco MA, Ávila-Palma HD, LaVal RK, et al. A systematic revision of the bats (Chiroptera) of Honduras: an updated checklist with corroboration of historical specimens and new records. Zoosyst Evol. En prensa. 2020;96(2):411–429.
- Rodríguez Herrera B, Sánchez R. Estrategia centroamericana para la conservación de los murciélagos. Vol. 1. San José (Costa Rica): Universidad de Costa Rica; 2015.
- Medina-Fitoria A, Martínez-Fonseca JG. Cronología histórica de la quiropterología en Nicaragua. Revista Mexicana de Mastozoología. 2019;9(2):1–28.
- Saldaña Tapia OA, Ñamendy M, Martínez-Fonseca JG. First record of the lesser long-nosed bat, Leptonycteris yerbabuenae Martínez & Villa-R., 1940 (Chiroptera, Phyllostomidae), in Nicaragua. Check List. 2020;16(2):451–456.
- York HA, Rodríguez-Herrera B, LaVal RK, et al. Field key to the bats of Costa Rica and Nicaragua. J Mammal. 2019;100(6):1726–1749.
- Medellín RA, Equihua M, Amin MA. Bat diversity and abundance as indicators of disturbance in Neotropical rainforests. Conserv Biol. 2000;14(6):1666–1675.
- Holdridge LR. Life zone ecology. San José (Costa Rica): Tropical Science Center; 1967.
- SINIT: Sistema Nacional de Información Territorial [Internet]. Guatemala: Segeplán. Disponible en: Accesado el 05 de noviembre de 2018. http://www.segeplan.gob.gt/nportal/index.php/servicios/sistemas-en-linea/sinit
- Gutiérrez-Espeleta EE, Van Gyseghem CF. Perspectivas de la biodiversidad en Centroamérica 2003: una primera aproximación al análisis de un tema prioritario. San José (Costa Rica): Observatorio del Desarrollo, Universidad de Costa Rica; 2005.
- Medina A, Harvey CA, Sánchez D, et al. Bat diversity and movement in a neotropical agricultural landscape in Matiguás, Nicaragua. Biotropica. 2007;39(1):120–128.
- Medina-Fitoria A, Harvey CA, Sánchez D, et al. Diversidad y composición de chiropteros en un paisaje fragmentado de bosque seco en Rivas, Nicaragua. Encuentro: Revista Académica de la Universidad Centroamericana. 2004;36(68):24–43.
- Montero J, Sáenz JC. Riqueza, abundancia y diversidad de murciélagos en diferentes hábitats y su relación con la forma y el tamaño de fragmentos en una zona de bosque seco tropical de Costa Rica. In: Harvey CA, Sáenz JC, editors. Evaluación y conservación de biodiversidad en paisajes fragmentados de Mesoamérica. Santo Domingo de Heredia (Costa Rica): Instituto Nacional de Biodiversidad (INBio); 2007. p. 393–420.
- Kunz TH, Kurta A. Capture methods and holding devices. In: Kunz TH, editor. Ecological and behavioral methods for the study of bats. Washington DC (USA): Smithsonian Institution Press; 1988. p. 1–28.
- Ralph CJ, Geupel GR, Pyle P, et al. Manual de métodos de campo para el monitoreo de aves terrestres. Albany (USA): Pacific Southwest Research Station – USDA Forest Service; 1996.
- Timm RM, LaVal RK, Rodríguez-H B. Clave de campo para los murciélagos de Costa Rica. Brenesia. 1999;52:1–32.
- Medellín RA, Arita HT, Sánchez Ó. Identificación de los murciélagos de México, clave de campo. Vol. 2. Distrito Federal (México): Universidad Nacional Autónoma de México; 2008.
- Reid FA. A field guide to the mammals of Central America & southeast Mexico. 2nd ed. New York (USA): Oxford University Press; 2009.
- Medina-Fitoria A. Murciélagos de Nicaragua, guía de campo. 1 ed. Managua (Nicaragua): Programa para la Conservación de los Murciélagos de Nicaragua (PCMN) y Ministerio del Ambiente y los Recursos Naturales (MARENA); 2014.
- Kunz TH, Wemmer CD, Hayssen V, et al. Sex, age, and reproductive condition of mammals. In: Wilson DE, Cole FR, Nichols JD editors. Measuring and monitoring biological diversity. Washington DC (USA): Smithsonian Institution Press; 1996. p. 279–290.
- Sikes RS, Thompson TA, Bryan JA. American Society of Mammalogists: raising the standards for ethical and appropriate oversight of wildlife research. J Mammal. 2019;100(3):763–773.
- Rabinowitz A, Hart J, White L. Information from dead animals and their curation. In: White L, Edwards A, editors. Conservation research in the African rain forests: a technical handbook. New York (USA): Wildlife Conservation Society; 2000. p. 191–201.
- Kingston T. Bats. In: Larsen T, editor. Core standardized methods for rapid biological field assessment. Virginia (USA): Conservation International; 2016. p. 59–82.
- Baker RJ, Solari S, Cirranello A, et al. Higher-level classification of phyllostomid bats with a summary of DNA synapomorphies. Acta Chiropter. 2016;18(1):1–38.
- Hurtado N, D’Elía G. Taxonomy of the genus Gardnerycteris (Chiroptera: phyllostomidae). Acta Chiropter. 2018;20(1):99–115.
- Hurtado N, Pacheco V. Análisis filogenético del género Mimon Gray, 1847 (Mammalia, Chiroptera, Phyllostomidae) con la descripción de un nuevo género. Therya. 2014;5(3):75–1791.
- Basantes M, Tinoco N, Velazco PM, et al. Systematics and taxonomy of Tonatia saurophila Koopman & Williams, 1951 (Chiroptera, Phyllostomidae). ZooKeys. 2020;915:59–86.
- Lee TE, Hoofer SR., Van Den Bussche RA. Molecular phylogenetics and taxonomic revision of the genus Tonatia (Chiroptera: Phyllostomidae). J Mammal. 2002;83(1):49–57.
- Porter CA, Hoofer SR, Van Den Bussche RA, et al. Systematics of round-eared bats (Tonatia and Lophostoma) based on nuclear and mitochondrial DNA sequences. J Mammal. 2003;84(3):791–808.
- Hoofer SR, Solari S, Larsen PA, et al. Phylogenetics of the fruit-eating bats (Phyllostomidae: Artibeina) inferred from mitochondrial DNA sequences. Occas Pap Mus Tex Tech Univ. 2008;277:1–15.
- Solari S, Hoofer SR, Larsen PA, et al. Operational criteria for genetically defined species: analysis of the diversification of the small fruit-eating bats, Dermanura (Phyllostomidae: Stenodermatinae). Acta Chiropter. 2009;11(2):279–288.
- Hoofer SR, Baker RJ. Molecular systematics of Vampyressine bats (Phyllostomidae: Stenodermatinae) with comparison of direct and indirect surveys of mitochondrial DNA variation. Mol Phylogenet Evol. 2006;39(2):424–438.
- Mantilla-Meluk H. Defining species and species boundaries in Uroderma (Chiroptera: Phyllostomidae) with a description of a new species. Occas Pap Mus Tex Tech Univ. 2014;325:1–25.
- Velazco PM, Patterson BD. Diversification of the Yellow-shouldered bats, Genus Sturnira (Chiroptera, Phyllostomidae), in the New World tropics. Mol Phylogenet Evol. 2013;68(3):683–698.
- Velazco PM, Simmons NB. Systematics and taxonomy of great striped-faced bats of the Genus Vampyrodes Thomas, 1900 (Chiroptera: Phyllostomidae). Am Mus Novit. 2011;3710(3710):1–35.
- Clare EL, Adams AM, Maya-Simões AZ, et al. Diversification and reproductive isolation: cryptic species in the only New World high-duty cycle bat, Pteronotus parnellii. BMC Evol Biol. 2013;13(26):1–18.
- Pavan AC, Marroig G. Timing and patterns of diversification in the Neotropical bat genus Pteronotus (Mormoopidae). Mol Phylogenet Evol. 2017;108:61–69.
- Baird AB, Marchán-Rivadeneira MR, Pérez SG, et al. Morphological analysis and description of two new species of Rhogeessa (Chiroptera: Vespertilionidae) from the Neotropics. Occas Pap Mus Tex Tech Univ. 2012;307:1–25.
- Baird AB, Hillis DM, Patton JC, et al. Evolutionary history of the genus Rhogeessa (Chiroptera: Vespertilionidae) as revealed by mitochondrial DNA sequences. J Mammal. 2008;89(3):744–754.
- Mantilla-Meluk H, Muñoz-Garay J. Biogeography and taxonomic status of Myotis keaysi pilosatibialis LaVal 1973 (Chiroptera: Vespertilionidae). Zootaxa. 2014;3793(1):60–70.
- Bracamonte JC. Protocolo de muestreo para la estimación de la diversidad de murciélagos con redes de niebla en estudios de ecología. Ecol Austral. 2018;28(2):446–454.
- Colwell RK Statistical estimation of species richness and shared species from sample [Internet]. Versión 9.1.0. USA: EstimateS; 2013. Disponible en: http://viceroy.eeb.uconn.edu/estimates/
- Colwell RK, Coddington JA. Estimating terrestrial biodiversity through extrapolation. Phil Trans R Soc Lond B. 1994;345(1311):101–118.
- Magurran AE. Measuring biological diversity. Oxford (UK): Blackwell Publishing; 2004.
- García-Morales R, Moreno CE, Bello-Gutiérrez J. Renovando las medidas para evaluar la diversidad en comunidades ecológicas: el número de especies efectivas de murciélagos en el sureste de Tabasco, México. Therya. 2011;2(3):205–215.
- Moreno CE, Barragán F, Pineda E, et al. Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Rev Mex Biodivers. 2011;82:1249–1261.
- Jost L. Entropy and diversity. Oikos. 2006;113(2):363–375.
- Kraker-Castañeda C, Cóbar-Carranza AJ. Uso de rarefacción para la comparación de la riqueza de especies: el caso de las aves de sotobosque en la zona de influencia del Parque Nacional Laguna Lachuá, Guatemala. Naturaleza y Desarrollo. 2011;9(1):60–70.
- Magurran AE. Ecological diversity and its measurement. New Jersey (USA): Princeton University Press; 1988.
- McAleece N, Lambshead PJ, Paterson GL, et al. [Internet]. Version 2. Oban (UK): BioDiversity Professssional (bdpro33) Software; 1997. Disponible en: https://www.sams.ac.uk/science/outputs/
- Emmons LH, Feer F. Neotropical rainforest mammals, a field guide. 2nd ed. Chicago (USA): The University of Chicago Press; 1999.
- IUCN. The IUCN Red List of Threatened Species [Internet]. Suiza; 2008. Disponible en: Accesado el 05 de noviembre de 2018. http://www.iucnredlist.org
- Hernández DJ. Programa para la conservación de los murciélagos de Honduras (PCMH). In: Rodríguez-Herrera B, Sánchez R, editors. Estrategia centroamericana para la conservación de los murciélagos. 1 ed. San José (Costa Rica): Universidad de Costa Rica; 2015. p. 41–56.
- Medina-Fitoria A, Saldaña O, Aguirre Y, et al. Lista roja de los murciélagos de Nicaragua y su estado de conservación. Bol Red Latin Car Cons Murc. 2017;8(2):12–20.
- Dolan PG. Systematics of Middle American mastiff bats of the genus Molossus. Spec Publ Mus Tex Tech Univ. 1989;29:1–71.
- Jones JK Jr, Arroyo-Cabrales J, Owen RD. Revised checklist of bat (Chiroptera) of Mexico and Central America. Occas Pap Mus Texas Tech Univ. 1988;120:1–34.
- Baker RJ, Jones JK Jr. Additional records of bats from Nicaragua, with a revised checklist of Chiroptera. Occas Pap Mus Tex Tech Univ. 1975;32:1–13.
- Medina-Fitoria A, Perayre M, Toval N, et al. Distribución de Cyttarops alecto (Chiroptera: emballonuridae) en Nicaragua y un aporte a su distribución mundial. Revista Nicaragüense De Biodiversidad. 2016;5:1–11.
- Goodwin GG. Mammals of Honduras. Bull Am Mus Nat History. 1942;79(2):107–195.
- Hall ER. The mammals of North America. 2nd ed. New York (USA): John Wiley and Sons; 1981.
- Tavares V, Mantilla H Thyroptera tricolor [Internet]. Suiza: IUCN; 2015. Disponible en: Accesado el 03 de marzo de 2017. http://www.iucnredlist.org/details/21879/0
- Medina-Fitoria A, Saldaña O, Martínez JG, et al. Nuevos reportes sobre los murciélagos (Mammalia: chiroptera) de Nicaragua, América Central, con la adición de siete nuevos registros de especies. Mastozool Neotrop. 2015;22(1):43–54.
- Turcios-Casco MA, Medina-Fitoria A. Occurrence of Hylonycteris underwoodi (Chiroptera, Phyllostomidae) and Thyroptera tricolor (Chiroptera, Thyropteridae) in Honduras. Stud Neotrop Fauna Environ. 2019;54(1):69–72.
- McCarthy TJ, Davis WD, Hill JE, et al. Bat (Mammalia: chiroptera) records, early collectors, and faunal lists for northern Central America. Ann Carnegie Mus. 1993;62(3):191–228.
- Estrada-Villegas S, Allen L, García M, et al. Bat assemblage composition and diversity of the Cusuco National Park, Honduras. San Pedro Sula (Honduras): Cusuco National Park; 2007.
- Mérida J, Cruz G. Mamíferos del Parque Nacional Nombre de Dios, con nueve registros para el departamento de Atlántida, Honduras. Cuadernos De Investigación UNED. 2014;6(2):233–237.
- Portillo Reyes HO, Suazo JP, Mejía D, et al. Diversidad y riqueza para tres sitios del bosque de pino-encino en el departamento de Olancho, Honduras. Scientia Hondurensis. 2016;1(3):136–156.
- Mora JM, López LI, Espinal MR, et al. Diversidad y conservación de los murciélagos de Honduras. Vol. 1. Tegucigalpa (Honduras): Master Print S. de R.L.; 2018.
- Lim BK, Loureiro LO, Garbino GST. Cryptic diversity and range extension in the big-eyed bat genus Chiroderma (Chiroptera, Phyllostomidae). Zookeys. 2020;918:41–63.
- Baker RJ, Taddei VA, Hudgeons JL, et al. Systematic relationships within Chiroderma (Chiroptera: Phyllostomidae) based on cytochrome b sequence variation. J Mammal. 1994;75(2):321–327.
- Turcios-Casco MA, Medina-Fitoria A, Estrada-Andino N. Northernmost record of Chiroderma trinitatum (Chiroptera, Phyllostomidae) in Latin America, with distributional comments. Caribb J Sci. 2020;50(1):9–15.
- Valdez R, LaVal R. Records of bats from Honduras and Nicaragua. J Mammal. 1971;52(1):247–250.
- Marineros L, Martínez F. Guía de campo de los mamíferos de Honduras. Vol. 1. Tegucigalpa (Honduras): Instituto Nacional de Ambiente y Desarrollo (INADES); 1998.
- GBIF: Global Biodiversity Information Facility. Occurrence records [Internet]. Denmark. . Disponible en: Accesado el 02 de septiembre de 2019. https://www.gbif.org/occurrence/download/0008417-190813142620410
- Davis WB, Carter DC. A review of the round-eared bats the Tonatia silvicola complex, with descriptions of three new taxa. Occas Pap Mus Tex Tech Univ. 1978;53:1–12.
- Medina-Fitoria A, Saldaña O, McCarthy T, et al. Nuevos reportes y comentarios históricos de murciélagos (Orden Chiroptera) para la fauna de Nicaragua. Biodiversidad Revista Nicaragüense. 2010;2:93–102.
- Cruz GA, López V, Rodríguez S. Primer inventario de mamíferos, reptiles y anfibios del Parque Nacional Celaque. Siguatepeque (Honduras): COHDEFOR; 1994.
- Espinal M, Mora JM. Noteworthy records of Eptesicus brasiliensis (Vespertilionidae) in Honduras. Ceiba. 2012;53(2):77–80.
- Dolan PG, Carter DC. Distributional notes and records for Middle American Chiroptera. J Mammal. 1979;60(3):644–649.
- López-González C, Presley SJ. Taxonomic status of Molossus bondae J. A. Allen, 1904 (Chiroptera: Molossidae), with description of a new subspecies. J Mammal. 2001;82(3):760–774.
- Miller GS Jr. Notes on the bats of the genus Molossus. Proc U S Natl Mus. 1913;46(2013):85–92.
- McNab BK. The structure of tropical bat faunas. Ecology. 1971;52(2):352–358.
- Voss RS, Emmons LH. Mammalian diversity in Neotropical lowland rainforests: a preliminary assessment. Bull Am Mus Nat Hist. 1996;230:1–115.
- Wilcken S, Kalko EKV. Die vielfalt neotropischer fledermäuse. Biol Unserer Zeit. 2004;34(4):230–239.
- Cuarón AD. Effects of land-cover changes on mammals in a Neotropical region: a modeling approach. Conserv Biol. 2000;14(6):1676–1692.
- Bonaccorso FJ. Foraging and reproductive ecology in a Panamanian bat community. Bull Fla State Mus Biol Ser. 1979;24:359–408.
- Fleming TH, Hooper ET, Wilson DE. Three Central American bat comumnities: estructure, reproductive cycles and movement patterns. Ecology. 1972;53(4):653–670.
- Ávila-Palma HD, Turcios-Casco MA, Ordoñez Bautista DJ, et al. First records of Mimon cozumelae Goldman, 1914 (Chiroptera, Phyllostomidae) in the Río Plátano Biosphere Reserve in northeastern Honduras. Check List. 2019;15(6):1113–1118.
- Brosset A, Charles-Dominique P, Cockle A, et al. Bat communities and deforestation in Frech Guiana. Can J Zool. 1996;74(11):1974–1982.
- Harvey CA, Medina A, Sánchez DM, et al. Patterns of animal diversity in different forms of tree cover in agricultural landscapes. Ecol Appl. 2006;16(5):1986–1999.
- Harvey CA, Villanueva C, Villacís J, et al. Contribution of live fences to the ecological integrity of agricultural landscapes in Central America. Agric Ecosyst Environ. 2005;111(1–4):200–230.
- Ministerio del Ambiente y los Recursos Naturales. Biodiversidad en Nicaragua: un estudio de país. 1 ed. Managua (Nicaragua): Ministerio del Ambiente y los Recursos Naturales (MARENA); 1999.
- FAO. Global forest resources assessment. Rome: Food and Agriculture Organization of the United Nations; 2015.
- Escuela Nacional de Ciencias Forestales. Plan de manejo Reserva del Hombre y la Biosfera del Río Plátano (2013–2025). Tegucigalpa (Honduras): Escuela Nacional de Ciencias Forestales (ESNACIFOR); 2013.
- Gaston KJ. The magnitude of global insect species richness. Conserv Biol. 1991;5(3):283–296.
- Janzen D. Historia natural de Costa Rica. Vol. 1. San José (Costa Rica): Universidad de Costa Rica; 1991.
- Turcios-Casco MA, Medina-Fitoria A, Manzanares T, et al. Sobre la distribución de tres especies de murciélagos filostómidos (Chiroptera), con registros adicionales para el Departartamento de Gracias a Dios, Honduras. Graellsia. 2020;76(1):e108.
Appendices
Apéndice 1. Sitios de muestreo en el Caribe de Honduras y Nicaragua, en donde se muestrearon 34 sitios por país (N = 68) desde el 2003 hasta el 2018
Apéndice 2. Familias, especies y cantidad de individuos de murciélagos identificados en el Caribe de Honduras y Nicaragua (2003–2018) por cobertura vegetal y país