ABSTRACT
Knowledge of the ecological requirements, the current extensions, and cover of a species is important for its management conservation, but this information is lacking for many species of Polylepis (ROSACEA). Here we use niche modeling to understand the ecological requirements of two Polylepis species natively found in sympatry within the Huascarán National Park (HNP) (Cordillera Blanca, Peru), Polylepis albicans and P. webebaueri, and produce species distribution maps restricted by forest cover to estimate each species' current cover within the park . Based on presence/absence data collected systematically throughout their local elevational distribution and analyzed using a Canonical Correspondence Analysis (CCA) and generalized linear models (glm), the best models show that P. albicans and P. weberbaueri have different environmental niches and their occupation is maximized at different climatic ranges mainly associated with temperature (annual mean temperature and mean monthly temperature range) and solar radiation during the dry season. P. albicans occupies warmer and drier areas than P. weberbaueri, which leads to a spatial segregation that has implications for the conservation management of each species. However, it is necessary to evaluate if the models described here adequately capture the environmental niche of other populations of P. weberbaueri, or if these could be new species. Our results indicate that within the HNP, the extension of Polylepis forests (~ 24,000 ha; 11,361 ha of P. albicans and 12,627 ha of P. weberbaueri) is significantly greater than that previously reported and confirm that this protected area harbors the greatest extensions of both species in Peru and its proper management is key for their conservation and that of the ecosystems they constitute.
RESUMEN
El conocimiento de los requerimientos ecológicos, y las extensiones y coberturas actuales de una especie es importante para su manejo de conservación, pero para muchas especies de Polylepis (ROSACEA) se carece de esta información. Aquí realizamos un modelamiento de nicho restringido por mapas de cobertura forestal para entender los requerimientos ecológicos y estimar las coberturas actuales de dos especies nativas de este género halladas en simpatría dentro del Parque Nacional Huascarán (Cordillera Blanca, Perú), Polylepis albicans y P. webebaueri. Basados en datos de presencia/ausencia colectados sistemáticamente a lo largo de su distribución elevacional y analizados mediante un Análisis de Correspondencia Canónica (CCA) y modelos lineares generalizados (glm), los mejores modelos muestran que P. albicans y P. weberbaueri poseen nichos ambientales diferentes y su ocupación es maximizada a distintos rangos climáticos principalmente asociados con la temperatura (temperatura media anual y el promedio del rango de temperatura mensual) y la radiación solar durante la época seca. P. albicans ocupa áreas más cálidas y secas que P. weberbaueri, lo cual conlleva a una segregación especial que tiene implicaciones para el manejo de conservación de cada una. Sin embargo, se necesita evaluar si los modelos aquí descritos capturan adecuadamente el nicho ambiental de otras poblaciones de P. weberbaueri, o si se tratase de nuevas especies. Nuestros resultados indican que dentro del PNH, la extensión de bosques de Polylepis (~24,000 ha; 11,361 ha de P. albicans y 12,627 ha de P. weberbaueri) es significativamente mayor a la reportada previamente y confirman que sería el área con mayor extensión de ambas especies en el Perú y la adecuada gestión de esta área natural protegida es clave para su conservación y la de los ecosistemas que conforman.
Introducción
A lo largo de los altos Andes (> 3,500 m) y las Sierras de Córdoba en Argentina, los bosques dominados por plantas del género Polylepis (ROSACEA), son reconocidos como islas de biodiversidad de importancia para la conservación [Citation1,Citation2]. Estos bosques constituyen ecosistemas únicos por la flora y fauna endémica que albergan [Citation3–7] y los diversos servicios ecosistémicos que brindan a poblaciones locales, incluyendo la captación y regulación de agua en las cabeceras de cuencas [Citation8–10], el mantenimiento y regeneración de suelos [Citation8,Citation11] y la captura de carbono [Citation9,Citation12,Citation13], entre otros (e.g. valor cultural) [ver Citation14]. Pese a estas particularidades, los bosques de Polylepis se encuentran amenazados por actividades humanas como incendios provocados [Citation15–17], ganadería [Citation17,Citation18] y tala selectiva [Citation18], causando la degradación y pérdida de cobertura forestal en la mayor parte de su distribución y poniendo en riesgo a muchas especies que dependen de estos bosques [Citation7]. En respuesta, varias iniciativas de conservación y restauración se han desarrollado [Citation19–21] en conjunto con una activa generación de conocimientos teórico-prácticos [Citation21–25].
Un aspecto importante para la conservación y restauración de Polylepis es identificar los requerimientos ecológicos de cada especie, lo cual es clave para un manejo adecuado de las especies nativas a nivel local [Citation22,Citation23]. Con 28–36 especies distribuidas de forma discontinua a lo largo de >5000 km de cordilleras [Citation26], se ha sugerido que varios miembros de este género poseen requerimientos ecológicos específicos (nichos ecológicos diferenciados) asociados con un rango de distribución restringida y variabilidad climática local. Polylepis tarapacana por ejemplo, está distribuida y adaptada a las áridas condiciones climáticas del norte de Chile y Argentina, pero ausente en otros ambientes con mayor disponibilidad de agua y otros recursos [Citation27]. Similarmente, una reciente re-evaluacion taxonómica de 5 especies pertenecientes al complejo taxonómico P. serícea demostró que estas no solo se diferencian morfológicamente, pero en el nicho climático (temperatura y precipitación) que ocupan, incluso al tener otros ambientes disponibles relativamente cercanos [Citation28]. Otras especies parecen tolerar una mayor amplitud de condiciones. Polylepis racemosa, por ejemplo, está ampliamente distribuida en varias poblaciones, muchas de las cuales parecen ser introducidas en distintas partes de los Andes al ser reconocida por su facilidad de prosperar en diversas condiciones climáticas [Citation26,Citation29]. De hecho, P. racemosa ha sido una de las principales especies usadas en agroforestería y reforestación de bosques de Polylepis en Ecuador y Perú, posiblemente desde tiempos Incaicos [Citation30], pese a los aspectos negativos a los que esto puede conllevar, como la pérdida de diversidad genética y un aumento en la hibridación con las especies nativas [Citation22,Citation29]. Sin embargo, los requerimientos ecológicos de las distintas especies de Polylepis aún no están claros, lo cual impide una implementación adecuada de prácticas de conservación y restauración para cada especie de forma individual. Para esto, creemos que es clave ampliar y profundizar el conocimiento sobre la distribución de cada especie de Polylepis a escalas locales y regionales.
Una de las mayores concentraciones de bosques de Polylepis ocurre en la Cordillera Blanca de los Andes centrales de Perú, las cual se encuentra protegida dentro del Parque Nacional Huascarán (PNH) desde 1972. En la Cordillera Blanca se han registrado entre 4 y 6 especies de Polylepis (P. albicans, P. weberbaueri, P. incana, P. racemosa, P. microphylla, P. reticulata) [Citation28,Citation31,Citation32]. Sin embargo, P. albicans (anteriormente P. sericea albicans) y P. weberbaueri dominan los bosques de la Cordillera Blanca y probablemente son las especies nativas de la zona, constituyendo las principales poblaciones de ambas especies en su distribución [Citation28,Citation33]. La conservación de estas dos especies depende, por lo tanto, del manejo y conservación de los bosques naturales dentro del PNH, para lo cual es importante entender los requerimientos ecológicos de cada una. Al respecto, un estudio de la abundancia de plántulas y ocurrencia de adultos en relación con la elevación e irradiación solar sugiere que P. albicans tolera condiciones más cálidas y secas que P. weberbaueri, incluso dentro de un solo valle [Citation34]. Esto sugiere que incluso a escalas de sólo 10–100 metros, las condiciones ambientales pueden estar determinando la estructura y composición de los bosques y son factores importantes para tener en cuenta en las estrategias de conservación y restauración.
Sin embargo, aún hay más por entender sobre la distribución y tolerancias climáticas de ambas especies, no solo desde el punto de vista de su autoecología, sino para mejorar las prácticas de conservación de los bosques bajo protección y manejo del PNH. Como en otras zonas, y para distintas especies de Polylepis, aún se carece de un inventario de la composición de los bosques de Polylepis de la Cordillera Blanca o el PNH. Aunque esta es una pieza importante para evaluar el aporte del PNH en la conservación de las especies de Polylepis, la extensión y compleja topografía de la Cordillera Blanca dificultan este trabajo. Sin embargo, basado en un muestreo sistemático de la ocurrencia de cada especie a lo largo de la elevación, es posible modelar y mapear explícitamente sus nichos ambientales, y así, estimar la extensión dominada por cada una dentro de la cobertura actual de bosques.
En el presente estudio, realizamos este análisis para estimar la distribución y cobertura actual de P. albicans y P. weberbaueri en el PNH. Específicamente: (i) describimos las condiciones ambientales relacionadas con la ocurrencia de ambas especies y (ii) mapeamos la distribución estimada de cada especie dentro de la cobertura boscosa existente basado en el mejor modelo de nicho. En base a lo anterior, proveemos recomendaciones específicas para su conservación y futuros estudios de campo en la zona.
Métodos
Área de estudio
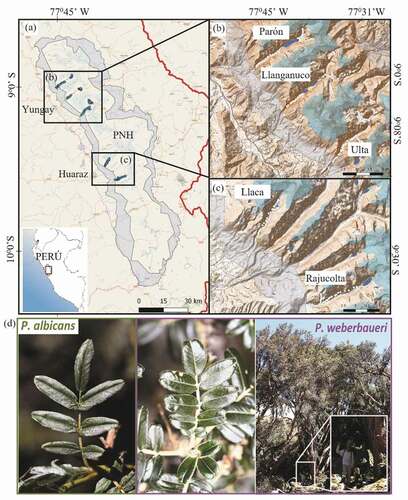
Desarrollamos el estudio en la Cordillera Blanca (Latitud: 8°50’S – 10°40’S; Longitud: 77°07ʹW – 77°49ʹW), localizada en el Departamento de Ancash, Perú (). Considerada la cordillera tropical más alta del mundo (2,400–6,768 m), la Cordillera Blanca está flanqueada por los valles del Callejón de Huaylas (este) y los Conchucos (oeste), donde alrededor de 728,000 habitantes [Citation35] dependen de los servicios ecosistémicos que los glaciares, bosques, pastizales, turberas y otros ecosistemas altoandinos proveen [Citation36]. Desde 1975, las 340,000 ha del PNH protegen la mayoría de esta zona y conforman la zona núcleo de la Reserva de Biosfera Huascarán (RBH), declarada Patrimonio de la Humanidad por la UNESCO en 1985 [Citation35,Citation36].
Figure 1. Lugares y especies de estudio. Las localidades evaluadas incluyen cinco valles glaciares de la Cordillera Blanca protegidas por el Parque Nacional Huascarán (PNH) (a). Los valles de Parón, Llanganuco y Ulta (norte) (b) son más extensos que los ubicados al sur, Llaca y Rajucolta (c). Línea roja = límite regional; puntos azules y blancos = zonas de muestreo (d) P. albicans y P. weberbaueri se diferencian entre otras particularidades, por sus características foliares. Algunos individuos de P. weberbaueri pueden llegar a sobrepasar los 20 m de alto
El clima en la Cordillera Blanca varía espacialmente con la latitud y elevación y es localmente modificado por la topografía. La temperatura media anual (2–7.7°C) [Citation35] disminuye con la elevación (Figura S1 a) a una tasa de 5–8°C/1000 m entre los 3,000 y 5,000 m dependiendo de la hora del día, la estación y la localidad [Citation37–39]. La temperatura media diaria es relativamente estable a lo largo del año en cada elevación, aunque con eventos de heladas (descensos drásticos de la temperatura por períodos cortos del día, usualmente antes del amanecer) entre mayo y agosto [Citation35,Citation36,Citation40]. Durante estas épocas, entre los 3,900 y 4,500 m la amplitud térmica fuera de los bosques puede ser de 20–40°C con temperaturas mínimas entre las 4 y 7 am y temperaturas bajo cero entre las 10 pm y 8 am (LVM datos no publicados, 2015). En contraste, la precipitación media anual (640–1400 mm) se incrementa con la elevación (Figura S1 f) y muestra una fuerte estacionalidad, disminuyendo pronunciadamente entre junio y agosto [Citation32,Citation35,Citation37]. Como resultado de la estacionalidad, la productividad primaria en distintas comunidades vegetales, como bofedales, matorrales y pastizales de puna, disminuye marcadamente durante la época seca, aunque las zonas boscosas, al ser perennifolias, permanecen sin cambios aparente en su estructura o productividad primaria.
En la Cordillera Blanca, los bosques nativos se distribuyen a lo largo de la mayoría de los valles glaciares orientados de este a oeste y están rodeados por una matriz abierta de pastizales y matorrales montanos [Citation35]. A elevaciones menores a 3,200 m, los bosques nativos están dominados por Aliso (Alnus acuminata), Quishuar (Buddleia incana) y Molle (Schinus molle), mientras que las especies introducidas de eucaliptos (Eucalyptus globulus) o pinos (Pinus radiata) dominan las plantaciones forestales establecidas desde la década de 1970 [Citation36]. Por encima de 3,200 m, los bosques nativos son dominados por Polylepis albicans y P. weberbaueri () mientras que Gynoxys spp. domina las zonas arbustivas [Citation41,Citation42]. Como en varios lugares Andinos, estos bosques suelen distribuirse de forma discontinua en ambas laderas de los valles glaciares, evitando las zonas planas con suelos saturados de agua, mientras que su límite altitudinal superior en Cordillera Blanca está alrededor de los 4,700 m [Citation34,Citation35].
Colección de datos de Polylepis
Entre el 2014 y 2016 recolectamos datos de presencia/ausencia de las especies de Polylepis en 201 parcelas circulares de 10-m de radio ubicadas a lo largo de cinco valles glaciares de la vertiente del Pacifico de la Cordillera Blanca [ver 42–43]. Estas fueron seleccionadas para cubrir toda la extensión altitudinal de los bosques de Polylepis dentro del PNH en base a su accesibilidad. En los valles amplios (13–15 km) de Parón, Llanganuco y Ulta, localizados en la zona norte del PNH (), recolectamos información entre 3,300–4,700 m. En los valles más pequeños (~6-8 km) de Llaca y Rajucolta, en la zona central de Cordillera Blanca (), recolectamos datos entre 3,800–4,700 m. Las parcelas fueron distribuidas de forma estratificada, separadas por > 150 m (media: 206 m; min-máx: 150–480 m) con el fin de representar la variabilidad de comunidades vegetales presentes a lo largo de la gradiente altitudinal. Un total de 113 parcelas fueron ubicadas en bosques de Polylepis, 71 en zonas arbustivas, 12 en pastizales de Puna y 5 en bosques de Eucaliptos. Con el propósito de caracterizar las condiciones ambientales en los limites superiores, seleccionamos 20 puntos adicionales de muestreo al azar entre los 4,700–5,200 m, los cuales se encontraban a más de 5 km de distancia entre ellos (Figura S1).
En el centro de cada parcela, registramos las coordenadas UTM y la elevación (±10 m) (GPS: Garmin 64S).Dentro de cada una de las parcelas registramos la presencia/ausencia de árboles de Polylepis ≥ 10-cm DAP, eucalipto y Japru(Gynoxys Spp.) y de zonas dominadas por pastizales de Puna. Las especies de Polylepis fueron identificadas en campo basado en las características botánicas descritas por Simpson [Citation43].
Datos climáticos y ambientales
Para los análisis consideramos variables ambientales indicadoras de condiciones climáticas (térmicas e hídricas) o energéticas que podrían tener importancia en el establecimiento, crecimiento y supervivencia de las plántulas y arboles adultos de Polylepis. Entre ellas están variables de extremos o rangos climáticos mensuales, variables bioclimáticas (BIO de WorldClim2) [Citation44], radiación solar en época seca y pendiente del terreno. Dado que en los trópicos las zonas de alta-montaña tienen mayor fluctuación diaria de temperatura que estacional, los extremos y rangos climáticos mensuales pueden capturar la gran amplitud térmica diaria característica que afecta el funcionamiento metabólico de las plantas y puede requerir adaptaciones específicas por parte de estas [Citation45]. Las variables BIO de WorldClim2, son variables derivadas de temperatura y precipitación que se consideran de importancia biológica en general al ser indicadores de la disponibilidad anual o la variabilidad temporal en la disponibilidad del agua y energía para las plantas. Similarmente, a escalas espaciales menores la radiación solar en época seca y la pendiente pueden afectar las condiciones hídricas y energéticas. La irradiación solar en época seca representa una medida de energía solar y térmica que también sirve como indicador del potencial estrés hídrico durante la época de menor precipitación. La pendiente puede afectar el flujo y retención de agua bajo el suelo, afectando su disponibilidad para las plantas.
Inicialmente, usamos las 19 variables bioclimáticas de WorldClim 2.1, las cuales son derivadas de datos climáticos mensuales espacialmente interpolados de ~1 km2 resolución registrados entre 1970 y el 2000 [Citation44]. Sin embargo, dada la alta correlación entre muchas de ellas (Spearman r > 0.85), seleccionamos siete que creemos representan adecuadamente el clima local (Figura S1; Figura S2). La temperatura y precipitación media anual (BIO1 y BIO12) son referentes de la cantidad total de energía y agua disponible anualmente [Citation45], mientras que la estacionalidad anual de temperatura y precipitación (BIO4 y BIO15) representa la variabilidad de estas dentro de un año, inferidas a partir de la desviación estándar de la media de los 12 valores mensuales multiplicado por 100 [Citation44]. También usamos la variabilidad de los rangos de temperatura diaria y anual (BIO2 y BIO7) y la isotermalidad (BIO3 = BIO2/BIO7*100), la cual es interpretada como el grado de variación de las temperaturas diarias con respecto al rango de variación anual [Citation45]. Adicionalmente, incluimos la media anual de los valores de temperatura máxima mensual (Tmax) y el rango entre la temperatura máxima y mínima mensual (Tmax – Tmin). Inicialmente también consideramos la temperatura mínima mensual (Tmin), pero debido a que está altamente correlacionada con Tmax se excluyó en los análisis.
El promedio de irradiación solar diaria de la época seca (Junio – Agosto) entre 1986–2010 fue calculado para cada mes con la herramienta r.sun (GRASS GIS 7.2.2) [Citation46], incorporando los efectos de pendientes y sombras topográficas a partir de Modelo de Elevación Digital (DEM) de 30-metros de resolución del Shuttle Radar Topography Mission [Citation47] según la metodología descrita por Morales et al. [Citation34]. Finalmente, extrajimos la pendiente del terreno del mismo DEM. En total, evaluamos 11 variables climáticas y ambientales ().
Table 1. La categoría de las covariables ambientales y combinaciones e interacciones de ellas examinadas para explicar la distribución de P. albicans y P. weberbaueri en Cordillera Blanca y el razonamiento biológico/ecológico detrás de su consideración. Se espera que cada especie exista dentro distintos rangos óptimos para coexistir dentro de la Cordillera Blanca
Análisis de datos
Dado que había diferencias iniciales en la resolución entre las variables climáticas de WorldClim (1-km) y las otras como irradiación solar (30-m), y, a que en algunos casos múltiples puntos de evaluación caían dentro del mismo pixel de 1-km – lo cual causa problemas de psedo-replicación espacial – derivamos una nueva muestra con una nueva unidad analítica basada en cada píxel de 1-km de WorldClim muestreado en campo. De esta manera, nuestras 201 unidades de observación fueron condensadas en 80 unidades analíticas. Estos, junto con los 20 puntos adicionales por encima de los 4,700 m descritos anteriormente, totalizaron 100 unidad analíticas de 1-km. Para cada píxel de 1-km, consolidamos los datos de presencia/ausencia de cada especie de Polylepis, contabilizando a la especie como presente si esta fue registrada en por lo menos uno de los puntos. Para las covariables ambientales de 30-m de resolución derivamos las medidas correspondientes al promedio de los valores (en 500-m radio) de todos los puntos que caían dentro de él. La matriz resultante (100 sitios x 11 covariables x 6 tipos de cobertura) fue usada para los subsiguientes análisis.
En primer lugar, analizamos las asociaciones entre la presencia/ausencia de las especies de Polylepis, eucalipto, Gynoxys y cobertura de pastizal con las condiciones ambientales (no transformadas), mediante un Análisis de Correspondencia Canónica (CCA) implementada con el programa “Vegan” v2.5–6 [Citation48] en RStudio v1.1.463 [Citation49]. Aunque es atípico utilizar la presencia de especies, géneros y hábitos de plantas (arbustos) dentro de un mismo CCA, su uso es justificado debido a que cada uno representa una categoría de cobertura de suelo identificable. Además, este método permite examinar estas relaciones en conjunto y proveer un entendimiento inicial de la relación linear entre estas categorías de cobertura de suelo y las condiciones climáticas. Sin embargo, este análisis posee limitaciones con relaciones cuadráticas y no permite identificar condiciones óptimas a las cuales se maximiza la probabilidad de ocurrencia de una especie – óptimos ecológicos tal como se esperaría según la teoría del nicho de Hutchinson 1957-, por lo cual usamos un segundo método más versátil.
Para evaluar mejor el efecto de cada covariable explicativa en la ocurrencia de cada especie de Polylepis (presencia – ausencia) e identificar si su óptimo ecológico ocurría dentro de nuestra zona de estudio, generamos modelos lineares generalizados (glm) usando el paquete “lme4” [Citation50] en RStudio [Citation49]. Construimos un grupo individual de modelos glm para cada especie de Polylepis, con datos binarios de presencia – ausencia de cada una, especificando una distribución binomial de error, e identificando los efectos lineales, cuadráticos y las respectivas interacciones de las variables explicativas. La incorporación de efectos cuadráticos nos permitía modelar la relación unimodal esperada si la muestra comprendía a el óptimo climático de las variables, mientras que las interacciones nos permiten comprender influencias no lineales entre covariables. Para cada especie generamos 58 modelos para examinar cuáles factores mejor explican la distribución de los datos (, Tabla S1 & Tabla S2). Para identificar los factores o la combinación de factores ambientales que están más asociados con la presencia de Polylepis y podrían explicar mejor su distribución en el paisaje, evaluamos el desempeño de los modelos usando el criterio Akaike corregido (AICc). Consideramos que una diferencias entre los valores de Akaike mayores a 2.0 como indicativas de diferencias significativas entre los modelos (Δi = AICi – AICmin >2.0).
Cobertura forestal
La cobertura forestal (treecover2010) a resolución de 30-m fue adquirida del trabajo desarrollado por el laboratorio GLAD (Global Land Analysis & Discovery) de la Universidad de Maryland [Citation51]. Específicamente, usamos las imágenes correspondientes a las extensiones 00 N-080 W y 10S-080 W, las cuales están basadas en imágenes multiespectrales Landsat-7 de 30-m de resolución procesadas usando un algoritmo de aprendizaje supervisado en Google Earth Engine (GGE) para estimar la densidad de la cobertura forestal por píxel (con valores de 0–100%) [Citation51]. Solo consideramos píxeles con una densidad mayor a 10% para los cálculos de cobertura forestal.
Para estimar la extensión forestal de bosques de Polylepis dentro del PNH usamos mapas de cobertura forestal en combinación con nuestros mejores modelos de nicho ambiental. Primero, mapeamos explícitamente las probabilidades de ocupación (ψ) derivadas a partir del mejor modelo de cada especie de Polylepis dentro de la cobertura forestal (densidad >10%), generando un mapa de ocupación restringida para cada una. Segundo, usando estos dos mapas, determinamos la dominancia de cada especie para cada píxel ocupado por Polylepis, asignando como dominante a la especie con mayor probabilidad de ocupación respecto a la otra. Finalmente, cuantificamos la extensión de las especies contabilizando el número de píxeles dominado por cada una y multiplicándolo por el área de un píxel (30x30-m).
Generamos tres estimaciones de extensión de bosques de Polylepis basadas en umbrales de densidad de cobertura forestal de 60, 30 y 10%. Para el paisaje de estudio consideramos a las áreas con densidad forestal >30% como representativas de áreas de bosque. Los píxeles con densidad de cobertura >60% incluyen parches muy definidos con dosel denso o un mínimo de 13-m de radio, pero tenderán a excluir zonas abiertas, aunque claramente dominadas por varios individuos aislados, o en crecimiento, de Polylepis y probablemente subestima la extensión de estos bosques. Por otro lado, un umbral de zonas con densidad >10% considera muchas áreas principalmente arbustivas (densidad forestal: 10–30%) que probablemente sobreestima la cobertura de Polylepis. Por lo tanto, presentamos las estimaciones para las áreas con densidad forestal >30% como las más razonable y las de los umbrales de zonas con densidades superiores a 60% y 10% como límites inferiores y superiores de la extensión de bosques de Polylepis.
Validación
Los mapas obtenidos fueron contrastados con 103 registros de ambas especies provenientes de estudios previos o ejemplares depositados en herbarios [Citation34,Citation52,Citation53]. Sin embargo, 13 de ellos fueron retirados por (i) presentar limitaciones para identificar el lugar exacto de recolección (n = 5) o (ii) por encontrarse fuera del PNH (n = 8).
Resultados
En total registramos la presencia de Polylepis en 131 de las 201 parcelas (P. albicans: 58, P. weberbaueri: 75), con la co-ocurrencia de ambas en sólo dos de ellas. La mayoría estaban en parcelas ubicadas dentro de bosques, pero hubo 8 puntos donde, pese a estar dentro de esta comunidad vegetal, el tamaño de los árboles no alcanzaba los 10 cm de DAP y por lo tanto quedaron registrados como ausencias. Además, el 22.9% de las presencias fueron de individuos aislados dentro de zonas dominadas por comunidades arbustivas (24) o de pastizales de Puna (6). Salvo algunos individuos plantados en las inmediaciones de los puestos de control o en las inmediaciones de las carreteras, no se registró ningún árbol de P. incana o P. racemosa dentro de las parcelas. Ningún individuo de P. microphylla o P. reticulata fue registrado durante todo el periodo de estudio. A escala de las 80 unidades analíticas de 1 km, Polylepis fue registrada en 62 (P. albicans: 37, P. weberbaueri: 32), coocurriendo en 7 de ellas.
Asociación de Polylepis con las Condiciones Ambientales
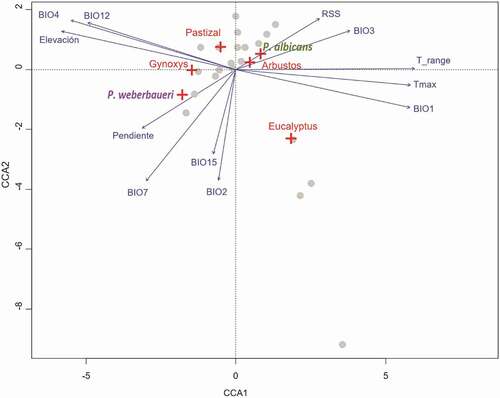
El CCA resultante explico el 37.53% de la variabilidad de los datos en términos de la presencia/ausencia de los distintos tipos de cobertura vegetal (, ). El primer eje (CCA1, 20.03%), captura principalmente las asociaciones entre ambas especies de Polylepis con condiciones opuestas frente a la elevación y variables bio-climáticas de temperatura y precipitación, mientras que el segundo eje (CCA2, 08.72%) describe las asociaciones de los tipos de cobertura (e.g. pastizales, bosques) con la amplitud del rango de temperatura diaria (BIO2) y la estacionalidad en precipitación (BIO15) (). Así, el primer eje está positivamente asociado con la presencia de P. albicans, zonas arbustivas y bosques de eucaliptos y muestra su relación con áreas con mayores valores de temperatura media anual (BIO1), temperatura máxima (T_max), rango de temperatura mensual (T_rango), isotermalidad (BIO3) y zonas con mayor irradiación solar en época seca (RSS). En cambio, P. weberbaueri, Gynoxys y los pastizales están asociadas con zonas a mayor elevación, donde reciben una mayor precipitación media anual (BIO12) y estacionalidad térmica (BIO4). P. weberbaueri está especialmente asociado a zonas de mayor pendiente y rango anual de temperatura (BIO7).
Table 2. Ordenamiento canónico de los seis tipos de cobertura; dominados por las dos especies de Polylepis, Gynoxys Spp., zonas arbustivas, con Eucaliptos o pastizales de Puna.
Table 3. Resultados del Análisis de Correspondencia Canónica (CCA) de las 12 variables ambientales en cinco factores canónicos. Los valores de significancia del análisis ANOVA están mostrados en la última columna; los grados de libertad fueron igual a 1 en todos los casos. Los valores (Eigenvalues), la varianza explicada y valores p por cada CCA se encuentran en las últimas tres filas
Figure 2. Ordenamiento de los seis tipos de cobertura de suelo (cruces rojas) con respecto a 12 variables ambientales (vectores) por los dos primeros CCAs (eje x & y)
Los resultados de los glm muestran que P. albicans y P. weberbaueri poseen nichos ambientales diferentes y su ocupación es maximizada a distintos rangos climáticos principalmente asociados con la temperatura y la radiación solar (, ). En promedio, P. albicans está presente en áreas más cálidas (7.8 °C vs 3.8 °C = Δ 4 °C) y con mayor rango de temperatura mensual (12.3 °C vs 11.2 °C = Δ 1.2 °C) que P. weberbaueri ( – c). Interesantemente, la ocupación de P. albicans decrece constantemente con el incremento de la precipitación anual (ψ = 0.87, a 400 mm vs ψ = 0.09 a 1000 mm) mientras que P. weberbaueri maximiza su probabilidad entre los 700 y 800 mm (). Concordante con esto, P. albicans incrementa su ocurrencia con la irradiación solar (entre los 4000 y 6000 Wh/m2/día; ) y en terrenos menos empinados (10–30 grados; ), mientras que P. weberbaueri muestra una fuerte preferencia por lugares con poca irradiación solar (ψ > 0.5, SRR < 3300 Wh/m2/día) y mayor pendiente.
Table 4. Modelos lineales generalizados (glm) con mejor desempeño (delta AICc < 5) para cada especie de Polylepis en el Parque Nacional Huascarán. El total de los modelos evaluados para cada especie se encuentran en las tablas S1 y S2 del material
Figure 3. Efectos (Media e IC 95%; líneas sólidas y punteadas) de seis covariables ambientales evaluadas por los modelos lineales generalizados (glm) para los datos de presencia-ausencia (círculos 1–0) de Polylepis albicans y P. weberbaueri dentro del Parque Nacional Huascarán
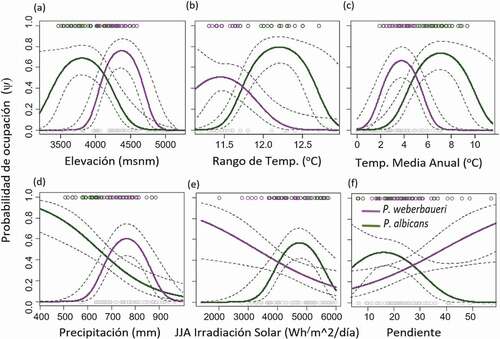
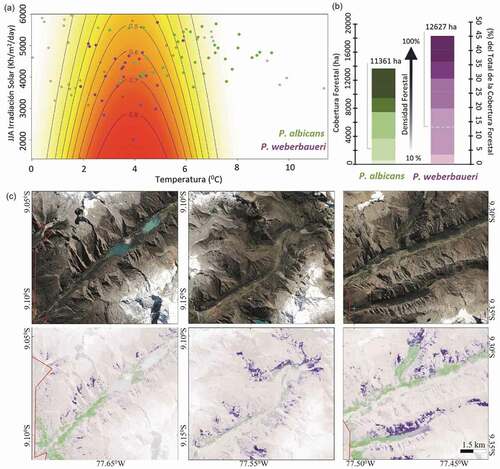
El mejor modelo para P. albicans incluye solo el efecto cuadrático del rango de temperatura mensual (T_rango) [β0 (95%IC) = −1148.41 (−1471.20 ̶ −825.63)*; β1 (95%IC) = 188.442 (134.728 ̶ 242.16)*; β2 (95%IC) = −7.721 (−9.95 ̶ −5.49)*, * = p < 0.0001], mientras que para P. weberbaueri, múltiples modelos que principalmente incluían los efecto cuadráticos de la temperatura media anual (BIO1) y la irradiación solar durante la época seca (RSS) resultaron como los más informativos (). Entre ellos, el modelo BIO12 + RSS figuró como el más significativo [β0 (95%IC) = −3.13 (−5.06 ̶ −1.20)*; β1 (95%IC) = 3.04 (2.19–3.88)*; β2 (95%IC) = −0.39 (−0.49 – −0.28)*; β3 (95%IC) = −0.0004916 (−0.0008043 – −0.0001789)*, * = p < 0.0001] (, ). En resumen, los resultados reflejan (i) el reemplazo de P. albicans (ψ máx = 0.66, a 3,700 m) por P. weberbaueri (ψ máx = 0.75, a 4,400 m) con el incremento de la elevación () y (ii) una preferencia de esta última por áreas con menor exposición solar (ψ > 0.5, SRR < 3000 Wh/m2/dia) ().
Figure 4. La temperatura y la irradiación solar son los factores que mejor explican la separación de nicho entre P. albicans y P. weberbaueri en el Parque Nacional Huascarán. (a) Plot bivariado de la probabilidad de ocupación de P. weberbaueri (logit-psi) en función de la temperatura media anual (BIO1) y la irradiación solar durante la época seca (RSS), a partir del mejor modelo (). Los círculos pequeños corresponden a las 100 parcelas evaluadas (P. albicans: 37, P. weberbaueri: 32, otros: 38). (b) Cobertura forestal de ambas especies (x–izquierda) en proporción a la cobertura forestal total del PNH (x-derecha). Con excepción de la categoría más baja (10%), la saturación del color representa un incremento de 20% de la densidad forestal. Las líneas grises indican las estimaciones para las áreas con densidad forestal >30%. (c) Imágenes satelitales (arriba) y modeladas (abajo) de la ocupación de P. albicans y P. weberbaueri en las quebradas de Llanganuco (izquierda), Ulta (Centro) y Honda/Aquilpo (derecha). Se puede apreciar la mayor conectividad que P. albicans posee en comparación con P. weberbaueri (Fuente de Imagen: Google Earth 2020; Satelite: CNES/Airbus 2020)
Extensión Estimada de Cobertura Forestal
Estimamos un total de 39,505.5 ha de cobertura forestal para el PNH, comprendida por áreas con distintas densidades forestales [Clases de Densidad Forestal, 10–34%: 11,834 ha (29.95%); 35–64%:14,864 ha (37.63%); 65–100%: 12,808 ha (32.42%)]. Calculamos que el 60.72% (Min-Max: 31.2–80.9%) de la extensión total de cobertura forestal del PNH podrían ser bosques de Polylepis. Estimamos 11,361 ha (Min-Max: 6,205.77–13,661 ha) dominadas por P. albicans y 12,627 ha (Min-Max: 6,120.27–18,300 ha) por P. weberbaueri (, Figura S3).
El proceso de validación mostro que el 62% (23/37) y 96% (50/52) de los registros de P. albicans y P. weberbaueri fueron correctamente predichos por nuestro modelo. La mayoría de los puntos erróneamente predichos (12/14; 2/2) ocurrieron en la transición entre ambas especies, donde las probabilidades de ocupación favorecen a P. weberbaueri.
Discusión
Nuestros resultados amplían el conocimiento sobre las condiciones ambientales en las cuales ocurren P. albicans y P. weberbaueri y precisan las estimaciones de extensión de la cobertura forestal que ambas representan dentro del PNH. Mostramos que ambas especies poseen nichos ecológicos distintos que maximizan su probabilidad de ocurrencia en distintos lugares dentro de una misma cordillera. Específicamente, identificamos que la temperatura (T_rango y BIO1) junto a la irradiación solar durante la época seca (RSS) son los factores más importantes que explican su distribución en la Cordillera Blanca. Además, la extensión que ambas especies representan es significativamente mayor a la reportada previamente [Citation35], y confirman que el PNH es una de las áreas con mayores extensiones de P. albicans y P. weberbaueri en el Perú y su adecuada gestión es clave para la conservación de ambas especies y los ecosistemas que conforman.
Se ha sugerido que la temperatura y la disponibilidad de agua son los principales factores que determinan la distribución de Polylepis en los Andes [Citation54,Citation55]. Sin embargo, su importancia relativa puede variar por especie y las condiciones regionales de humedad [Citation56]. Nuestros resultados muestran que esto también sucede a escalas locales y concuerdan con observaciones previas que sugerían que P. albicans está asociada a zonas cálidas y secas mientras que P. weberbaueri lo está a zonas de mayor humedad y menor radiación solar durante la época seca [Citation28,Citation34]. Específicamente, P. albicans está relacionada a la amplitud térmica mensual (T_rango), llegando a tolerar mayores temperaturas que P. weberbaueri durante el año (Temperatura máxima media anual: 14.8 vs 12.3°C respectivamente) y como resultado, posee mayores probabilidades de ocupar zonas a menor elevación o áreas con mayor grado de exposición solar, incluyendo las de menor pendiente y laderas con exposición norte (). Por otro lado, la disminución de la ocurrencia de P. albicans con el incremento de la precipitación podría reflejar (i) que esta especie no estaría tan adaptada a zonas húmedas como lo estaría P. weberbaueri o (ii) que, dependiendo de la capacidad de dispersión de las semillas, podría estar siendo desplazada por competencia interespecífica con P. weberbaueri a zonas de mayor estrés hídrico. Ciertamente, aunque una mayor temperatura y exposición solar podría favorecer el crecimiento de ciertas especies a través del incremento metabólico y fotosintético [Citation57]; ambos factores también regulan el balance hídrico y de evapotranspiración de un ecosistema [Citation57,Citation58], causando eventos de estrés térmico e hídrico que pueden afectar el crecimiento de plántulas [Citation59,Citation60] y adultos de Polylepis [Citation55]. La temperatura del aire, por ejemplo, se ha sugerido como factor limitante del crecimiento apical de Polylepis en el Cuzco [Citation61], mientras que la fuerte radiación solar durante los eventos de heladas suele “quemar” a muchas plántulas de alta montaña [Citation62]. En conclusión, nuestros resultados demuestran que, aunque P. albicans y P. weberbaueri se encuentran dentro del mismo paisaje de la Cordillera Blanca, han desarrollado adaptaciones específicas que les permiten coexistir en simpatría al explotar distintas condiciones ambientales.
Aunque los rangos ambientales que favorecen a P. albicans en la Cordillera Blanca podrían ser extrapolables a otras poblaciones, incluyendo a las ubicadas en la región de la Libertad (Perú) [Citation28], creemos que no es el caso para P. weberbaueri. Los registros de P. weberbaueri sugieren una distribución más amplia de la especie, incluyendo elevaciones tan bajas como los 2,500 m en Lima, Cajamarca, Lambayeque y Piura al norte de Perú [Citation31]. Sin embargo, nosotros no registramos P. weberbaueri por debajo de 3,800 m. Es posible, que su límite inferior en Cordillera Blanca este restringido por la presencia de P. albicans y competencia entre estas especies. Si esto es cierto, el nicho realizado de P. weberbaueri en zonas donde no coexiste con P. albicans sería más amplio, sin embargo, nuestro estudio y observaciones en campo no apoyan esta idea, ya que la ocurrencia de P. weberbaueri dentro de los rangos estudiados disminuye notablemente con la elevación incluso en quebrada sin P. albicans (e.g. Rajucolta). También es poco probable que la ausencia de P. weberbaueri a menores elevaciones sea el resultado de sesgos en la toma de datos o actividades humanas que hayan diezmado selectivamente a esta especie en beneficio de P. albicans. Ante esto, cabe la posibilidad que: (1) las condiciones bio-climáticas donde se registra P. weberbaueri a menores elevaciones sean similares a las observadas a mayores elevaciones en Cordillera Blanca, o (2) que los registros de P. weberbaueri en Cordillera Blanca vs. el Norte Perú y Ecuador comprenden más de una especie (también sugerido por Segovia-Salcedo et al. [Citation26]), que, aunque tengan morfologías similares, tienen requerimientos ecológicos distintos. Creemos que, como se hizo recientemente con el complejo P. serícea [ver 29], tal vez se requiera de una revisión que tome en cuenta las morfologías y los nichos climáticos de las diferentes poblaciones de P. weberbaueri para identificar si realmente se trata de especies distintas.
La diferenciación de nicho entre ambas especies también implica que estas posean características espaciales importantes a discutir. En primer lugar, P. albicans tiende a ubicarse al ingreso de las quebradas, usualmente en el primer tercio de las sub-cuencas donde conforma bosques continuos de mayor extensión (). Esa disposición espacial sugeriría que P. albicans posee una mayor conectividad en el paisaje mientras que P. weberbaueri, al estar restringida a las zonas de mayor elevación y complejidad topográfica, poseería un menor grado de conectividad (). En segundo lugar, nuestros modelos sugieren que el límite inferior de la distribución altitudinal de P. albicans se encontraría fuera de la zona núcleo de la RBH, en la zona de amortiguamiento (< 3,200 m), donde distintas actividades humanas, como la agricultura y el desarrollo urbano, habrían modificado fuertemente su distribución natural [Citation35]. Además, gran parte de la actividad turística masiva y el pastoreo de ganado vacuno por parte de las comunidades locales se desarrollan precisamente en el primer tercio de las quebradas, donde P. albicans estaría más vulnerable a estas actividades. Adicionalmente, es importante notar que gran parte de la extensión de ambas especies está constituida por bosques pequeños (menores a 1 ha) que, en conjunto, representan tanta área como el de los bosques continuos de gran densidad forestal. De acuerdo a los cálculos hechos por el PNH, se estimaba que la cobertura forestal era de 11,560 ha [Citation35], mientras que el mapa Panandino de bosques de Polylepis [Citation63] estima una cobertura de 17,826 ha, ambas estimaciones sin diferenciar entre especies. Nuestros resultados sugieren resultados semejantes (12,326 ha) pero solo cuando restringimos nuestro análisis a áreas con más 60% de cobertura forestal, dejando de lado muchas áreas dominadas por alguna especie de Polylepis pero que no son suficientemente densas. Así mismo, la mayoría de los parches de menor tamaño también son subestimados en este proceso. Esto es especialmente cierto para P. weberbaueri que como mencionamos, está restringida a zonas topográficamente más accidentadas y naturalmente fragmentadas. Los estudios en la Cordillera Vilcanota demuestran que, a mayores elevaciones, los bosques de Polylepis pueden estar fuertemente influenciados por la heterogeneidad topográfica, restringiéndolos a zonas con condiciones micro-climáticas adecuadas [Citation64]. Por estos motivos, nuestros resultados muestran que la extensión de los bosques de Polylepis seria cercana a los 24,000 ha, con aproximadamente la mitad de estas constituidas por bosques de menor tamaño ().
Finalmente, es importante mencionar que además de las características climáticas y ambientales, existen otros procesos evolutivos del paisaje, la topografía, el azar y el impacto humano que también contribuyen a definir la distribución actual de los bosques de Polylepis [Citation60,Citation61]. El impacto humano en Polylepis ha sido particularmente estudiado en distintas regiones, siendo reconocido como un factor determinante de la distribución actual de los relictos de Polylepis en varios de ellos [Citation16,Citation17,Citation61]. Muchos de estos están presentes en la Cordillera Blanca, pero aún faltan ser cuantificados.
Implicancias para la conservación y futuros estudios
Las actividades de conservación y restauración que se realicen dentro del PNH deben considerar las diferencias ecológicas de ambas especies. A lo largo de la elevación, la restauración entre los 3,200–4,000 m debería hacerse con P. albicans, y con P. weberbaueri entre los 4,300–4,700 m. Entre los 4000–4,300 m, donde ocurre la transición entre ambas especies, recomendamos reconocer cuál de ellas está presente en el área de intervención y usar esa especie. Sin embargo, en vista a las proyecciones de cambio climático para la zona, se podría contemplar el uso de P. serícea en estas zonas bajo un esquema de migración asistida. Las plantaciones con especies exóticas de Polylepis debería ser evitada debido a que estas podrían hibridarse con las especies nativas y afectar negativamente la diversidad genética local [Citation29]. La conservación de los bosques pequeños es tan importante como el de los grandes [Citation65,Citation66], ya que, en conjunto, los pequeños representan una gran proporción de la cantidad de total de bosques de ambas especies y podrían ser el hábitat clave para algunas especies de importancia para la conservación [Citation41,Citation66]. Finalmente, creemos que nuestra aproximación para determinar el nicho y la cobertura de estas dos especies puede aplicarse a muchas otras. En ese sentido, el muestreo sistemático a lo largo de la gradiente altitudinal es clave para complementar las colectas de herbario, las cuales usualmente carecen de esta sistematización. Sin embargo, futuras colectas de especímenes de herbario que empleen mejores prácticas de georreferenciación podrían facilitar la aplicación de este tipo de análisis a zonas o especies que no cuentan con muestreos sistemáticos.
Geolocalización
Parque Nacional Huascarán, Latitud: 8°50’S – 10°40’S; Longitud: 77°07ʹW – 77°49ʹW, Departamento de Ancash, Perú
Agradecimientos
El estudio fue financiado por FONDECYT-CONCYTEC (Nº 237-2015-FONDECYT) y Proyecto CONCYTEC - Banco Mundial, a través de su unidad ejecutora el Fondo Nacional de Desarrollo Científico, Tecnológico y de Innovación Tecnológica (Fondecyt). Agradecemos el apoyo logístico de la Universidad de Cornell, Cornell Lab of Ornithology, the Athena Grant, the Bergstrom Award of the Association of Field Ornithologists y al American Alpine Club Research Grants 2017. En especial, queremos agradecer a nuestro equipo de campo: J. Pisconte, N. Young, N. Mamani, R. Watanabe, J. Salvador, C. Sierra, J. Purcell, T. Colonia, R. López, J.M. Quispe, F. Gonzales, C. Elías, C. Gutiérrez, K. Sulca, A. Cáceres, N. Torres, J. Cansaya, N. Solís, D. Young, I. Cachajagua, A. Ochoa, K. Gamarra, R. Rodríguez y V. Gutiérrez. Finalmente, al personal del Parque Nacional Huascarán, Ing. J. Gómez, A. Valverde, M. Salvador, y O. Gonzales, así como a los distintos Guardaparques que ayudaron de muchas maneras.
Supplemental Material
Download MS Word (3.7 MB)Disclosure Statement
No potential conflict of interest was reported by the author(s).
Supplemental Material
Supplemental data for this article can be accessed here.
Additional information
Funding
References
- Gareca EE, Hermy M, Fjeldså J, et al. Polylepis woodland remnants as biodiversity islands in the Bolivian high Andes. Biodivers Conservat. 2010;19(12):3327–3346.
- Herzog SK, Cahill J, Fjeldså J, et al. Ecology and conservation of High-Andean Polylepis forests. Ecotropica 2002;8:93–95.
- Ridbäck U. A floristic study of Polylepis forest fragments in the central Andes of Ecuador [Master's Thesis]. Gotland(Sweden): Gotland University; 2008.
- Romoleroux K, Tandalla DC, Erler R, et al. Plantas vasculares de los bosques de Polylepis en los páramos de Oyacachi. Ecuador: Centro de Publicaciones Pontificia Universidad Católica del Ecuador; 2016.
- Fjeldså J. Key areas for conserving the avifauna of Polylepis forests. Ecotropica. 2002;8(2):125–131.
- Yensen E, Tarifa T. Mammals of Bolivian Polylepis woodlands: guild structure and diversity patterns in the world’s highest woodlands. Ecotropica 2002;8:145–162.
- Sevillano-Ríos CS, Rodewald AD, Morales LV. Ecología y conservación de las aves asociadas con Polylepis: ¿qué sabemos de esta comunidad cada vez más vulnerable? Ecología Austral. 2018;28:216–228.
- Fjeldsa J, Kessler M. Conserving the biological diversity of Polylepis woodlands of the highlands of Peru and Bolivia: a contribution to sustainable natural resource management in the Andes.Denmark: Centre for Tropical Biodiversity and Nordic Foundation for Development and Ecology; 1996.
- Rada F, Azócar A, Briceno B, et al. Carbon and water balance in Polylepis sericea, a tropical treeline species. Trees. 1996;10(4):218–222.
- Fjeldså J. Polylepis forests–vestiges of a vanishing ecosystem in the Andes. Ecotropica. 2002;8(2):111–123.
- Renison D, Hensen I, Suarez R, et al. Soil conservation in Polylepis mountain forests of Central Argentina: is livestock reducing our natural capital? Austral Ecol. 2010;35(4):435–443.
- Vásquez E, Ladd B, Borchard N. Carbon storage in a high-altitude Polylepis woodland in the Peruvian Andes. Alpine Botany. 2014;124(1):71–75.
- Fehse J, Hofstede R, Aguirre N, et al. High altitude tropical secondary forests: a competitive carbon sink? For Ecol Manage. 2002;163(1–3):9–25.
- Cranford M, Mourato S. Community conservation and a two-stage approach to payments for ecosystem services. Ecol Econ. 2011;15(71):89–98.
- Gosling WD, Hanselman JA, Knox C, et al. Long‐term drivers of change in Polylepis woodland distribution in the central Andes. J Veg Sci. 2009;20(6):1041–1052.
- Alinari J, Von Müller A, Renison D. The contribution of fire damage to restricting high mountain Polylepis australis forests to ravines: insights from an un-replicated comparison. Ecología Austral. 2015;25(1):11–18.
- Argibay DS, Renison D. Efecto del fuego y la ganadería en bosques de Polylepis australis (Rosaceae) a lo largo de un gradiente altitudinal en las montañas del centro de la Argentina. Bosque (Valdivia). 2018;39(1):145–150.
- Purcell J, Brelsford A. Reassessing the causes of decline of Polylepis, a tropical subalpine forest. Ecotropica 2004;10:155–158.
- Renison D, Cuyckens GA, Pacheco S, et al. Distribución y estado de conservación de las poblaciones de árboles y arbustos del género Polylepis (Rosaceae) en las montañas de Argentina. Ecología Austral. 2013;23(4):27–36.
- Aucca C, Ramsay PM. Management of biodiversity and land use in southern Peru. Mountain Res Dev. 2005;25(3):287–289.
- Fuentealba B, Sevillano-Ríos CS.Experiences of community rehabilitation with Queñual(Polylepis sp.) in the Department of Ancash,Peru.In:CecconE, PerezDR, editors.Beyond restoration ecology: social perspectives in Latin America and the Caribbean. Buenos Aires (Argentina):Vasquez Mazzini Editores;2017. p.315-330
- Morales LV, Fuentealba B, Sevillano CS, et al. Oportunidades para acercar la ciencia a la práctica de la restauración de bosques y arbustales de Polylepis. Ecología Austral. 2018;28:291–300.
- Renison D, Morales L, GÉ C, et al. Ecología y conservación de los bosques y arbustales de Polylepis: ¿qué sabemos y qué ignoramos? Ecología Austral. 2018 ;28:163–174.
- Pinos J. Challenges and conservation implications of Polylepis woodlands in the Andean region: defining actions for sustainable management. Hacquetia. 2020 ;19:143-153.
- Cerrón Macha J, del Castillo Ruiz JD, Thomas E, et al. Experiencias de restauración en el Perú. Lecciones aprendidas. Lima (Peru):Servicio Nacional Forestal y de Fauna Silvestre;2018.
- Segovia-Salcedo MC, Domic A, Boza T, et al. Situación taxonómica de las especies del género Polylepis. Implicancias para los estudios ecológicos, la conservación y la restauración de sus bosques. Ecología Austral. 2018;28:188–201.
- Cuyckens GA, Christie DA, Domic AI, et al. Climate change and the distribution and conservation of the world’s highest elevation woodlands in the South American Altiplano. Global Planet Change. 2016;1(137):79–87.
- Boza-Espinoza TE, Quispe-Melgar HR, Kessler M. Taxonomic reevaluation of the Polylepis sericea complex (Rosaceae), with the description of a new species. Systemat Bot. 2019 Jun 30;44(2):324–334.
- Segovia MC. Los riesgos de la reforestación de los páramos con especies exóticas: el caso Polylepis racemosa. Propuestas Andinas. 2011;4:1–4.
- Chepstow-Lusty A, Winfield M. Inca agroforestry: lessons from the past. AMBIO: J Hum Environ. 2000;29(6):322–328.
- Mendoza W, Cano A. El género Polylepis en el Perú: taxonomía, morfología y distribución. Saarbrucken (Alemania): Editorial Académia Española; 2012.
- Smith DN. Flora and vegetation of the Huascarán National Park, Ancash, Peru: with preliminary taxonomic studies for a manual of the flora [PhD Dissertations]. Iowa State Univ. 1988. DOI:https://doi.org/10.31274/rtd-180813-8885
- Zutta BR, Rundel PW, Saatchi S, et al. Prediciendo la distribución de Polylepis: bosques Andinos vulnerables y cada vez más importantes. Revista Peruana De Biología. 2012;19(2):205–212.
- Morales LV, Sevillano‐ Ríos CS, Fick S, et al. Differential seedling regeneration patterns across forest–grassland ecotones in two tropical treeline species (Polylepis spp.). Austral Ecol. 2018;43(5):514–526.
- Parque Nacional Huascarán SERNANP. Plan Maestro 2010 – 2015. Vol. l. Lima: Imprenta CANO S.R.; 2010.
- Shoobridge D [ Internet]. ParksWatch Protected Area Profile–Peru: Huascarán National Park.Durham (NC):ParksWatch;2005; [cited 2020 Jul 17]. Disponible en:https://parkswatch.org/parkprofiles/pdf/hunp_eng.pdf
- Carey M, Huggel. C, Bury J, et al. An integrated socio-environmental framework for glacier hazard management and climate change adaptation: lessons from Lake 513, Cordillera Blanca,Peru.Climatic Change. 2012;112:733-767.
- Schauwecker S, Mario Rohrer D, Acuña AC, et al. Climate trends and glacier retreat in the Cordillera Blanca, Peru, revisited. Global Planet Change. 2014;119:85–97.
- Hellström RÅ, Fernández A, Mark BG, et al. Incorporating Autonomous Sensors and Climate Modeling to Gain Insight into Seasonal Hydrometeorological Processes within a Tropical Glacierized Valley.Annals of the American Association of Geographers. 2017;107(2):260–273.
- Kaser G, Juen I, Georges C, et al. The impact of glaciers on the runoff and the reconstruction of mass balance history from hydrological data in the tropical Cordillera Blanca, Peru. J Hydro. 2003;282(1–4):130–144. .
- Sevillano-Ríos CS. Diversity, ecology, and conservation of bird communities of Polylepis woodlands in the northern Andes of Peru. [Master’s Thesis]. Ithaca(NY): Cornell University; 2016. DOI:https://doi.org/10.7298/X45D8PSK.
- Sevillano-Ríos CS, Rodewald AD. Avian community structure and habitat use of Polylepis forests along an elevation gradient. PeerJ. 2017;27(5):e3220.
- Simpson BB. A revision of the genus Polylepis (Rosaceae: sanguisorbeae).Washington D.C.: Smithsonian Institution Press; 1979. (Smithsonian Contributions to Botany;43)
- Fick SE, Hijmans RJ. WorldClim 2: new 1‐km spatial resolution climate surfaces for global land areas. Int J Climatol. 2017;37(12):4302–4315.
- O’Donnell MS, Ignizio DA. Bioclimatic predictors for supporting ecological applications in the conterminous United States. Reston (VA):US Geological Survey; 2012. (US. Geological Survey Data Series; 691).
- GRASS Development Team. Geographic Resources Analysis Support System (GRASS) Software. Version 7.2. Electronic Document: https://grass.osgeo.org. Open Source Geospatial Foundation; 2017.
- Farr TG, Rosen PA, Caro E, et al. The shuttle radar topography mission. Rev Geophys. 2007;45:RG2004.
- Oksanen J, Kindt R, Legendre P, et al.Vegan:Community Ecology Package. R package Version 2.5-6.2020 URL:https://CRAN.R-project.org/package=vegan.
- R studio Team. RStudio: Integrated Development for R. Boston (MA):RStudio, PBC;2020. URL:http://www.rstudio.com/.
- Bates D, Maechler M, Bolker B, et al. Fitting Linear Mixed-Effects Models Using lme4. Journal of Statistical Software. 2015;67(1):1-48. doi:https://doi.org/10.18637/jss.v067.i01.
- Hansen MC, Potapov PV, Moore R, et al. High-resolution global maps of 21st-century forest cover change. Science. 2013;342(6160):850–853.
- Tropicos.org.Saint Louis (MO):Missouri Botanical Garden;[cited 2020 Jul 17]. Available from: https://www.tropicos.org/home
- Morales LV. Polylepis regeneration and the potential for forest expansion in the Peruvian Andes: the influence of cattle and environmental conditions. [Dissertation]. Davis (US): University of California; 2017.
- Hoch G, Körner C. Growth, demography and carbon relations of Polylepis trees at the world’s highest treeline. Funct Ecol. 2005;1(6):941–951.
- Kessler M, Böhner J, Kluge J. Modelling tree height to assess climatic conditions at tree lines in the Bolivian Andes. Ecol Modell. 2007;207(2–4):223–233.
- Toivonen JM, Horna V, Kessler M, et al. Interspecific variation in functional traits in relation to species climatic niche optima in Andean Polylepis (Rosaceae) tree species: evidence for climatic adaptations. Funct Plant Biol. 2014;41(3):301–312. .
- Goldstein G, Meinzer FC, Rada F.Environmental biology of a tropical treeline species, Polylepis sericea. In:RundelPW, SmithAP, MeinzerFC, editors.Tropical Alpine Environments. Cambridge (UK):Cambridge University Press;1994. p. 129–149.
- García-Plazaola JI, Rojas R, Christie DA, et al. Photosynthetic responses of trees in high-elevation forests: comparing evergreen species along an elevation gradient in the Central Andes. AoB Plants. 2015;7:plv058.
- Bader MY, van Geloof I, Rietkerk M. High solar radiation hinders tree regeneration above the alpine treeline in northern Ecuador. Plant Ecol. 2007;191(1):33–45.
- Bader MY, Ruijten JJ. A topography‐based model of forest cover at the alpine tree line in the tropical Andes. J Biogeography. 2008;35:711–723.
- Kessler M, Toivonen JM, Sylvester SP, et al. Elevational patterns of Polylepis tree height (Rosaceae) in the high Andes of Peru: role of human impact and climatic conditions. Front Plant Sci. 2014;5:194.
- Körner C. Alpine treelines: functional ecology of the global high elevation tree limits. Basel(Switzerland):Springer;2012.
- Arnal H, Sampson A, Navarro G, et al. Mapa pan-andino de Bosques de Polylepis prioritarios para conservación [dataset] 2014 Aug 31[cited 2020 Dec 15].In: Zenodo.org [Internet] Lima(Peru):American Bird Conservancy and Comunidad Andina. Available from: DOI:https://doi.org/10.5281/zenodo.4174838
- Toivonen JM, Gonzales-Inca CA, Bader MY, et al. Elevational shifts in the topographic position of Polylepis forest stands in the Andes of southern Peru. Forests. 2018;9(1):7.
- Wintle BA, Kujala H, Whitehead A, et al. Global synthesis of conservation studies reveals the importance of small habitat patches for biodiversity. Proc Nat Acad Sci. 2019;116(3):909–914.
- Sevillano-Ríos CS, Rodewald A. Responses of Polylepis birds to patch and landscape attributes in the High Andes. Neotrop Biodivers. 2021;7(1):5–22.
