ABSTRACT
Mammalian dung represents a primary feeding and reproductive resource for most dung beetle species. Competition for the trophic resource is common among the subfamily Scarabaeinae showing different habits depending on the quantity and quality of food available. In this study, we evaluated the dung of six species of mammal native to Chiapas (Mexico) as attractants for sampling dung beetles. The six species have different feeding habits (carnivores, herbivores and omnivores) and the feces used were obtained from Zoo animals fed a standard diet. Sampling efficiency was over 99% for each of the attractants. Tapirus bairdii feces attracted the highest abundance, while Canis latrans attracted the highest richness and diversity was higher in Procyon lotor. The captured species showed no affinity for a specific attractant, and differences in richness, abundance, diversity, and species composition between baits were largely non-significant. These results suggest that when food availability is high, Scarabaeinae assemblages maintain very abundant populations with generalists feeding habits. However, other aspects such as the quality and quantity (volume) of the food may be important when choosing a resource. Hence, the use of different types of attractants that meet these characteristics offers the possibility of improving results in the monitoring of dung beetle communities in tropical forests, allowing the capture of those inconspicuous or rare species that inhabit the landscape.
RESUMEN
El estiércol de mamíferos representa un recurso primario para la alimentación y reproducción de la mayoría de las especies de escarabajos coprófagos. La competencia por el recurso trófico es común entre la subfamilia Scarabaeinae mostrando diferentes hábitos dependiendo de la cantidad y calidad del alimento disponible. En este estudio se evaluó el estiércol de seis especies de mamíferos nativos de Chiapas (México) como atrayentes para el muestreo de escarabajos coprófagos. Las seis especies presentan distintos hábitos de alimentación (carnívoros, herbívoros y omnívoros) y las heces utilizadas se obtuvieron de animales de Zoológico alimentados con una dieta estándar. La eficiencia de muestreo fue superior al 99% en cada uno de los atrayentes. Las heces de Tapirus bairdii capturaron la mayor abundancia, mientras que Canis latrans atrajo la riqueza más alta y la diversidad fue superior en Procyon lotor. No obstante, las diferencias en la riqueza, abundancia, diversidad y composición de especies entre cebos fueron en gran medida no significativas. Estos resultados sugieren que cuando la disponibilidad de alimento es alta, los ensamblajes de Scarabaeinae mantienen poblaciones muy abundantes con hábitos generalistas de alimentación. Sin embargo, es factible que otros aspectos como la calidad y cantidad (volumen) del alimento, pueden ser importantes al momento de elegir un recurso. Por lo tanto, el uso de distintos tipos de atrayentes que cumplan con estas características brinda la posibilidad de mejorar los resultados en el monitoreo de las comunidades de escarabajos coprófagos en bosques tropicales, permitiendo la captura de aquellas especies inconspicuas o raras que habitan en el paisaje.
Palabras clave:
Introducción
Los escarabajos coprófagos de la subfamilia Scarabaeinae (Coleoptera: Scarabaeidae) están representados por alrededor de 6700 especies y 282 géneros con distribución en todo el mundo [Citation1], pero su diversidad se concentra principalmente en las regiones tropicales y subtropicales, disminuyendo gradualmente hacia los polos, donde están completamente ausentes [Citation2]. Son un grupo de escarabajos taxonómicamente bien diferenciado, relativamente fáciles y económicos de muestrear [Citation3]. Presentan una serie de características que permiten su uso como un grupo bioindicador y la viabilidad de sus comunidades depende en gran medida de la presencia de mamíferos en el ecosistema [Citation4–6]. Debido a sus hábitos de alimentación y nidificación realizan una variedad de servicios ecológicos esenciales para el funcionamiento ecosistémico, tales como facilitación del ciclo de nutrientes, bioturbación del suelo, dispersión secundaria de semillas y supresión de parásitos gastrointestinales de mamíferos, entre otros [Citation7]. Además, los escarabajos son sensibles a los cambios en el hábitat debido a su fuerte relación con la estructura de la vegetación [Citation3,Citation8].
En los bosques tropicales algunas especies de Scarabaeinae consiguen utilizar un amplio rango de recursos tróficos, algunos de ellos muy poco usuales, como hongos, frutos y flores en descomposición [Citation9–13]. Estas adaptaciones dietéticas pueden resultar en distintos niveles de especialización como una consecuencia de la escasez de alimento en el ecosistema [Citation14]. No obstante, los Scarabaeinae probablemente evolucionaron de ancestros con hábitos saprófagos y su diversificación parece haber seguido el incremento de distintos tipos de estiércol resultado de la aparición de mamíferos durante el Mesozoico [Citation15,Citation16], alimentándose principalmente del estiércol de grandes herbívoros [Citation2].
En estudios realizados en la región Neotropical se han utilizado diversos tipos de recursos como atrayentes para el monitoreo de escarabajos coprófagos, entre los que destacan el estiércol de ganado bovino, estiércol de cerdo doméstico y heces humanas [Citation17–19]. Aunque la eficiencia de estos atrayentes ha sido ampliamente justificada, en ocasiones el uso de otros tipos de recurso como carroña, invertebrados muertos, hongos o fruta fermentada son utilizados como alternativas que complementan el muestreo de escarabajos y de esta forma obtener una mayor eficiencia en los muestreos [Citation11,Citation12,Citation20]. Sin embargo, en pocos estudios se ha evaluado el estiércol de especies no introducidas o domesticadas (i.e. especies nativas) como atrayente para la captura de las especies de Scarabaeinae. La mayoría de estos trabajos proceden de países de Sudamérica, como Brasil, Colombia y Argentina [Citation21–25].
El objetivo de este estudio fue evaluar la efectividad de diferentes tipos de estiércol para el muestreo de escarabajos coprófagos. Para ello, se realizaron muestreos utilizando trampas de caída cebadas con estiércol de seis especies de mamíferos nativos del estado de Chiapas (México), los cuales presentan distintos hábitos de alimentación: carnívoros, herbívoros y omnívoros. El estiércol de algunas de estas especies o sus congéneres ha demostrado ser eficientes para la captura de escarabajos coprófagos pero pocas veces se comparan entre ellos en condiciones similares y durante periodos largos de muestreo, pues usualmente su efectividad se evalúa en estimaciones ecológicas rápidas [e.g. 21].
Materiales y métodos
Área de estudio
El estudio fue realizado en El Centro Ecológico y Recreativo El Zapotal (CEREZ), una reserva de administración estatal que forma parte de la región fisiográfica Depresión Central de Chiapas, México. El CEREZ se localiza al sureste de la zona urbana del municipio de Tuxtla Gutiérrez (16°43ʹ 24” N, 93°05ʹ50” W), con una extensión total de 127.4 ha y una zona de influencia de 95.7 ha. El clima de la región es cálido subhúmedo con lluvias en verano y una marcada estación seca. La precipitación promedio anual es de 975.4 mm, concertada principalmente entre los meses de mayo a octubre, con una temperatura media anual de 24.5 °C. Los tipos de vegetación predominante son selva baja caducifolia y selva mediana subperennifolia con un rango altitudinal entre los 600 y 850 m s.n.m [Citation26].
Muestreo e identificación
Se realizaron muestreos una vez por mes desde febrero de 2013 hasta enero de 2014. Durante cada muestreo se instalaron 24 trampas de caída con el cebo colocado en una gasa con un alambre suspendido a nivel de la superficie. Las trampas consistían en recipientes de plástico circulares de 1 L de capacidad, los cuales contenían 250 ml de etilenglicol para conservar los escarabajos capturados. Las trampas se instalaron a lo largo de un trayecto de aproximadamente 1.5 km, cada una separada por un mínimo de 50 m para promover su independencia [Citation27] y se cubrieron con una lámina para evitar la inundación por lluvias y la irradiación solar directa. Las trampas estuvieron activas por un periodo efectivo de 48 h durante cada muestreo.
Las trampas fueron cebadas alternadas con ~30 g de estiércol de seis especies de mamíferos (cuatro trampas por tipo de cebo), todas nativas del estado de Chiapas, pero de amplia distribución en bosques tropicales de México y Centroamérica. Las especies de mamíferos se seleccionaron por presentar distintos hábitos de alimentación:
Carnívoros: Jaguar (Panthera onca [Linnaeus, 1758]) y Coyote (Canis latrans Say, 1823);
Herbívoros: Tapir centroamericano (Tapirus bairdii [Gill, 1865]) y Venado de cola blanca (Odocoileus virginianus Zimmermann, 1780);
Omnívoros: Coatí (Nasua narica [Linnaeus, 1766]) y Mapache boreal (Procyon lotor [Linnaeus, 1758]).
Las heces utilizadas se obtuvieron de animales que se mantienen en cautiverio en un zoológico local (16°43ʹ30” N, 93°05ʹ37” W) durante la mañana del mismo día en que se instalaron las trampas. Estos individuos son alimentados con una dieta estándar de acuerdo con sus hábitos de alimentación. Los escarabajos capturados se transportaron a laboratorio en frascos con etanol al 70% y se identificaron a nivel de especies usando bibliografía taxonómica [Citation28–38].
Análisis de datos
Para evaluar la integridad del muestreo por cada tipo de cebo, se utilizó el estimador de cobertura de la muestra [Citation39]. Las posibles diferencias estadísticas a nivel de riqueza y abundancia de especies entre los seis atrayentes se analizaron con una prueba no paramétrica de Kruskal-Wallis con un umbral de significancia de P = 0.05. También se realizó un análisis de escalamiento multidimensional no métrico (NMDS) basado en la matriz de disimilitud de Bray-Curtis, utilizando los datos de las abundancias obtenidas durante cada mes como unidades de muestreo para expresar gráficamente los patrones de agrupación en la composición de especies de cada cebo. Las diferencias en la composición de especies entre cebos, expresadas en los resultados del NMDS, se corroboraron mediante una prueba ANOSIM (análisis de similitud). La diversidad de especies por tipo de atrayente se estimó en términos del número efectivo de especies o diversidad de orden qD. Se calculó el exponencial de la entropía del índice de Shannon o diversidad de orden 1D, donde todas las especies se consideran de acuerdo con su frecuencia relativa en la muestra; y la diversidad de orden 2D, que es el inverso del índice de Simpson, basado en las especies dominantes de la comunidad [Citation40]. Los análisis de diversidad y el estimador de cobertura de la muestra se obtuvieron usando el método de remuestreo Bootstrap con 500 repeticiones en el paquete R iNEXT [Citation41] con intervalos de confianza al 95%, los cuales se consideran como una prueba de significancia estadística [Citation42]. Todos los análisis se realizaron utilizando los programas estadísticos PAST v.4.02 [Citation43] y R v.3.6.3 [Citation44].
Resultados
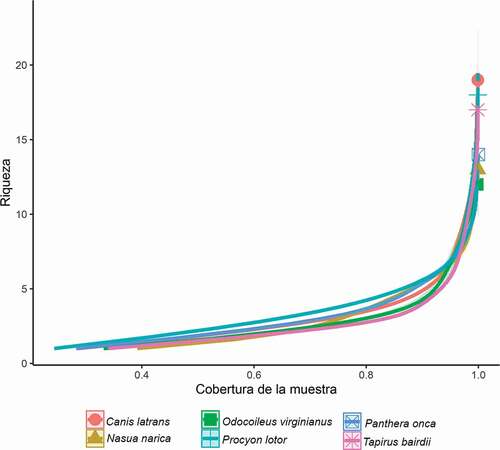
Se capturaron 14,866 individuos distribuidos en 22 especies, 14 géneros y seis tribus de Scarabaeinae (). El estimador de cobertura registró una alta eficiencia de muestreo, con valores que van desde 99.8% en las trampas cebadas con estiércol de O. virginianus hasta 100% en P. onca (; ). Este resultado implica que cada uno de los atrayentes por separado puede ser adecuado para el muestreo de escarabajos coprófagos.
Table 1. Composición de especies de escarabajos coprófagos y distribución de sus abundancias en estiércol de seis especies mamíferos nativos de Chiapas. C.lat = Canis latrans; P.onca = Panthera onca; P.lot = Procyon lotor; N.nar = Nasua narica; T.bair = Tapirus bairdii; O.vir = Odocoileus virginianus.
Figure 1. Cobertura de la muestra obtenida en estiércol de seis especies de mamíferos nativos de Chiapas, utilizados para el muestreo de escarabajos coprófagos
El cebo que atrajo la mayor cantidad de individuos fue el estiércol de T. bairdii (24.83% de la abundancia total), seguido de P. onca con una abundancia similar (24.53%). Las trampas cebadas con estiércol de C. latrans capturaron la mayor riqueza, con 19 especies. Por el contrario, el estiércol de O. virginianus atrajo la menor riqueza y abundancia de especies (). No obstante, no se detectaron diferencias estadísticas al comparar las medias de las abundancias (X2 = 4.36, df = 5, p = 0.499) y la riqueza de especies (X2 = 4.44, df = 5, p = 0.488) entre los seis atrayentes.
Onthophagus anthracinus Harold, 1873 fue la especie más abundante en la mayoría de los cebos, excepto en estiércol de T. bairdii donde la especie dominante fue Canthon femoralis (Chevrolat, 1834). La mitad de las especies (S = 11) fueron muestreadas en los seis cebos. Otras tres especies fueron comunes en cuatro o cinco de los cebos, mientras que solo cuatro fueron exclusivas a uno de ellos, las cuales tenían una abundancia ≤ 3 individuos: dos en estiércol de C. latrans (Copris lugubris Boheman, 1858 y Deltochilum sublaeve Bates, 1887), una en P. lotor (Sisyphus mexicanus Harold, 1863) y una en T. bairdii (Dichotomius colonicus [Harold, 1867]) (). Excluyendo las ocho especies raras (n ≤ 6 individuos), las especies muestreadas fueron notablemente consistentes en todos los tipos de cebo ya que en cada uno de ellos se obtuvo entre 85.7 (s = 12) y 100% (s = 14) de las especies comunes ().
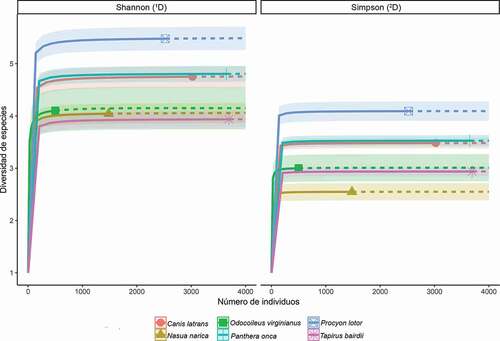
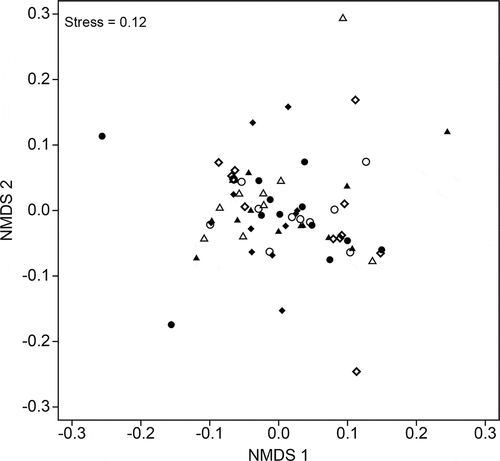
De acuerdo con el análisis de similitud, la composición de especies no difirió significativamente entre los distintos cebos (R = 0.015, p = 0.249) y los grupos formados por el diagrama NMDS no muestran un patrón de separación visual entre cada uno de ellos (). No obstante, de acuerdo con el exponencial de la diversidad de Shannon (1D = 5.48) y el inverso del índice de Simpson (2D = 4.09) el estiércol de P. lotor atrajo un mayor número de especies efectivas ().
Figure 2. Diagrama de escalamiento multidimensional no métrico (NMDS) de los ensamblajes de escarabajos coprófagos capturados en estiércol de seis especies de mamíferos nativos de Chiapas. Panthera onca = circulo relleno; Canis latrans = circulo blanco; Tapirus bairdii = triangulo relleno; Odocoileus virginianus = triangulo blanco; Nasua narica = rombo relleno; Procyon lotor = rombo blanco
Discusión
En este estudio se evaluó la eficiencia del estiércol de seis especies de mamíferos nativos del estado de Chiapas (México) para el muestreo de escarabajos coprófagos de la subfamilia Scarabaeinae. Se obtuvo una alta eficiencia de muestreo en todos los cebos, por lo tanto, esto indica que cada uno de los atrayentes empleados en este trabajo pueden ser utilizados de manera independiente para estudios de monitoreo y comparación de ensamblajes de escarabajos coprófagos en áreas tropicales.
Tomando en cuenta que el área de estudio se encuentra inmersa en una matriz urbana, la proporción faunística de Scarabaeinae fue alta al comparar nuestros hallazgos con otros inventarios de biodiversidad realizados en distintas zonas de la Depresión Central de Chiapas [Citation45,Citation46], con abundancias que sobrepasan al menos 3.6 veces lo obtenido en estos mismos trabajos. Este resultado se puede asociar al hecho de que el área de muestreo está ubicada en una zona que se caracteriza por la presencia constante de diversas especies de vertebrados, así como por la ocupación de excretas obtenidas de las mismas especies, pero en condiciones de cautiverio en un zoológico local ubicado en las cercanías del área de estudio. Es probable que, por su cercanía, las especies de vertebrados que se mantienen en este zoológico proveen los recursos necesarios para la alimentación y nidificación de los escarabajos de forma continua, lo que permite que la mayoría de las especies de Scarabaeinae mantengan poblaciones abundantes a muy abundantes durante gran parte del año [Citation47].
Si bien en estudios previos se ha evaluado la atracción del estiércol de algunas de las especies utilizadas en este estudio o de sus congéneres (e.g. Tapirus terrestris [Linnaeus, 1758] y Procyon cancrivorus [Cuvier, 1798]) [Citation21,Citation23,Citation48]; hasta ahora, únicamente en un trabajo se ha evaluado el estiércol de mamíferos nativos como atrayente para los ensamblajes de Scarabaeinae en México [Citation49]. En dicho estudio se reportan 21 especies atraídas a estiércol de coatí (N. narica) y mono aullador (Alouatta palliata) en el bosque tropical de Los Tuxtlas, Veracruz. Por tanto, estos resultados incrementan el conocimiento sobre la fauna de escarabajos coprófagos asociada a estiércol de especies de mamíferos nativos en México.
Aunque hubo pequeñas diferencias en el número de especies e individuos muestreados por cada cebo, las diferencias fueron estadísticamente no significativas. Además, los ensamblajes de escarabajos fueron notablemente consistentes, donde casi todas las especies abundantes o muy abundantes se capturaron en todos los cebos y la composición de especies muestra un alto porcentaje de similitud sin diferencias estadísticas. Todas aquellas especies que se limitaron a uno o dos tipos de atrayentes (siete especies) se presentaron en bajas abundancias (n ≤ 3 individuos), las cuales por lo general manifiestan preferencias por recursos distintos a los de esta investigación. De estas especies raras, Copris lugubris Boheman, 1858, Dichotomius colonicus (Harold, 1867) y Scatimus ovatus Harold, 1862, presentan poblaciones abundantes en áreas abiertas o muy perturbadas, como áreas de pastoreo, mientras que Coprophanaeus corythus (Harold, 1863) y Deltochilum scabriusculum Bates, 1887 usualmente son consideradas especies necrófagas especialistas [Citation17,Citation50]. Por otro lado, Sisyphus mexicanus Harold, 1863 forma parte de un conjunto de especies de rareza biogeográfica, capturada ocasionalmente y en abundancias muy bajas [Citation51].
En los ensamblajes de Scarabaeinae, además de la distribución temporal y las estrategias de nidificación, la preferencia trófica funciona como uno de los principales mecanismos que permiten reducir la potencial competencia intra e interespecífica [Citation14,Citation15]. Esto permitiría la coexistencia de una mayor diversidad de especies con poblaciones abundantes en comunidades de un área determinada [Citation17,Citation19]. Nuestros resultados indican que a pesar de que la mayoría de las especies recolectadas no mostraron una clara afinidad por algún tipo de estiércol (generalistas), si es posible detectar especies raras que se encontraron en un solo cebo. Esto concuerda con un estudio a nivel global sobre el grado de especialización trófica que sugiere que las especies de escarabajos coprófagos son principalmente de hábitos generalistas, con una baja especificidad por un tipo de recurso [Citation52].
A diferencia de la atracción que generan otros tipos de atrayentes para la captura de escarabajos coprófagos, como la carroña, hongos o fruta fermentada [Citation10–12], recursos que comúnmente son aprovechados por especies con cierto grado de especialización [Citation14], las heces humanas o el estiércol de cerdo doméstico, son atrayentes considerados los más eficientes para el monitoreo de la subfamilia Scarabaeinae al atraer a casi todas las especies de estos insectos [Citation17,Citation19]. No obstante, es posible que alternar dichos atrayentes con una mayor oferta de recursos brinde la ventaja de aumentar de forma considerable el esfuerzo de muestreo [Citation20], ayudando a determinar de manera más efectiva la amplitud trófica de las especies [Citation11] y a su vez ofrecer resultados más realistas de la composición de especies de escarabajos coprófagos presentes en el paisaje [Citation47], permitiendo obtener especies raras o especialistas.
Por otra parte, si bien no se encontraron diferencias estadísticas, se observó una evidente disminución en la captura de individuos en las trampas cebadas con estiércol de O. virginianus respecto de los demás atrayentes, principalmente de las especies que generan masas de estiércol de mayor tamaño (i.e. T. bairdii y P. onca). Como se ha demostrado en otros estudios, este resultado se puede atribuir a una estrategia de “percheo” para reducir las interacciones competitivas dentro y entre especies [Citation53], ya que una alta oferta alimento permite que las especies de Scarabaeinae seleccionan principalmente las masas el estiércol de mayor tamaño, mientras que las más pequeñas probablemente funcionen como un recurso alterno [Citation54–56]. Además, presentan un menor contenido de agua y debido a su consistencia tienden a desecarse con mayor rapidez, afectando la emisión del olor, lo que hace que sean un recurso transitorio menos aprovechable para los escarabajos coprófagos [Citation57].
Sin embargo, no solo la cantidad o el estado del estiércol determinan la atracción de escarabajos [Citation2]. De acuerdo con los análisis de diversidad, el número efectivo de especies fue significativamente superior en las trampas cebadas con estiércol de P. lotor, una especie con hábitos omnívoros de alimentación. Este resultado es consistente con los hallazgos de estudios previos que han demostrado que las trampas con cebo de estiércol omnívoro superan al estiércol herbívoro o carnívoro para el muestreo de ensamblajes de escarabajos coprófagos en la región Neotropical ya que representa el principal tipo de alimento utilizado por las especies de Scarabaeinae [Citation18,Citation21,Citation22]. Lo anterior se puede atribuir a la mayor capacidad de atracción, la cantidad y la calidad de los nutrientes presentes en el estiércol de las especies omnívoras en comparación con el estiércol de las especies herbívoras [Citation2,Citation21,Citation58].
No obstante, se debe considerar que la dieta de los mamíferos en vida silvestre puede ser compleja química, temporal y espacialmente. Si bien la alimentación de un animal en cautiverio se enfoca en duplicar los nutrientes que consumen dichas especies, es claro que siempre existirá una diferencia en lo que consuma un animal en vida silvestre en comparación a la alimentación de un animal en cautiverio [Citation59]. La repercusión de lo anterior a nivel de excretas es, su disponibilidad en el territorio, su temporalidad, tamaño y la intensidad de los olores producto de la emisión de compuestos químicos. Factores como la vegetación, el clima local y tipo de suelo pueden hacer la diferencia en el tiempo de desecación o descomposición rápida de las excretas y de los nutrientes que contienen [Citation60,Citation61]. Por otra parte, las excretas de las diferentes especies presentan características propias como su tamaño, cantidad, consistencia y composición, variando a su vez con la edad, sexo, tipo de alimento ingerido y su capacidad de absorción [Citation62,Citation63]. Además, las secreciones de cada especie presentan un olor característico y complejo, donde no solo intervienen los productos ingeridos, sino también aspectos morfo-fisiológicos de la especie [Citation64,Citation65].
Si bien se deben considerar diversos aspectos al utilizar las excretas de animales en cautiverio para el monitoreo de las comunidades de Scarabaeinae, ante la dificultad de utilizar las heces de especies silvestres, estas ofrecen una alternativa logísticamente viable que permitiría determinar la amplitud trófica los escarabajos coprófagos en un área determinada de manera más efectiva [Citation20,Citation21]. La disponibilidad de recursos ofrecida por distintos cebos en este estudio favoreció una alta eficiencia de captura de escarabajos coprófagos, incluidas aquellas especies consideradas raras. Aun cuando las diferencias en cuanto a riqueza, abundancia, diversidad y composición de especies encontradas en cada uno de los cebos utilizados en esta investigación resultaron en gran medida no significativas, también demostraron que su uso en conjunto ofrece mejores resultados. En particular, destacan el estiércol de ciertas especies de mamíferos (i.e. P. onca, P. lotor y T. bairdii), probablemente por sus características físicas o químicas, atributos que inciden en su poder de atracción. Por lo tanto, el uso de distintos tipos de atrayentes que cumplan con estas características, brinda la posibilidad de obtener resultados más cercanos a la diversidad local de especies en bosques tropicales.
Agradecimientos
Los autores agradecen a la Dirección de la Reserva El Zapotal por las facilidades que permitieron el desarrollo de este trabajo. Al personal técnico de la curaduría de mamíferos del Zoologico Miguel Álvarez del Toro por su ayuda para recolectar las muestras para el uso de atrayentes durante los muestreos. Rolando A. Dávila-Sánchez revisó una versión preliminar del artículo. Los comentarios de dos revisores anónimos y del editor en jefe de la revista permitieron realizar mejoras sustanciales al manuscrito.
Contribución de los autores
MERL Realizó el trabajo de campo; GSH analizó los datos y concibió el primer borrador del manuscrito; MERL y BG revisaron y realizaron mejoras sustanciales al manuscrito.
Disclosure Statement
No potential conflict of interest was reported by the author(s).
References
- Schoolmeesters P. Scarabs: world scarabaeidae database. Roskov Y, Ower G, Orrell T et al. editors Species 2000 & ITIS catalogue of life. [Internet]. updated 2020; Cited 2020 jun 21. Available from https://www.catalogueoflife.org/col/details/database/id/27
- Scholtz CH, Davis ALV, Kryger U. Evolutionary biology and conservation of dung beetles. Sofia (BG): Pensoft; 2009.
- Halffter G, Favila ME, Scarabaeinae T. (Insecta: Coleoptera) an animal group for analyzing, inventorying and monitoring biodiversity in tropical rainforest and modified landscapes. Biol Int. 1993;27:15–21.
- Favila ME, Halffter G. The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zool Mex (n.s.). 1997;72:1–25.
- Spector S. Scarabaeine dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae): an invertebrate focal taxon for biodiversity research and conservation. Coleopts Bull. 2006;60(sp5):71–83.
- Otavo SE, Parrado-Roselli A, Noriega JA. Superfamilia Scarabaeoidea (Insecta: Coleoptera) como elemento bioindicador de perturbación antropogénica en un parque nacional amazónico. Rev Biol Trop. 2013;61(2):735–752.
- Nichols E, Spector S, Louzada J, et al. Ecological functions and ecosystem services provided by Scarabaeinae dung beetles. Biol Conserv. 2008;141(6):1461–1474.
- Nichols E, Larsen T, Spector S, et al. Global dung beetle response to tropical forest modification and fragmentation: a quantitative literature review and meta-analysis. Biol Conserv. 2007;137(1):1–19.
- Larsen TH, Lopera A, Forsyth A, et al. From coprophagy to predation: a dung beetle that kills millipedes. Biol Lett. 2009;5(2):152–155.
- Da Silva PG, Bogoni JA. Dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae) attracted to rotten eggs in the Atlantic forest in subtropical southern Brazil. Coleopts Bull. 2014;68(2):339–342.
- Salomão RP, Lira AFA, Iannuzzi L. Dominant dung beetle (Coleoptera: Scarabaeidae: Scarabaeinae) species exhibit wider trophic niches on fruits, excrement, and carrion, in Atlantic forest, Brazil. Coleopts Bull. 2014;68(4):686–688.
- Sánchez-Hernández G, Agustín-Sánchez J Bueno-Villegas J, et al. Utilizando un recurso inusual: escarabajos del estiércol atraídos a milpiés (Diplopoda: spirobolida). Rev Peru Biol. 2019;26(4):499–502.
- Noriega JA, Calle JC. Consumption of Gustavia hexapetala (Aublet) Smith (Lecythidales: lecythidaceae) by the dung beetle Eurysternus plebejus Harold (Coleoptera: Scarabaeidae). Coleopts Bull. 2008;62(4):455–460.
- Halffter G, Halffter V. Why and where coprophagous beetles (Coleoptera: Scarabaeinae) eat seeds, fruits or vegetable detritus. Boletín SEA. 2009;45:1–22.
- Halffter G, Matthews EG. The natural history of dung beetles of the subfamily Scarabaeinae (Coleoptera, Scarabaeidae). Folia Entomol Mex. 1966;12–14:1–312.
- Hanski I, Cambefort Y. Dung beetle ecology. Princeton (NJ):: Princeton University Press; 1991. p. 481.
- Navarrete DA, Halffter G. Dung beetle (Coleoptera: Scarabaeidae: Scarabaeinae) diversity in continuous forest, forest fragments and cattle pastures in a landscape of Chiapas, Mexico: the effects of anthropogenic changes. Biodivers Conserv. 2008;17(4):2869–2898.
- Correa CMA, Puker A, Korasaki V, et al. Attractiveness of baits to dung beetles in Brazilian savanna and exotic pasturelands. Entomol Sci. 2016;19(2):112–123.
- Sánchez-Hernández G, Gómez B, Delgado L, et al. Diversidad de escarabajos copronecrófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en la Reserva de la Biosfera Selva El Ocote, Chiapas, México. Caldasia. 2018;40(1):144–160.
- Larsen TH, Lopera A, Forsyth A. Extreme trophic and habitat specialization by Peruvian dung beetles. Coleopts Bull. 2006;60(4):315–324.
- Bogoni JA, Hernández MIM. Attractiveness of native mammal’s feces of different trophic guilds to dung beetles (Coleoptera: Scarabaeinae). J Insect Sci. 2014;14(1):299.
- Filgueiras BKC, Liberal CN, Aguiar CDM, et al. Attractivity of omnivore, carnivore and herbivore mammalian dung to Scarabaeinae (Coleoptera, Scarabaeidae) in a tropical Atlantic rainforest remnant. Rev Bras Entomol. 2009;53(3):422–427.
- Giménez VC, Verdú JR, Gómez-Cifuentes A, et al. Influence of land use on the trophic niche overlap of dung beetles in the semideciduous Atlantic forest of Argentina. Insect Conserv Diver. 2018;11(6):554–564.
- Puker A, Correa CMA, Korasaki V, et al. Dung beetles (Coleoptera: Scarabaeidae) attracted to dung of the largest herbivorous rodent on earth: a comparison with human feces. Environ Entomol. 2013;42(6):1218–1225.
- Noriega JA. Dung beetles (Coleoptera: scarabaeinae) Attracted to Lagothrix lagotricha (Humboldt) and Alouatta seniculus (Linnaeus) (Primates: atelidae) dung in a Colombian Amazon Forest. Psyche. 2012;2012:437589.
- Palacios-Espinosa E, Beutelspacher CR, Sarmiento-Cortez O. Vegetación y flora del Parque Ecológico y Recreativo El Zapotal, Tuxtla Gutiérrez, Chiapas, México. Lacandonia. 2016;10(1):37–86.
- Larsen TH, Forsyth A. Trap spacing and transect design for dung beetle biodiversity studies. Biotropica. 2005;37(2):322–325.
- Delgado L, Kohlmann B. Revisión de las especies del género Uroxys Westwood de México y Guatemala (Coleoptera: Scarabaeidae: Scarabaeinae). Folia Entomol Mex. 2007;46(1):1–36.
- Edmonds WD, Zidek J. A taxonomic review of the neotropical genus Coprophanaeus Olsoufieff, 1924 (Coleoptera: Scarabaeidae, Scarabaeinae). Insecta Mundi. 2010;0129:1–111.
- Edmonds WD, Zidek J. Taxonomy of Phanaeus revisited: revised keys to and comments on species of the new world dung beetle genus Phanaeus MacLeay, 1819 (Coleoptera: Scarabaeidae: Scarabaeinae: Phanaeini). Insecta Mundi. 2012;0274:1–108.
- Génier F. A new species and notes on the subgenus Deltochilum (Deltochilum) Eschscholtz, 1822 (Coleoptera: Scarabaeidae: Scarabaeinae: Deltochilini). Zootaxa. 2012;3357(1):25–36.
- Génier F, Kohlmann B. Revision of the Neotropical dung beetle genera Scatimus Erichson and Scatrichus gen. nov. (Coleoptera: Scarabaeidae: Scarabaeinae). Fabreries. 2003;28(2):57–111.
- González-Alvarado A, Vaz-de-Mello FZ. Taxonomic review of the subgenus Hybomidium Shipp 1897 (Coleoptera: Scarabaeidae: Scarabaeinae: Deltochilum). Ann Soc entomol Fr. 2014;50(3–4):431–476.
- Kohlmann B, Solís A. El género Onthophagus (Coleoptera: Scarabaeidae) en Costa Rica. G it Ent. 2001;9:159–261.
- Kohlmann B, Solís A. El género Canthidium (Coleoptera: Scarabaeidae) en Norteamérica. G it Ent. 2006;11:235–295.
- López-GuerreroI. Los Dichotomius (Coleoptera: Scarabaeidae, Dichotomiini) de la fauna de México. Boletín SEA. 2005;36:195–209.
- Peraza L, Deloya C. Una nueva especie mexicana de Dichotomius Hope (Coleoptera: Scarabaeidae) y clave para la identificación de las especies del grupo carolinus. Neotrop Entomol. 2006;35(5):629–631.
- Rivera-Cervantes LE, Halffter G. Monografía de las especies mexicanas de Canthon del subgénero Glaphyrocanthon (Coleoptera: Scarabaeidae: Scarabaeinae). Acta Zool Mex (n.s.). 1999;77:23–150.
- Chao A, Jost L. Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology. 2012;93(12):2533–2547.
- Jost J. Entropy and diversity. Oikos. 2006;113(2):363–375.
- Hsieh TC, Ma KH, Chao A. iNEXT: an R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods Ecol Evol. 2016;7(12):1451–1456.
- Moreno CE, Barragán F, Pineda E, et al. Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Rev Mex Biodivers. 2011;82(4):1249–1261.
- Hammer Ø, Harper DAT, Ryan PD. PAST: Paleontological Statistics software package for education and data analysis. Palaeontol Electron. 2001;4(1):1–9
- R Core Team. R: a language and environment for statistical computing. Vienna (AT): R Foundation for Statistical Computing; 2019.
- Arellano L, León-Cortes JL, Halffter G. Response of dung beetle assemblages to landscape structure in remnant natural and modified habitats in southern Mexico. Insect Conserv Diver. 2008;1(4):253–262.
- Arellano L, León-Cortes JL, Halffter G, et al. Acacia woodlots, cattle and dung beetles (Coleoptera: scarabaeinae) in a Mexican silvopastoral landscape. Rev Mex Biodivers. 2013;84(2):650–660.
- Rodríguez-López ME, Sánchez-Hernández G, Gómez B. Escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en la reserva El Zapotal, Chiapas, México. Rev Peru Biol. 2019;26(3):339–350.
- Raine EH, Mikich SB, Lewis OT, et al. Linking dung beetle-mediated functions to interactions in the Atlantic forest: sampling design matters. Biotropica. 2020;52(2):215–220.
- Estrada E, Halffter G, Coates-Estrada R, et al. Dung beetles attracted to mammalian herbivore (Alouatta palliata) and omnivore (Nasua narica) dung in the tropical rain forest of Los Tuxtlas, Mexico. J Trop Ecol. 1993;9(1):45–54.
- Quiroz-Rocha GA, Navarrete-Heredia JL, Martínez-Rodríguez PA. Especies de Scarabaeinae (Coleoptera: Scarabaeidae) y Silphidae (Coleoptera) necrófilas del bosque de pino-encino y bosque mesófilo de montaña en el municipio de Mascota, Jalisco, México. Dugesiana. 2008;15(1):27–37.
- Morón MA. Scarabaeidae. In: Llorente-Bousquets J, García-Aldrete AN, González-Soriano E, editors. Biodiversidad, taxonomía y biogeografía de artrópodos de México. Hacia una síntesis de su conocimiento. México (MX): Instituto de Biología, UNAM; 1996. p. 287–307.
- Frank K, Krell F-T, Slade EM, et al. Global dung web: high trophic generalism of dung along the latitudinal diversity gradient. Ecol Lett. 2018;21(8):1229–1236.
- Noriega JA, Vulinec K. Perching behavior by dung beetles (Coleoptera: Scarabaeidae): a spatial segregation mechanism to dilute interspecific competition in highly rich assemblages? Ann Entom Soc Am. 2021;114(1):17–26.
- Peck SB, Howden H. Response of a dung beetle guild to different sizes of dung bait in a Panamanian rainforest. Biotropica. 1984;16(3):235–238.
- Finn JA, Giller PS. Path size and colonisation patterns: an experimental analysis using north temperate coprophagous dung beetles. Ecography. 2000;23(3):315–327.
- Errouissi F, Haloti S, Jay-Robert P, et al. Effects of the attractiveness for dung beetles of dung pat origin and size along climatic gradient. Environ Entomol. 2004;33(1):45–53.
- Halffter G, Edmonds WD. The nesting behavior of dung beetles (Scarabaeinae): an ecological and evolutive approach. Mexico (MX): Man and Biosphere Program UNESCO; 1982.
- Holter P, Scholtz C. What do dung beetles eat? Ecol Entomol. 2007;32(6):690–697.
- Diereweld E. Captive wild animal nutrition: a historical perspective. Proc Nutr Soc. 1997;56(3):989–999.
- Chame M. Terrestrial Mammal Feces: a Morphometric Summary and Description. Mem Inst Oswaldo Cruz. 2003;98(Suppl. I):71–94.
- Stuart C, Stuart T. A field guide to the tracks and signs of southern and East African wildlife. Cape Town (ZA): Southern Books Publishers; 1998.
- Bang P, Dahlström P. Huellas y Señales de los Animales de Europa. Barcelona (ESP): Omega; 1999.
- Touma C, Palme R. Measuring fecal glucocorticoid metabolites in mammals and birds: the importance of validation. Ann NY Acad Sci. 2005;1046(1):54–74.
- Gorman ML, Trowbridge BJ. The role odor in the social lives carnivores. In: Gittleman JL, editor. Carnivore behavior, ecology and evolution. New York (USA): Springer; 1989. p. 57–88.
- Aranda J. Manual para el rastreo de mamíferos silvestres en México. México (MX): Comisión Nacional para el Conocimiento y el Uso de la Biodiversidad; 2012.