RESUMEN
En la Región Oriental del Paraguay se encuentran los humedales del Complejo Ypoá, declarados como sitio RAMSAR y categorizados como Reserva de Recursos Manejados. Pese a estas categorías de protección, su biodiversidad ha sido escasamente estudiada. El objetivo de este trabajo fue determinar la riqueza, composición y abundancia de anuros y reptiles de estos humedales (diversidad alfa y gamma), cuantificar la diferencia en la composición de especies entre los sitios de muestreo (diversidad beta) y evaluar la variación temporal en la riqueza de especies en relación a variables climáticas. Se seleccionaron tres sitios de muestreo y se realizó un esfuerzo de muestreo de 45 días. La detección de herpetozoos se realizó a través de búsquedas activas asociadas a listas MacKinnon en el caso de anuros, instalación de trampas pozo con cercos de conducción y redes de embudo acuáticas. Los datos de precipitación, humedad y temperatura mensual se obtuvieron del Centro Meteorológico Nacional. Se identificaron 32 especies de anuros y 21 de reptiles a escala regional en los humedales del Ypoá. El sitio con mayor riqueza de especies de anuros fue Quiindy (27 especies), y para reptiles, Carapeguá (10 especies). Las curvas de acumulación y los estimadores de riqueza indicaron que a mayor esfuerzo de muestreo se seguirán registrando especies de reptiles, sin embargo, en el caso de los anuros, el muestreo fue suficiente para caracterizar el 89 % de la riqueza de este ensamble. La similitud en la composición de anuros entre los sitios varía entre 0.571–0.708, y entre reptiles 0.071–0.182. Menos de un tercio de las especies registradas fueron clasificadas como abundantes en los humedales, incluyendo Melanophryniscus paraguayensis, la única especie de anuro endémica del Paraguay. Se registró una correlación positiva entre la riqueza de especies de anuros y reptiles y la temperatura del aire en los meses de muestreo.
PALABRAS CLAVE:
Introducción
Los humedales del Lago Ypoá forman un paisaje de gran extensión en la Región Oriental del Paraguay, caracterizado por una gran sabana de inundación con tres espejos de agua importantes en superficie: Lago Ypoá, Laguna Cabral y Laguna Verá [Citation1]. Estos humedales fueron designados en 1995 como Humedales de Importancia Internacional (sitio Ramsar), y, recientemente, parte de su territorio fue declarado como Reserva de Recursos Manejados Lago Ypoá, por la Ley 5859/2017, con una superficie de 119.006 ha. A pesar de estas categorías de protección, los humedales del Complejo Ypoá atraviesan por amenazas a su conservación, entre los que se puede mencionar la influencia antrópica debido a la ganadería, la agricultura, el establecimiento de industrias y la urbanización, en ausencia de una planificación territorial [Citation2,Citation3]. En adición, los estudios sobre su diversidad son escasos, y se enfocan principalmente en las comunidades vegetales [Citation1,Citation4–6]. Con respecto a la fauna, se ha publicado información referente a la diversidad de aves [Citation7] y mamíferos [Citation8]. En cuanto a la herpetofauna, se sabe que la riqueza basada en ejemplares de referencia en los humedales del Ypoá es de nueve especies de anuros y seis especies de reptiles [Citation9,Citation10].
En las últimas décadas, se ha registrado el declive de las poblaciones de anfibios y reptiles a escala mundial. El mismo se vincula principalmente al cambio climático, la pérdida y degradación de hábitats, las enfermedades emergentes, la contaminación ambiental, el uso de agroquímicos, la sobreexplotación y la introducción de especies invasoras [Citation11–13]. Estas problemáticas ponen de manifiesto la necesidad de aumentar el conocimiento sobre la diversidad y ecología de los herpetozoos, que, como parte integral de los ecosistemas, contribuyen a al mantenimiento y regulación de diversas funciones ecosistémicas como el ciclo de nutrientes, la bioturbación, la polinización, la dispersión de semillas y el flujo de energía [Citation14,Citation15].
Para diseñar estrategias efectivas de conservación, tanto a escala local como regional, el análisis de la biodiversidad basado en sus componentes alfa, beta y gamma es de gran utilidad [Citation16]. La diversidad alfa corresponde a la medición de atributos comunitarios como la riqueza y la abundancia de una comunidad específica, la diversidad beta mide el reemplazo en la composición de especies entre diferentes comunidades, y la diversidad gamma corresponde a la medición de atributos comunitarios en varias comunidades que integran un paisaje [Citation17]. Asimismo, es muy conocido el efecto que tienen variables ambientales en el comportamiento de los anfibios y reptiles [Citation18,Citation19], lo que afecta su detección y por tanto las estimativas de los atributos comunitarios como riqueza, composición y abundancia de especies [Citation20–23].
Considerando la importancia de los humedales del Ypoá y del estudio de su biodiversidad con miras a su conservación a largo plazo, el objetivo de este trabajo es conocer la riqueza, composición y abundancia de anuros y reptiles en humedales del Complejo Ypoá, analizando la diversidad alfa, beta y gamma, así como la variación temporal de la riqueza específica en relación a la temperatura, humedad y precipitación.
Materiales y Métodos
Área de estudio
El estudio se realizó en el Complejo de Humedales del Ypoá que abarca tres departamentos: Central, Paraguarí y Ñeembucú. El clima es sub-tropical templado-cálido, con una temperatura promedio anual de 25°C y la precipitación promedio anual es de hasta 1400 mm, con énfasis en los meses de la estación estival [Citation1].
Considerando los caminos disponibles y el permiso de los propietarios de tierras privadas, se establecieron tres sitios de muestreo, localizados en el distrito de Nueva Italia (dpto. Central, 57º 31’ 00,8’’ O; 25º 39’ 24,2’’ S), distrito de Carapeguá (dpto. Paraguarí, 57º 25’ 6,84” O; 25º 51’ 20,58” S) y distrito de Quiindy (dpto. Paraguarí, 57°26’29.17” O; 25°56’54.90” S). Los últimos dos sitios están incluidos en el polígono que corresponde a la Reserva de Recursos Manejados ().
Figura 1. Sitios de muestreo localizados en el Complejo de humedales del Ypoá, Paraguay.
Figure 1. Sampling sites located in the Ypoá Wetland Complex, Paraguay.
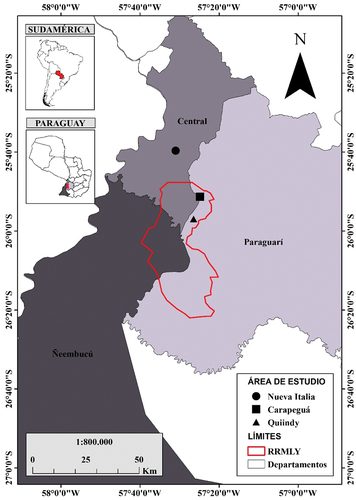
El punto de muestreo de Nueva Italia corresponde a una zona con influencia de cultivos de caña de azúcar y ganadería. La vegetación del área incluye isletas de bosques subhúmedos semicaducifolios, bosques higrófilos y pastizales naturales. Las familias botánicas dominantes en los pastizales son Asteraceae y Poaceae; y en los bosques Meliaceae y Fabaceae, con influencia de especies exóticas. En Carapeguá, el área de estudio corresponde a una isla de tierra firme rodeada de embalsados de vegetación, donde se realiza ganadería y producción agrícola para autoconsumo. El suelo es rocoso y existen remanentes de bosques subhúmedos semicaducifolios y bosques higrófilos con dominancia de especies de la familia Phytolacaceae, Rutaceae, Cannabaceae y Fabaceae; bordeando la isla se encuentran las sabanas de humedales conformadas por embalsados, vegetación flotante (dominancia de Pontederia sp.) y enraizada (dominancia de Cyperus giganteus). El punto de muestreo situado en Quiindy se caracteriza por un suelo mayormente rocoso, con implantación de Brachiaria brizantha para el engorde de ganado. Dentro del área estudiada existen bosques subhúmedos semicadufolios e higrófilos con dominancia de especies de la familia Fabaceae y Bignoniaceae; sabanas palmares de Copernicia alba y sabanas de humedales con dominancia de pirizales (Cyperus giganteus) y totorales (Typha sp.).
Colecta de datos
Los muestreos de herpetofauna se realizaron en diciembre de 2017, febrero y agosto de 2018 en Nueva Italia, enero, abril y noviembre de 2018 en Carapeguá, y junio, setiembre de 2018 y febrero de 2019 en Quiindy. En cada uno de estos meses se realizó un esfuerzo de muestreo de cinco días, resultando un esfuerzo de muestreo total de 45 días. El equipo de investigadores de campo estuvo compuesto por cuatro personas (los primeros cuatro autores).
Las técnicas de muestreo aplicadas fueron búsqueda activa visual y auditiva, elaboración de listas MacKinnon, instalación de trampas pozo en el suelo y redes de embudo en los cuerpos de agua. La búsqueda activa, visual y auditiva [Citation24] consistió en recorrer los sitios de muestreo, removiendo troncos y rocas, y observando huecos que sirven como potenciales refugios. Los recorridos se realizaron cubriendo los diferentes tipos de vegetación, tanto de día, como en horario crepuscular y nocturno, durante un promedio de 2–3 horas de búsqueda diurna y 2–3 horas de búsqueda nocturna, abarcando de 1 a 3 km en cada recorrido. Esta técnica de muestreo se combinó con la elaboración de listas MacKinnon en el caso de los anuros para estandarizar el esfuerzo de muestreo y construir las curvas de acumulación de especies. Estas listas se usan con más frecuencia en los estudios sobre aves, pero ya fueron aplicadas en estudios sobre anfibios [Citation25,Citation26] Las listas consistieron en la detección y registro de cinco especies observadas y/o escuchadas, sin repetición de especies en una misma lista, pero sí entre listas. Se registró la hora al iniciar y al concluir cada lista. En Nueva Italia y en Quiindy se realizaron 39 listas y en Carapeguá, 49.
Se instalaron tres trampas pozo en cada sitio de muestreo (nueve en total), a una distancia mínima de 300 m entre sí, siguiendo a Cechin y Martins [Citation27]. Cada trampa estuvo integrada por cuatro baldes plásticos de 20 l de capacidad, dispuestos en línea recta y distanciados por 5 m. El cerco de conducción que actuó de barrera para guiar a los anuros y reptiles al pozo consistió en un plástico transparente, de 25 m de largo y 1 m de ancho. Dicho cerco se sujetó a los alambrados existentes con la finalidad de evitar la obstrucción en zonas de circulación de pobladores y ganado. Los baldes fueron perforados a 3 cm de la base, para facilitar su desagote en caso de lluvia y se mantuvo en los mismos una pequeña cantidad de agua para evitar que los individuos capturados se deshidraten [Citation27].
En los cuerpos de agua se instalaron una red de embudo de 3,5 m con una valla de 5 m y dos redes de embudo sin vallas, de 85 cm de largo. Estas redes se cebaron con trozos de carne o sardina para aumentar su efectividad. Las revisiones tanto de las trampas pozo como de las redes se realizaron cada 24 h.
Los animales registrados se fotografiaron en su hábitat y antes del proceso de curación. Parte de los animales registrados se colectaron para ejemplares de referencia, siendo anestesiados por inmersión en alcohol diluido al 10% en el caso de los anuros, y por inyección de alcohol puro en el foramen magnum en el caso de los reptiles, y posteriormente formolizados con formaldehído 4% [Citation28]. Los ejemplares se depositaron en la Colección Zoológica de la Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de Asunción (CZCEN N° 1319–1589). El permiso de colecta de anuros y reptiles fue otorgado por el Ministerio del Ambiente y Desarrollo Sostenible (Permiso N° 244/2017).
La identificación de las especies de anuros se basó en Weiler et al. [Citation29] y Lavilla et al. [Citation30] y la de los reptiles en Bergna & Alvarez [Citation31], Cacciali & Mercolli [Citation32], Cei et al. [Citation33], Cei [Citation34], Passos et al. [Citation35], Perez et al. [Citation36], Scott et al. [Citation37] y Vanzolini [Citation38]. La actualización taxonómica se realizó consultando las bases de datos Amphibian Species of the World [Citation39] y The Reptile Database [Citation40].
Los datos de precipitación, humedad y temperatura mensual se obtuvieron del Centro Meteorológico Nacional de Paraguay. En el caso de la humedad y la temperatura se utilizaron los promedios correspondientes a los días de muestreo y en cuanto a los datos de precipitación, se estimó la precipitación acumulada durante los 30 días previos e incluyendo los días de muestreo.
Análisis de datos
El análisis de la diversidad alfa y gamma se realizó a través de curvas de acumulación de especies. Adicionalmente para la diversidad alfa se calcularon los estimadores de riqueza no paramétricos Chao 2, Jack 1 y Jack 2, siendo la unidad de esfuerzo la cantidad de listas MacKinnon para anuros y los días de muestreo para el caso de reptiles. La diversidad beta fue estimada entre los sitios de muestreo para los dos ensambles con el índice Jaccard. Estos análisis fueron realizados con el software EstimateS 9.1.0 [Citation41]. También se realizó el cálculo de diversidad gamma basada en la riqueza de especies según la fórmula propuesta por Lande [Citation42], para entender el valor de la contribución de la diversidad alfa y beta, utilizando el peso proporcional de cada sitio basado en la superficie que abarcó el muestreo.
La abundancia relativa de anuros se calculó como el índice de frecuencia de cada especie en la lista (número de listas en la cual las especies fueron registradas/número total de listas) [Citation43]. Las especies fueron clasificadas como muy frecuentes (> 50%), frecuentes (50–25%) y raras (< 25%) siguiendo a De Melo et al. [Citation25]. La abundancia relativa de los reptiles se obtuvo a partir del total de registros (individuos observados y capturados en las trampas pozo), y fueron clasificadas según Duellman [Citation44] en: rara, cuando se registran uno o dos ejemplares, moderadamente abundante si se observan de tres a cinco ejemplares, y abundante cuando se encuentran más de cinco ejemplares.
Se utilizó el coeficiente de correlación no paramétrico de Spearman (rs) [Citation45] con significancia del 5% para verificar la existencia de relación entre las variables ambientales: temperatura promedio, humedad promedio y precipitación acumulada, con la riqueza de especies registradas en cada muestreo, mediante el software Past 3.02a [Citation46].
Resultados
Diversidad gamma
La riqueza y composición de anuros de los humedales del Ypoá registrada corresponde a 31 especies de seis familias y 17 géneros. Las familias de anuros representadas por más especies fueron Hylidae y Leptodactylidae. En cuanto a reptiles se registraron 19 especies pertenecientes a ocho familias y 17 géneros, siendo dominante la familia Colubridae. Se registraron sólo tres especies de lagartos, una especie de anfisbénido y una especie de caimán ().
Tabla 1. Abundancia, composición y riqueza de especies de anuros y reptiles registradas en tres sitios de muestreo en los humedales del Complejo Ypoá. NI: Nueva Italia, Ca: Carapeguá, Qui: Quiindy. Abundancia de anuros: basada en el número de listas de registro de la especie por sitio y él índice de frecuencia en listas MacKinnon. Abundancia de reptiles: basada en el número de individuos registrados. MF: muy frecuente, FRE: frecuente, RAR: rara, NRL: no registrada en listas, ABU: abundante, MA: moderadamente abundante.
Table 1. Abundance, composition and species richness of anurans and reptiles recorded at three sampling sites in the wetlands of the Ypoá Complex. NI: Nueva Italia, Ca: Carapeguá, Qui: Quiindy. Abundance of anurans: based on the number of lists where it was recorded per site and the frequency index in MacKinnon lists. Abundance of reptiles: based on the number of individuals recorded. MF: very frequent, FRE: frequent, RAR: rare, NRL: not recorded in lists, ABU: abundant, MA: moderately abundant
Tres especies, Leptodactylus chaquensis, Polychrus acutirostris y Xenodon merremi se registraron en forma ocasional en el distrito de Nueva Italia, después de finalizado el periodo de muestreo sistemático, por lo que no fueron incluidos en los análisis comparativos. Incluyendo estos datos, la riqueza total para el área de estudio es de 32 especies de anuros y 21 especies de reptiles.
Los estimadores de riqueza y la curva de acumulación mostraron que el ensamble de anuros estuvo bien representado por el muestreo aplicado, ya que hay una tendencia a la estabilización en las curvas de acumulación y la riqueza registrada corresponde al 89% de la riqueza estimada promedio (). En el caso del ensamble de reptiles, las curvas de acumulación no alcanzan la asíntota, y la riqueza estimada promedio es de 59%, indicando que aún es posible registrar nuevas especies para el área estudiada ().
Figura 2. Curvas de acumulación de especies para anuros (a) y reptiles (b) mostrando la riqueza de especies observada y los estimadores de riqueza. Esfuerzo de muestreo = muestreos mensuales (diversidad gamma).
Figure 2. Species accumulation curves for anurans (a) and reptiles (b) showing observed species richness and estimators. Sampling effort = number of field trips (gamma diversity).
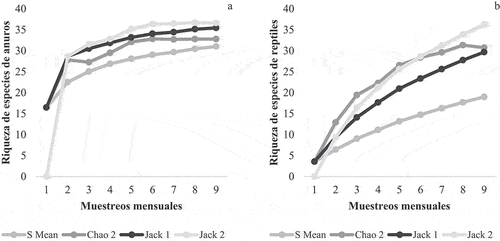
En cuanto a la detección de especies por técnica de muestreo, la mayoría de los anuros se registraron a través de las listas MacKinnon, excepto Dermatonotus muelleri, registrada sólo en trampas pozo y Pithecopus azureus únicamente por búsqueda activa. En cuanto a reptiles, la mayoría de las especies se registraron a través de búsqueda activa, a excepción de Aspronema dorsivitatum, Ameiva ameiva, Amerotyphlops brongersmianus y Bothrops alternatus, registradas en trampas pozo. Las redes de embudo permitieron la captura de Caiman yacare y Helicops leopardinus, registradas también a través de búsqueda activa. Hydrodynastes gigas fue registrada a través de una foto tomada por un poblador, durante el periodo de muestreo.
Diversidad alfa
Considerando la riqueza en cada sitio de muestreo, en Nueva Italia se registraron 24 especies de anuros y ocho de reptiles, en Carapeguá 17 especies de anuros y 10 de reptiles, y en Quiindy 27 especies de anuros y cinco de reptiles.
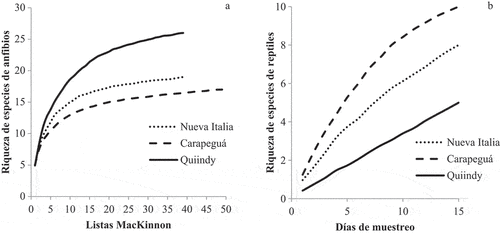
Al igual que en el análisis regional, a nivel local las curvas de acumulación de anuros en relación a la cantidad de listas MacKinnon por sitio de muestreo están próximas a la asíntota ().Sin embargo, las curvas de acumulación de riqueza de reptiles por día de muestreo no alcanzan la asíntota, sugiriendo que a mayor esfuerzo aumentará la riqueza de especies por sitio ().
Figura 3. Curvas de acumulación de la riqueza de especies en los tres sitios de muestreo (diversidad alfa): Riqueza acumulada de especies de anuros en relación a las listas MacKinnon (a) y riqueza acumulada de especies de reptiles por día de muestreo (b).
Figure 3. Figure Species accumulation curves of the three sampling sites (alpha diversity): Species accumulated richness of anuran species in relation to MacKinnon lists (a) and species accumulated richness of reptile species per sampling day (b).
Diversidad beta
La similitud en la composición de comunidades resultó mayor en los ensambles de anuros, y muy baja en la comparación de los ensambles de reptiles. El índice de Jaccard varío de 0.571 a 0.708, en la comparación de los ensambles de anuros entre sitios de muestreo. Los ensambles de reptiles son muy diferentes entre sí, según el índice de Jaccard, que varía de 0.071 a 0.182 ().
Tabla 2. Diversidad beta (Índice de Jaccard) de anfibios y reptiles entre sitios de muestreo.
Table 2. Beta diversity (Jaccard index) of amphibians and reptiles between sampling sites
Contribución de las diversidades alfa y beta a la diversidad gamma
El índice de diversidad gamma estimada para los anuros en el área estudiada fue 27.060, del cual la diversidad alfa comprende el 84% y la diversidad beta el 16%. En cuanto al índice estimado para los reptiles fue 21.341, siendo la contribución de la diversidad alfa 36% y de la diversidad beta 64%.
Abundancia
La abundancia medida según el índice de frecuencia en listas MacKinnon en los tres sitios de muestreo, muestran que una especie de anuro es considerada muy frecuente, nueve son frecuentes y el resto de las especies son raras (). En cuanto a reptiles, tres especies son abundantes, dos especies son moderadamente abundantes y las restantes son raras ().
Variación temporal y relación de la riqueza de especies con la temperatura, la humedad y la precipitación
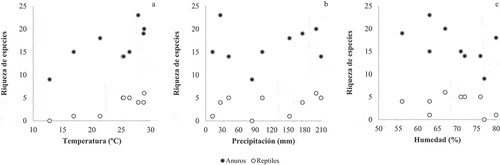
La temperatura del aire en el periodo de estudio osciló entre 12 y 29 °C, siendo los meses más calurosos diciembre, enero y febrero. La humedad varió de 56 a 80% y la precipitación entre 12 a 210 mm. El mayor número de especies se registró en febrero de 2018 y 2019 y el menor en junio de 2018. Sólo se registró una correlación positiva y significativa entre la riqueza de especies de anuros y de reptiles con la temperatura del aire (rs = 0.73, p < 0.05; rs = 0.72, p < 0.05, respectivamente), no existiendo correlación significativa entre la riqueza de especies con la humedad y la preciptación ().
Figura 4. Riqueza de especies de anuros y reptiles registradas mensualmente en relación a la temperatura promedio (a), la humedad promedio (b) y la precipitación acumulada (c), en los humedales del Complejo Ypoá.
Figure 4. Figure Species richness of anurans and reptiles in relation to the the monthly temperature and monthly humidity, and the accumulated rainfall, in the wetlands of the Ypoá Complex.
Discusión
En los humedales del Ypoá están representadas el 37% de las especies de anuros y el 11% de las especies de reptiles que se distribuyen en Paraguay [Citation47,Citation48]. Con este trabajo se aportaron por primera vez ejemplares de referencia para 22 especies de anuros y 15 especies de reptiles (Material suplementario). De las 53 especies que componen los ensambles de anuros y reptiles de los humedales del Ypoá, 13 constituyen nuevos registros a nivel departamental en Paraguay [Citation49,Citation50] y dos especies están categorizadas como Vulnerable a nivel nacional: Melanophryniscus paraguayensis [Citation47] y Atractus reticulatus [Citation48],
Las curvas de acumulación y los estimadores de riqueza muestran, tanto a nivel local (diversidad alfa) como regional (diversidad gamma), que el muestreo fue eficiente para los ensambles de anuros, pero no para los de reptiles. Teniendo en cuenta que, para este último grupo, hay varios registros basados en un único individuo, se espera encontrar nuevos taxones conforme se aumente el esfuerzo de muestreo. Probablemente, esto influyó en la estimación de la diversidad beta de los ensambles de reptiles, que presentó valores altos. Así mismo, se denotó que la principal contribución a la diversidad gamma proviene de la diversidad local en el caso de los anuros, coincidiendo con lo concluido en otras comunidades de animales, como mamíferos en Argentina, en moluscos de agua dulce del Sur de Brasil, y en pseudoescorpiones en México [Citation51–53]. Sin embargo, en los ensambles de reptiles, fue mayor la contribución de la diversidad beta a la diversidad regional. Ochoa-Ochoa et al. [Citation54] demostraron que en México la diversidad beta es mayor en anfibios y reptiles, comparada con las aves y mamíferos, a diferentes escalas y en regiones con características históricas y ambientales diferentes. Así mismo, Frazao et al. [Citation55] indicaron que las serpientes tienen una detectabilidad baja, a pesar de realizar un esfuerzo de muestreo grande, lo que afecta las estimativas de diversidad beta. Esto demuestra la importancia de trabajar en diferentes escalas al estudiar la biodiversidad de grandes áreas.
La riqueza específica de anfibios está incluida dentro de los valores registrados para otros humedales importantes de la región, como los esteros del Iberá en Argentina, cuya riqueza es de 28 especies en el borde oriental, según Ingaramo et al. [Citation56] y 26 especies en el sector suroeste [Citation21]. Curi et al. [Citation57] en la provincia de Corrientes registraron 27 especies de anuros en ambientes inundables, y Pansonato et al. [Citation58] registraron en un estudio en el Pantanal Brasilero una riqueza de 34 especies de anfibios. El número de especies de anuros registradas en la Reserva Natural Laguna Blanca, localizada en el departamento San Pedro de Paraguay, coincide con la registrada en los humedales del Ypoá, aunque la riqueza de reptiles (57 especies), es notablemente mayor [Citation59], probablemente por diferentes estrategias de muestreo y afinidades biogeográficas de estas especies. Así mismo, en la Reserva Natural del Iberá se registró una mayor riqueza del Orden Squamata (33 especies de serpientes, lagartos y anfisbénidos), utilizando la técnica de muestreo por cuadrantes con un esfuerzo de muestreo de 64 días [Citation60].
En relación a la abundancia de las especies, 10 de las 32 especies de anuros registradas (31%) y cinco de las 21 especies de reptiles registradas (24%) son consideradas abundantes. Esta abundancia medida a través de la frecuencia de registros depende de la detectabilidad de las especies de anuros y reptiles y de los meses de muestreo en cada sitio. Se confirma que existe una población abundante de Melanophryniscus paraguayensis en dos de los sitios de muestreo (Nueva Italia y Quiindy). Esta especie es endémica de Paraguay y categorizada a nivel nacional como “Vulnerable” [Citation47]. En cuanto a reptiles, la serpiente con más registros fue Thamnodynastes hypoconia. En los pirizales de Carapeguá, se contó en una sola noche ocho individuos. Esto contrasta con Cei et al. [Citation33], quienes describen esta especie y la caracterizan como serpiente de hallazgo poco frecuente. Sin embargo, Bellini et al. [Citation61] reportan que se pueden encontrar muchos individuos en los meses más calurosos en los humedales que habitan.
En este trabajo se comprobó que existe correlación entre la temperatura y la riqueza de especies de anuros y reptiles en cada mes de muestreo, coincidiendo con Zaracho y Lavilla [Citation21], quienes registraron una relación positiva entre la riqueza de especies de anfibios en actividad de vocalización con la temperatura, y con França et al. [Citation23] y Zanella et al. [Citation22], quienes encontraron una asociación positiva entre riqueza de serpientes y la temperatura en los meses de muestreo.
Sin embargo, Piatti et al. [Citation20] encontraron una relación positiva entre riqueza de especies de anfibios y precipitación, pero no con la temperatura, en agroecosistemas arroceros del Pantanal Brasileño y Jofré et al. [Citation62] no encontraron relación entre la riqueza de especies de anuros y las variables temperatura, humedad y precipitación, en reservorios de agua en Argentina.
A pesar del esfuerzo de muestreo aplicado, es importante continuar con estudios sobre la herpetofauna de los humedales del Complejo Ypoá, especialmente para el grupo de los reptiles, cuyas estimativas de riqueza aún son bajas en relación a lo esperado por los estimadores. Las trampas pozo demostraron ser útiles para registrar especies de este grupo, cuya captura por búsqueda activa es difícil. Se recomienda que al utilizar trampas pozo, las mismas puedan estar activas el máximo tiempo posible, utilizando baldes de mayor volumen. Otra limitante de este trabajo es que, si bien los humedales del Complejo Ypoá tienen categoría de Reserva de Recursos Manejados declaradas por ley, están completamente bajo dominio privado, por lo que el acceso a los humedales se encuentra supeditado a la voluntad de los dueños de las tierras, lo que dificulta la aplicación de un muestreo que cubra en forma más representativa estos humedales.
Los humedales del Complejo Ypoá albergan un ensamble de anuros y reptiles expuesto a amenazas como la quema, la cacería y la modificación de hábitats, producto de las actividades agrícola-ganaderas y la urbanización creciente en la zona. Por todo lo expuesto, consideramos que, para planificar estrategias de conservación efectivas, debe considerarse la diversidad estimada tanto a escala local como regional, ya que en este trabajo se demostró que la diversidad gamma es complementada de forma variable por las diversidades alfa y beta en anuros y reptiles.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología que financió este proyecto a través de PROCIENCIA (Proyecto PINV15-820). A los propietarios de las tierras que nos permitieron acceder a los sitios de muestreo y a los pobladores de la zona. A los colaboradores de los muestreos de campo: N. Cantero, K. Chávez, J. López y R. Ayala. Al Centro Meteorológico Nacional por cedernos los datos climáticos utilizados en este trabajo.
Supplemental Material
Download MS Word (18.8 KB)Disclosure statement
No potential conflict of interest was reported by the author(s).
Supplementary material
Supplemental data for this article can be accessed here.
Additional information
Funding
References
- Mereles F. Aportes al conocimiento de la flora y las comunidades vegetales en la cuenca del lago Ypoá, región Oriental, Paraguay. Miscelánea. 2005;14:159–168.
- García J. Factores críticos de los Humedales del Ypoá desde el Departamento de Paraguarí. Revista técnica infoambiente. 2013;1:37–42.
- Mereles F. El Lago Ypoá: características generales y acciones de conservación necesarias. Revista técnica infoambiente. 2013;1:11–20.
- Mereles F. Humedales y bosques inundados. Rojasiana. 1993;1:21–32.
- Mereles F. Los humedales del Paraguay: principales tipos de vegetación. In: Salas D, Mereles F, Yanosky A, editors. Humedales del Paraguay. Asunción: Comité Nacional de Humedales; 2004. p. 67–88.
- Mereles F. La diversidad, los usos y la conservación de las especies vegetales en los humedales del Paraguay. Rojasiana. 2006;7:171–185.
- Yanosky A, Cartes J, Del Castillo H, et al. La biodiversidad del Lago Ypoá. Revista técnica infoambiente. 2003;1:21–32.
- Cartes J. Importancia de la conservación de los humedales para los mamíferos. In: Salas D, Mereles F, Yanosky A, editors. Humedales del Paraguay. Asunción: Comité Nacional de Humedales; 2004. p. 141–157.
- Brusquetti F, Lavilla E. Lista comentada de los anfibios de Paraguay. Cuad Herpetol. 2006;20:3–79.
- Cacciali P, Scott NJ, Aquino Ortíz LA, et al. The reptiles of Paraguay: literature, distribution, and an annotated taxonomic checklist. Spec Publ Museum Southwest Biol. 2016;11:1–373.
- Gibbons J, Scott D, Ryan T. The Global Decline of Reptiles, Deja Vu Amphibians. Bioscience. 2000;50:653–666.
- Beebee T, Griffiths R. The amphibian decline crisis: a watershed for conservation biology? Biol Conserv. 2005;125:271–285.
- Whitfield S, Bell K, Philippi T, et al. Amphibian and reptile declines over 35 years at La Selva, Costa Rica. Proc Natl Acad Sci. 2007;104:8352–8356.
- Valencia-Aguilar A, Cortés-Gómez A, Ruiz-Agudelo C. Ecosystem services provided by amphibians and reptiles in neotropical ecosystems. Int J Biodivers Sci Ecosyst Serv Manag. 2013;9:257–272.
- Cortés-Gomez A, Ruiz-Agudelo C, Valencia-Aguilar A, et al. Ecological functions of neotropical amphibians and reptiles: a review. Univ Sci. 2015;20:229–245.
- Moreno C. Métodos para medir la biodiversidad. Zaragoza: M&T–Manuales y Tesis SEA; 2001.
- Whittaker RH. Evolution and measurement of species diversity. Taxon. 1972;21:213–251.
- Wells KD. The ecology and behavior of amphibians. Chicago: University of Chicago Press; 2007.
- Vitt J, Caldwell J. Herpetology: an introductory biology of amphibians and reptiles. California: Academic Press Elsevier; 2014.
- Piatti L, Souza F, Filho L. Anuran assemblage in a rice field agroecosystem in the Pantanal of central Brazil. J Nat Hist. 2010;44:1215–1224.
- Zaracho V, Lavilla E. Diversidad, distribución espacio-temporal y turnos de vocalización de anuros (Amphibia, Anura) en un área ecotonal del Nordeste de Argentina. Iheringia Série Zool. 2015;105:199–208.
- Zanella N, de Paula A, Guaragni SA, et al. Herpetofauna do Parque Natural Municipal de Sertão, Rio Grande do Sul, Brasil. Biota Neotrop. 2013;13(4):290–298.
- França DPF, de Freitas MA, Ramalho WP, et al. Diversidade local e influência da sazonalidade sobre taxocenoses de anfíbios e répteis na Reserva Extrativista Chico Mendes, Acre, Brasil. Iheringia Série Zool. 2017;107:1–12.
- Crump M, and Scott N Relevamientos por encuentros visuales. In: Heyer R, Donnelly M, and McDiarmid L, editors. Medición y monitoreo de la diversidad biológica - Métodos estandarizados para anfibios. Comodoro Rivadavia: Editorial Universitaria de la Patagonia; 2001. p. 80–87.
- De Melo Moura CC, de Lira Neves RM, Almeida Silva PH, et al. The anuran fauna of a semi-arid Caatinga area in northeastern Brazil. Salamandra. 2016;52(3):278–282.
- Muir A, Muir M. A new rapid assessment technique for amphibians: introduction of the species list technique from San José de Payamino, Ecuador. Herpetol Rev. 2011;42:184–187.
- Cechin S, Martins M. Eficiência de armadilhas de queda (pitfall traps) em amostragens de anfíbios e répteis no Brasil. Rev Bras Zool. 2000;17:729–740.
- Cacciali P. Colecta y preparación de anfibios y reptiles- Manual para colecta científica. Saarbrucken: Editorial Académica Española; 2013.
- Weiler A, Nuñez K, Airaldi K, et al. Anfibios del Paraguay. San Lorenzo: Facultad de Ciencias Exactas y Naturales - Universidad de Salamanca; 2013.
- Lavilla E, Caballero-Gini A, Bueno-Villafañe, et al. Notes on the distribution of the genus Pseudopaludicola Miranda-Ribeiro,1926 (Anura: Leptodactylidae) in Paraguay. Check List. 2016;12:1–9.
- Bergna S, Alvarez B. Descripción de una nueva especie de Thamnodynastes (Reptilia: Serpentes, Colubridae) del Nordeste Argentino. Facena. 1993;10:5–18.
- Cacciali P, Mercolli C. Guía para la identificación de 60 Serpientes del Paraguay. Asunción: Guyra Paraguay; 2009.
- Cei J, Bergna S, Alvarez B. Nueva combinación para el género Thamnodynastes (Serpentes, Colubridae) de Argentina. Facena. 1992;9:123–134.
- Cei J. Reptiles del Noroeste, Nordeste y Este de la Argentina: herpetofauna de las Selvas Subtropicales, Puna y Pampas. Torino: Museo Regionale Di Scienze Naturali; 1993.
- Passos P, Fernandes R, Bérnils R, et al. Taxonomic revision of the Brazilian Atlantic Forest Atractus (Reptilia: Serpentes: Dipsadidae). Zootaxa. 2010;2364:1–63.
- Perez R, Ribeiro S, Borges-Martins M. Reappraisal of the taxonomic status of Amphisbaena prunicolor (Cope 1885) and Amphisbaena albocingulata Boettger 1885 (Amphisbaenia: Amphisbaenidae). Zootaxa. 2012;3550:1–25.
- Scott N, Giraudo A, Scrocchi G, et al. The genera Boiruna and Clelia (Serpentes: Pseudoboini) in Paraguay and Argentina. Pap Avulsos Zool. 2006;46:77–105.
- Vanzolini PE. An aid to the identification of the South American species of Amphisbaena (Squamata, Amphisbaenidae). Pap Avulsos Zool. 2002;42:351–362.
- Frost DR Amphibian Species of the world: an online reference. Version 6.0. [Internet]. New York (NY): American Museum of Natural History. [updated 2021; cited 2021 Jun 25]. Available from: http://research.amnh.org/herpetology/amphibia/index.html
- Database R, Uetz P, Freed P, et al. The reptile database. Reptil Database. [Internet]. [updated 2021; cited 2021 Jun 25]. Available from: http://www.reptiledatabase.org/
- Colwell RK. EstimateS: statistical estimation of species richness and shared species from samples. Versión 9.1.0. 2013.
- Lande R. Statistics and partitioning of species diversity, and similarity among multiple communities. Oikos. 1996;76:5–13.
- Mackinnon J. Field guide to the birds of Java and Bali. Yogyakarta: Gadjah Mada University Press; 1991.
- Duellman E. A biogeographic account of the herpetofauna of Michoacán, México. Univ Kansas Publ Museum Nat Hist. 1965;15:1–82.
- Zar JH. Biostatistical Analysis. New Jersey: Prentice Hall; 2010.
- Hammer Ø, Harper D, and Ryan P. PAST: Paleontological statistics software package for education and data analysis. Palaeontol Electron. 2001;4(1): 9.
- Motte M, Zaracho V, Caballero-Gini A, et al. Estado de conservación y lista roja de los anfibios del Paraguay. Bol Mus Nac Hist Nat Parag. 2019;23(1):1–62.
- Martínez N, Cacciali P, and Bauer F, et al. Estado de conservación y lista roja de los reptiles del Paraguay . Bol Mus Nac Hist Nat Parag. 2020;24(1):1–128.
- Zárate G, Núñez K, Ortiz F, et al. Nuevos registros para la herpetofauna de los departamentos Central y Paraguarí, procedentes de humedales asociados al Complejo Ypoá, Paraguay. Bol Mus Nac Hist Nat Parag. 2019;23(1):27–37.
- Mendoza M, Núñez K, Zárate G, et al. Ampliación de la distribución de Atractus reticulatus (Boulenger, 1885) (Reptilia: Serpentes: Dipsadidae) en Paraguay. Cuad Herpetol. 2020;34:131–133.
- Rimoldi P, Chimento N. Diversidad de mamíferos nativos medianos y grandes en la cuenca del río Carcarañá, provincia de Santa Fe (Argentina). Rev Mus Argent Cienc Nat. 2018;20:333–341.
- Martello A, Alcemar R, Hepp L, et al. Distribution and additive partitioning of diversity in freshwater mollusk communities in Southern Brazilian streams. Rev Biol Trop. 2014;62:47–58.
- Jiménez-Hernández V, Villegas-Guzmán G, Casasola-González J, et al. Altitudinal distribution of alpha, beta, and gamma diversity of pseudoscorpions (Arachnida) in Oaxaca, Mexico. Acta Oecologica. 2020;103:103525.
- Ochoa-Ochoa LM, Munguía M, Noriega AL, et al. Spatial scale and β-diversity of terrestrial vertebrates in Mexico. Rev Mex Biodivers. 2014;85:918–930.
- Frazão L, Oliveira ME, Menin M, et al. Species richness and composition of snake assemblages in poorly accessible areas in the Brazilian Amazonia. Biota Neotrop. 2020;20(1):1–19.
- Ingaramo M, Etchepare E, Álvarez B, et al. Riqueza y composición de la fauna de anuros en la región oriental de la Reserva Natural Provincial Esteros del Iberá, Corrientes, Argentina. Rev Biol Trop. 2012;60:759–769.
- Curi L, Céspedez J, Álvarez B. Composición, distribución espacial y actividad de vocalización de un ensamble de anuros dentro de la región fitogeográfica del Chaco Oriental. Rev Mex Biodivers. 2014;85:1197–1205.
- Pansonato A, Mott T, Strussmann C. Anuran amphibians diversity in a Northwestern area of the Brazilian Pantanal. Biota Neotrop. 2011;11:77–86.
- Smith P, Atkinson K, Brouard JP, et al. Reserva Natural Laguna Blanca, Departamento San Pedro: Paraguay’s first important area for the conservation of amphibians and reptiles? Russ J Herpetol. 2016;23(1):25–34.
- Etchepare E, Ingaramo M, Porcel E, et al. Diversidad de las comunidades de escamados en la Reserva Natural del Iberá, Corrientes, Argentina. Rev Mex Biodivers. 2013;84:1273–1283.
- Bellini G, Arzamendia V, Giraudo A. Ecology of Thamnodynastes hypoconia in Subtropical – temperate South America. Herpetologica. 2013;69:67–69.
- Jofré M, Cid F, Caviedes-Vidal E. Spatial and temporal patterns of richness and abundance in the anuran assemblage of an artificial water reservoir from the semiarid central region of Argentina. Amphib reptil. 2010;31:533–540.
