RESUMEN
Los murciélagos colicortos Carollia brevicaudum y C. perspicillata son dos de las especies de filostómidos más abundantes y ampliamente distribuidos en el Neotrópico. Debido a esto, diversos autores han encontrado variación intraespecífica a lo largo de su distribución, principalmente en tamaño corporal y coloración. Dado a que no hay un consenso en la magnitud de la variación intraespecífica, en este estudio evaluamos los patrones de variación de siete poblaciones de C. brevicaudum (n = 185) y C. perspicillata (n = 190) de poblaciones de Perú y Ecuador. Las poblaciones se delimitaron en base a las principales cuencas, río Amazonas y Andes. Se emplearon 26 medidas cráneo-mandibulares y se aplicaron análisis univariados, multivariados y de conglomerados. Nuestros resultados sugieren que hay diferencias morfométricas significativas entre determinados pares de poblaciones de ambas especies, pero ninguna es soportada consistentemente por todos los análisis. La amplia superposición de las poblaciones evaluadas en ambas especies sugiere una complejidad morfológica no relacionada con las geografías evaluadas.
ABSTRACT
The short-tailed bats Carollia brevicaudum and C. perspicillata are two of the most abundant and widely distributed species of phyllostomids in the Neotropics. Many authors have found intraspecific variation throughout its distribution, mainly in body size and coloration. Since there is no consensus on the magnitude of intraspecific variation, in this study we assessed the variation patterns of seven populations of both C. brevicaudum (n = 185) and C. perspicillata (n = 190) from Peru and Ecuador. The populations were delimited by potential barriers of distribution such as the main eastern basins, the Amazonas River, and the Andes. We took 26 craniomandibular measurements and used univariate, multivariate, and cluster analyses. We found significant morphometric differences between certain pairs of populations of both species, but none are supported by all the analyses. The broad overlap of the variables in the populations evaluated of both species suggests a morphological complexity not related to the assessed geographies.
Palabras claves:
Introducción
Los murciélagos colicortos de las especies Carollia brevicaudum (Schinz, 1821) y Carollia perspicillata (Linnaeus, 1758) de la familia Phyllostomidae son las más comunes del género [Citation1–3], con distribuciones amplias que van desde Panamá hasta el sur de Brasil y desde México hasta el sur de Brasil y norte de Argentina, respectivamente; y en diferentes hábitats a ambos lados de los Andes y un rango de elevación que va hasta 2500 m aproximadamente [Citation2,Citation4,Citation5]. Aunque ambas especies son parecidas, diversos autores han podido discriminarlas mediante métodos morfológicos y moleculares [Citation1,Citation4–11].
A nivel intraespecífico, diferentes autores han encontrado variabilidad morfológica a lo largo de la distribución de ambas especies, e.g. [Citation1,Citation4,Citation8,Citation10,Citation12,Citation13]. Pine [Citation1] basado en morfología y distribución, sugirió que C. perspicillata podría considerarse politípica y reconoció a tres subespecies: C. p. azteca (desde México hasta el occidente de los Andes), C. p. perspicillata (Amazonía) y C. p. tricolor (poblaciones al sur de su distribución en Sudamérica). Posteriormente, McLellan (1984) reexaminó los especímenes estudiados por Pine [Citation1] y mediante aproximaciones morfométricas describió variaciones sexuales y geográficas concluyendo que las subespecies de C. perspicillata reconocidas por Pine [Citation1] no eran discriminables morfométricamente. Con respecto a C. brevicaudum, ambos autores coincidieron en que era monotípica. Sin embargo, en el análisis de la variación intrapoblacional de las especies de Carollia, McLellan [Citation10] no consideró el efecto de grandes ríos o tipos de ecosistemas propuestos por otros autores para mamíferos como barreras biogeográficas y que podrían significar elementos importantes en la compresión de la variabilidad morfológica, e.g [Citation14–18].
Jarrín-V & Menendez-Guerrero [Citation12] empleando métodos morfogeométricos encontraron que estas dos especies en Ecuador fueron similares, tanto en tamaño como en forma del cráneo, mostrando superposición en su espacio ambiental. Empleando estos mismos métodos, López-Aguirre et al. [Citation8] no encontraron diferencias significativas entre poblaciones colombianas de cinco regiones geográficas en la forma y tamaño de la mandíbula, pero si en el cráneo, donde se encontró que especímenes andinos de C. brevicaudum fueron estadísticamente diferentes a los del Amazonas y el Caribe, mientras que los especímenes andinos de C. perspicillata fueron diferentes a los de la región del Pacífico. Los autores sugirieron que los Andes no actúan como una barrera sino como una región independiente tanto para C. brevicaudum como para C. perspicillata. Por otro lado, Barros et al. [Citation19] en poblaciones de Brasil, empleando métodos morfométricos clásicos, encontraron una disminución en tamaño hacia latitudes y altitudes mayores, y un aumento en tamaño en relación con el incremento de temperatura ambiental.
Aunque el estudio de la variación intraespecífica de C. brevicaudum y C. perspicillata ha sido un tópico estudiado en algunas poblaciones, aún no se ha probado si tanto Carollia brevicaudum como C. perspicillata presentan una estructura geográfica este-oeste en países Andinos. Por otro lado, los corredores ribereños utilizados diferencialmente por murciélagos para desplazarse tampoco han sido poco explorados en el estudio de su variabilidad [Citation20–22]. Trabajos clásicos que abordaron este tópico en otros murciélagos fueron los de Patterson et al. [Citation17] y Pacheco & Patterson [Citation14], quienes analizaron poblaciones peruanas de Artibeus fraterculus y Sturnira erythromos respectivamente, sugiriendo que estas especies eran capaces de dispersarse a través de los pasos bajos de los Andes como la Depresión de Huancabamba y que el río Marañón no influía en la variación.
Dado que la variación morfológica interpoblacional es un tópico poco explorado en murciélagos filostómidos [Citation10,Citation14,Citation23], y dado a que en Carollia no hay un consenso en la magnitud de la variación intraespecífica, en este estudio analizamos los patrones de variación geográfica de las poblaciones de Carollia brevicaudum y C. perspicillata de Perú y Ecuador, dos de las especies más ampliamente distribuidas y mejor representadas en colecciones, mediante métodos morfométricos univariados y multivariados y probar si los Andes, el río Amazonas o las principales cuencas hidrográficas orientales influyen en la variación intraespecífica.
Métodos
Muestras analizadas
Analizamos 375 especímenes adultos de las especies Carollia brevicaudum (n = 185) y C. perspicillata (n = 190) empleados por Ruelas [Citation4] procedentes de poblaciones peruanas y ecuatorianas y depositado en las colecciones de mamíferos del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (MUSM, Lima), Museo de Zoología de la Pontificia Universidad Católica del Ecuador (QCAZ, Quito) y Museo Ecuatoriano de Ciencias Naturales (MECN, Quito). El listado de los especímenes se encuentra en la Tabla S1.
Poblaciones
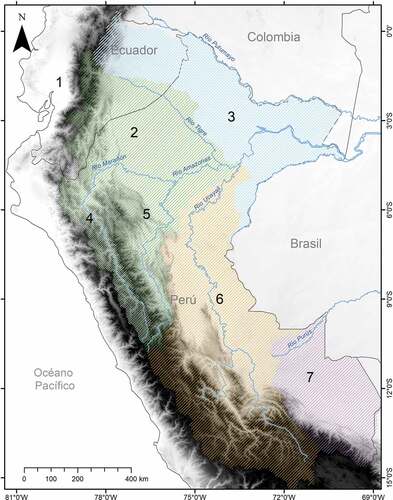
Para fines de este estudio, se definieron siete poblaciones para ambas especies considerando su distribución con relación a los Andes, el río Amazonas y las principales cuencas amazónicas peruanas: Población “occidente”, al occidente de los Andes del norte entre Perú y Ecuador; Población “Marañón N”, distribuida en la sección norte de cuenca alta del Marañón, respecto al río Amazonas; Población “Amazonas N”, distribuida en la sección norte de la cuenca del río Amazonas con límite en el Río Putumayo hasta el límite con la subcuenca del río Tigre; Población “Valle del Marañón”, distribuida en la cuenca media y alta del Marañón, incluyendo el Valle del Marañón; Población “Amazonas S”, distribuida en la sección sur de cuenca baja del río Marañón y al sur del Río Amazonas; Población “Ucayali”, distribuida en la cuenca del río Ucayali; y Población “Purús”, con distribución en la cuenca del Río Purús y Río Beni (). Debido a que los ríos son usados por murciélagos como corredores [Citation20,Citation22], las cuencas de los ríos se emplearon para delimitar las poblaciones.
Figura 1. Mapa de la delimitación de las poblaciones evaluadas de Carollia brevicaudum y C. perspicillata. Poblaciones: (1) “occidente”, (2) “Marañón N”, (3) “Amazonas N”, (4) “Valle del Marañón”, (5) “Amazonas S”, (6) “Ucayali”, (7) “Purús”. Las áreas sombreadas indican el límite de las principales cuencas: Cuenca alta y media del Río Marañón (verde), C. baja del Río Marañón (blanco), intercuenca del Amazonas (celeste), C. del Río Ucayali (naranja) y C. del Río Purús y Río Beni (morado). La descripción de la delimitación se encuentra descrita en Métodos.
Análisis morfométricos
Empleamos las 26 medidas cráneo-mandibulares consideradas por Ruelas [Citation4] para especies de Carollia tomadas usando un calibrador digital con un error de ±0.01 mm: longitud máxima del cráneo (LMC), no incluyendo incisivos; longitud basilar (BAL), del cóndilo occipital al borde anterior del alvéolo incisivo; ancho máximo de la caja craneal (AnC), sin incluir el proceso mastoideo o paroccipital; altura de la caja craneal (ACC), desde el basioccipital a lo más superior de la caja craneal sin incluir la cresta sagital; longitud cóndilo-incisiva (LCI), distancia entre los márgenes más posteriores de los cóndilos occipitales y el punto más anterior de los incisivos superiores; longitud cóndilo-canina (LCC), distancia entre los márgenes más posteriores de los cóndilos occipitales y la superficie más anterior de los caninos superiores; longitud palatal (LP), distancia entre parte más posterior del paladar y el borde más anterior de los alvéolos incisivos; ancho palatal (AnP), ancho postglenoideo (APG), ancho rostral (AnR), longitud ventral rostral (LVR), constricción postorbitaria (CP), anchura mínima de la constricción postorbital; ancho del foramen magnum (AFM), longitud de la hilera dental maxilar (LHM), distancia desde la superficie más anterior del canino superior hasta la superficie más posterior del tercer molar superior; distancia mínima interna entre los primeros molares superiores (M1M1); distancia mínima interna entre los segundos molares superiores (M2M2); distancia mínima interna entre los terceros molares superiores (M3M3); distancia máxima interna entre los segundos premolares superiores (P2P2); distancia máxima interna entre los caninos superiores (CC) ancho entre los márgenes linguales de los alvéolos de los caninos superiores; longitud mandibular (LM), distancia desde el punto medio del cóndilo mandibular hasta el punto más anterior del dentario; altura de la mandíbula (ALM), a nivel de la parte posterior del tercer molar inferior; longitud de la hilera dental mandibular (LHDM), distancia desde la superficie más anterior del primer incisivo inferior hasta la superficie más posterior de tercer molar inferior; altura del coronoides (APC), altura perpendicular desde el margen ventral de la mandíbula hasta la punta de la apófisis coronoides; distancia coronoide-angular (CAD), distancia entre la punta de la apófisis coronoides y la punta de la apófisis angular; longitud de la rama postdentaria (DCAM), desde el borde posterior del tercer molar inferior hasta la punta de la apófisis angular; y ancho máximo condilar (ACM), mayor distancia entre los extremos del cóndilo mandibular.
No se probó la variación intraespecífica debida al sexo ya que estudios previos indican que el aporte de éste es mínimo o poco significativo [Citation10,Citation13,Citation24]. Se probó la normalidad univariante mediante Shapiro-Wilk y la normalidad multivariante mediante la prueba de Royston. Luego, se realizó un Análisis de Varianza (ANOVA) para determinar la significancia estadística de cada variable y se empleó la prueba post hoc Tukey-Kramer [Citation25] para realizar comparaciones múltiples por pares para muestras desbalanceadas. Adicionalmente, la distribución de cada variable con distribución normal se visualizó mediante densidades de Kernel para cada población.
Las medidas fueron consideradas como variables dependientes y fueron transformadas a logaritmo natural. Se realizó un Análisis de Componentes Principales (ACP) basado en la matriz de varianza-covarianza para identificar las principales tendencias de variación de las poblaciones y un Análisis de Varianza (ANOVA) con la prueba post hoc Tukey-Kramer con los componentes que explicaron la mayor varianza. Finalmente, se realizó un Análisis de Función Discriminante para determinar las variables que permiten discriminar a las poblaciones asignadas a priori. Las relaciones de similaridad entre las poblaciones fueron analizadas empleando un análisis de conglomerados o UPGMA empleando el cuadrado de las distancias euclideanas a partir de las medias poblacionales. Este análisis produce un dendrograma que representa gráficamente la similaridad fenotípica entre las poblaciones. Todos los análisis se realizaron en R 3.6.1 [Citation26], para las pruebas de normalidad se empleó el paquete “MVN” [Citation27], para el ACP se empleó “ade4” [Citation28] y para la prueba de ANOVA y el post hoc Tukey-Kramer se empleó el paquete “DTK” [Citation25]. El valor de confianza fue de P < 0.05.
Resultados
Variación intraespecífica
En las y se presentan la estadística descriptiva a partir de 26 variables de cada una de las poblaciones de Carollia brevicaudum y C. perspicillata. Las variables en cada especie mostraron los valores de las medias y rangos comparativamente similares entre sus poblaciones. Por otro lado, en el set de C. brevicaudum, 18 variables presentaron normalidad univariante y 17 de éstas presentaron diferencias significativas: LMC, BAL, AnC, ACC, LCI, LCC, AnP, APG, AnR, CP, M1M1, M2M2, M3M3, P2P2, CC, LM y ALM (Tabla S2). Mientras que en el set de C. perspicillata, 19 variables presentaron normalidad univariante, de las cuales 15 presentaron diferencias significativas: LMC, BAL, LCI, LCC, LP, APG, M1M1, M2M2, M3M3, CC, LM, LHDM, APC, CAD y DCAM (Tabla S3).
Tabla 1. Medidas cráneo-mandibulares (en milímetros) de las poblaciones de Carollia brevicauda. Se muestra arriba la media y desviación estándar, seguido del tamaño de muestra entre paréntesis, abajo el rango máximo y mínimo. Ver Métodos para las abreviaciones de las medidas.
Tabla 2. Medidas cráneo-mandibulares (en milímetros) de las poblaciones de Carollia perspicillata. Se muestra arriba la media y desviación estándar, seguido del tamaño de muestra entre paréntesis, abajo el rango máximo y mínimo. Ver Métodos para las abreviaciones de las medidas.
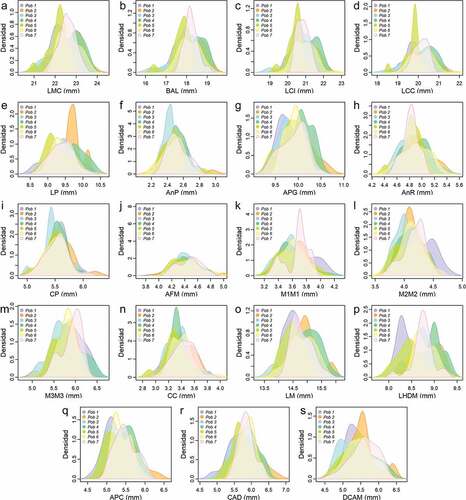
Variación interpoblacionalC. brevicaudum encontramos que de las 18 variables con distribución normal, 12 fueron significativamente diferentes al comparar la población “Purús” versus “Valle del Marañón” y diez comparando “Valle del Marañón” versus “Amazonas N” (ver Tabla S2). Mientras que, en las comparaciones entre las otras poblaciones se encontraron menos de ocho variables significativamente diferentes (<30.8 % del total de variables). Por otro lado, las comparaciones de las poblaciones “Marañón N” versus “occidente”, “Amazonas S” y “Ucayali”; “Amazonas S” versus “Valle del Marañón”; y “Purús” versus “Amazonas N” y “Ucayali”, no presentaron diferencias significativas (Tabla S2). En la comparación por pares de las poblaciones de C. perspicillata encontramos que 12 de las 19 variables con distribución normal fueron significativamente diferentes comparando “occidente” versus “Ucayali” y “Valle del Marañón”, y “Marañón N” versus “occidente” (ver Tabla S3). Las comparaciones entre las otras poblaciones presentaron menos de nueve variables estadísticamente diferentes (<47.4% del total de variables). Mientras que la comparación entre “Amazonas N” versus “Marañón N”; “Valle del Marañón” versus “Marañón N”; “Amazonas S” versus “Amazonas N”; y “Ucayali” versus “Amazonas N” y “Purús, no presentaron diferencias significativas (ver Tabla S3). No obstante, las gráficas de densidad de Kernel tanto para C. brevicaudum como para C. perspicillata, muestran superposición en la mayoría de las variables con diferencias significativas (, ), no obstante, la población “occidente” de C. brevicaudum se mostró ligeramente diferenciada del resto de poblaciones en seis variables (LMC, BAL, AnR, M2M2, LM y ALM) ().
Figura 2. Distribución de la densidad de Kernel de 18 medidas cráneo-mandibulares (en milímetros) con distribución normal de Carollia brevicaudum de Perú y Ecuador. Las abreviaciones se encuentran detalladas en Métodos.
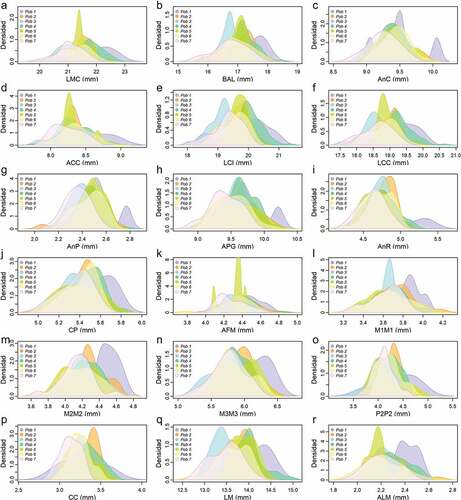
Figura 3. Distribución de la densidad de Kernel de 19 medidas cráneo-mandibulares (en milímetros) con distribución normal de Carollia perspicillata de Perú y Ecuador. Las abreviaciones se encuentran detalladas en Métodos.
Por otro lado, los sets de medidas de C. brevicaudum (H = 90.729, P = 1.09e-10) y C. perspicillata (H = 79.95414, P = 1.15e-08) no presentaron distribución normal multivariada siendo transformados a logaritmo natural para continuar con los análisis multivariados. En el ACP para las poblaciones de C. brevicaudum, los tres primeros componentes principales explicaron el 72.67 % de la varianza total, donde el componente principal 1 (CP1) explicó el 61.27 % de la varianza, todas las variables mostraron valores negativos y las que más aportaron en el componente fueron LMC, LCI y LCC; el componente principal 2 (CP2) representó el 6.09 % de la varianza y las variables que más aportaron fueron LP, M3M3 y DCAM, mientras que, el componente principal 3 (CP3) solo explicó el 5.31 % de la varianza y las variables LCC y DCAM fueron las que más aportaron (, ). Los autovalores del CP1 presentaron su autovalor asociado mayor que uno, los autovalores de los demás componentes fueron menores. Los resultados de ANOVA del CP1 encontraron diferencias significativas entre las poblaciones (F = 18.81, P < 2.2e-16); sin embargo, la prueba entre pares mostró que las diferencias significativas solo se dan al comparar las poblaciones “occidente” versus “Amazonas N”, “Ucayali” y “Purús”; “Marañón N” versus “Amazonas N” y “Purús”; “Valle del Marañón” versus “Amazonas N”, “Ucayali” y “Purús”, en los otros casos el nivel de significancia fue mayor de 0.05. Mientras que la distribución a lo largo del CP1 y CP2 todas las poblaciones se mostraron sobrepuestas (). El análisis de función discriminante recuperó seis variables discriminantes, donde los tres primeros representaron el 86.02% de la varianza total (). El discriminante lineal 1 (DL1) representó el 55.54 % y las variables que más contribuyeron a la discriminación fueron BAL, LCI y M1M1, mientras que el discriminante lineal 2 (DL2) representó el 18.52 % y el discriminante lineal 3 (DL3) el 11.96 %. En los morfoespacios 1 y 2 las poblaciones “occidente”, “Marañón N”, “Amazonas S”, “Ucayali” y “Purús” se mostraron sobrepuestas completamente, pero “Amazonas N” y “Valle del Marañón” se mantuvieron agrupadas ligeramente separadas del conglomerado de las otras poblaciones respecto al eje del CP1 (). Solo el 56.75 % de los especímenes fueron correctamente clasificados, donde la población “Valle del Marañón” fue la más distintiva con 91.78 % de especímenes correctamente asignados, seguida por “Amazonas N” con 60.00 %, “Purús” con 36.36 %, “Ucayali” con 34.38 %, “occidente” con 20.00 %, “Marañón N” con 18.18 % y “Amazonas S” con 16.67 % de especímenes correctamente clasificados.
Tabla 3. Porcentaje de varianza y coeficientes estandarizados de los primeros tres primeros autovectores de 26 variables empleadas en el PCA de las poblaciones de Carollia brevicauda y C. perspicillata. Ver Métodos para las abreviaciones de las medidas.
Tabla 4. Porcentaje de varianza y coeficientes estandarizados de los discriminantes lineares de 26 variables empleadas en el análisis de función discriminante de las poblaciones de Carollia brevicauda. Ver Métodos para las abreviaciones de las medidas.
Figura 4. Análisis de componentes principales ilustrando un plot del componente 1 versus 2 (izquierda) y discriminantes lineares 1 y 2 del análisis de función discriminante (derecha) de las poblaciones de Carollia brevicaudum (A, B) y C. perspicillata (C, D) analizados: “occidente” (cuadrados), “Marañón N” (círculos), “Amazonas N” (triángulos), “Valle del Marañón” (cruces), “Amazonas S” (equis), “Ucayali” (rombos) y “Purús” (asteriscos). Los porcentajes de varianza se muestran entre paréntesis.
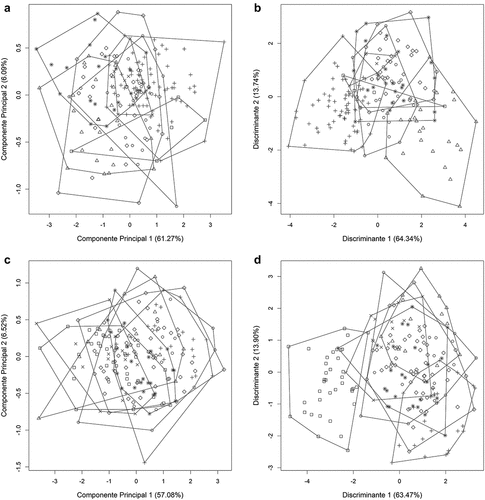
En el caso de C. perspicillata los tres primeros componentes explicaron el 69.29 % de la varianza total, donde el CP1 representó el 57.08 % de la varianza, todas las variables se mostraron negativas y las que más aportaron fueron LMC, ACC y LCI. El CP2 explicó el 6.52 % y estuvo influenciada principalmente por M1M1, M2M2 y ACM; mientras que el CP3 solo representó el 5.70 % de la varianza total y M3M3, LHDM y DCAM fueron las variables con mayor aporte (, ). Como medio confirmatorio de la distribución a lo largo del CP1, ANOVA mostró diferencias significativas entre las poblaciones (F = 10.11). Sin embargo, la prueba de Tukey-Kramer sugirió que estas diferencias solo se presentan entre “occidente” versus “Marañón N”, “Valle del Marañón”, “Ucayali” y “Purús”; “Amazonas N” versus “Valle del Marañón”; “Amazonas S” versus “Marañón N”, “Valle del Marañón”, “Ucayali” y “Purús”, en los otros casos el nivel de significancia fue mayor a 0.05. La distribución de los datos en el morfoespacio generado por el CP1 y CP2 mostró solapamiento de todas las poblaciones (). El análisis de función discriminante recuperó seis discriminantes, donde los tres primeros representaron el 87.56 % de la varianza (, ). El DL1 representó el 63.47 % de la varianza total y las variables que más contribuyeron fueron APG, M2M2 y LHDM, mientras que el DL2 representó el 13.90 % y el DL3 el 10.19 % de la varianza total. La distribución de las poblaciones en el morfoespacio de los DLs 1 y 2 mostraron una amplia sobreposición de las poblaciones “Marañón N”, “Amazonas N”, “Amazonas S”, “Ucayali” y “Purús”, mientras que la población “occidente” fue discriminada casi completamente, y la “Valle del Marañón” se mostró ligeramente separada del conglomerado formado por las otras poblaciones (). Por otro lado, solo el 42.11 % de los especímenes fueron correctamente asignados a las poblaciones a priori en función a los seis discriminantes lineares, donde el 86.84 % de especímenes de la población “occidente” fueron correctamente asignados, seguido por “Valle del Marañón” con 42.31 %, “Purús” con 40.00 %, “Ucayali” con 38.46 %, “Amazonas S” con 13.33 %, “Amazonas N” con 18.75 % y finalmente “Marañón N” con 5.56 % de especímenes correctamente asignados.
Tabla 5. Porcentaje de varianza y coeficientes estandarizados de los discriminantes lineares de 26 variables empleadas en el análisis de función discriminante de las poblaciones de Carollia perspicillata. Ver Métodos para las abreviaciones de las medidas.
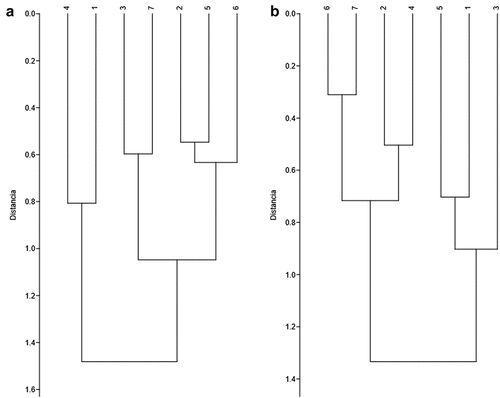
El dendrograma de las relaciones fenéticas de las poblaciones de C. brevicaudum y C. perspicillata presentaron patrones diferentes (). Para C. brevicaudum se encontró que la población “occidente” es más similar a la población “Valle del Marañón” y que las poblaciones “Amazonas N” y “Purús” son más similares entre sí al igual que las poblaciones “Marañón N”, “Amazonas S” y “Ucayali”, y que estos dos últimos agrupamientos son más similares entre sí que con el grupo formado por las poblaciones “occidente” y “Valle del Marañón” (). Para C. perspicillata se encontró que la población “occidente” es más similar a las poblaciones “Amazonas S” y “Marañón N” y que las poblaciones “Marañón N”, “Valle del Marañón”, “Ucayali” y “Purús” son más similares entre sí y forman una agrupación distinta ().
Figura 5. Dendrograma de similaridad UPGMA entre las poblaciones analizadas de Carollia brevicaudum (a) y C. perspicillata (b). Los números en los terminales indican la población referida: (1) “occidente”, (2) “Marañón N”, (3) “Amazonas N”, (4) “Valle del Marañón”, (5) “Amazonas S”, (6) “Ucayali”, (7) “Purús”.
Discusión
Nuestros resultados, tanto para Carollia brevicaudum como para C. perspicillata, sugieren que, debido a la amplia sobreposición de las poblaciones estudiadas y que ninguna es soportada consistentemente, no es posible atribuir la amplia variación en tamaño a la distribución de ambas especies en las cuencas estudiadas. Por otro lado, si bien no fue posible diferenciar claramente a la población occidental de las orientales en ninguna de las especies estudiadas, es necesario extender este estudio a otras regiones del norte de sus distribuciones (e.g. más regiones en Ecuador, Colombia y Venezuela), ya que aquí se analizó un número reducido de especímenes del occidente de Perú y Ecuador.
Previamente, McLellan [Citation10] encontró diferencias entre ocho poblaciones de C. brevicaudum de Centroamérica y una del lado oriental de los Andes de Ecuador (n = 3 especímenes), principalmente en el ancho entre los segundos premolares y entre los caninos. Estas poblaciones centroamericanas fueron diferenciadas posteriormente de C. brevicaudum mediante análisis moleculares y nombradas C. sowelli [Citation29]. McLellan [Citation10] también encontró que las poblaciones de C. perspicillata de Sudamérica (occidente de Colombia, oriente de Perú, Brasil y Paraguay) eran diferenciables morfométricamente de aquellas de Centroamérica (México, Honduras, Costa Rica y Panamá), siendo la longitud basilar la variable con mayor carga, mientras que en su análisis entre poblaciones sudamericanas no logró diferenciar algún grupo. Aunque McLellan [Citation10] no incluyó muestras del lado occidental de Ecuador, concluyó que C. perspicillata era monotípica. En este estudio las variables con mayor carga discriminante para C. perspicillata de la población “occidental” fueron el ancho posglenoideo, la amplitud entre M2-M2 y la longitud de la hilera dental mandibular que permitieron discriminar el 86.84 % de los especímenes. Si bien los resultados de los análisis discriminantes de este estudio y el estudio morfológico de Pine [Citation1] sugieren que las población occidental de C. perspicillata presenta cierto grado de diferenciación, reconocida como C. p. azteca por Pine [Citation1], a nivel molecular esta diferenciación no ha sido recuperada en la filogenia basada en el gen mitocondrial Citocromo b [Citation7], soportando la hipótesis de McLellan [Citation10]. En concordancia, la evidencia morfométrica presentada en este estudio tampoco soporta algún nivel taxonómico para esta población debido a la amplia sobreposición de los datos con respecto a las poblaciones orientales. Adicionalmente, el complejo patrón de variación morfométrica en C. perspicillata encuentra coincidencia con la red haplotipos presentada por Velazco [Citation7], en la cual se evidencia una ausencia de estructura geográfica y baja distancia genética para especímenes de casi toda su distribución, incluyendo especímenes del occidente de los Andes. En el caso de C. brevicaudum, no se tienen hipótesis poblacionales a nivel molecular, pero la distancia genética intraespecífica reportada es también baja [Citation7,Citation11].
Existen algunos taxones de amplia distribución y a ambos lados de los Andes con subespecies reconocidas que presentan un patrón similar a las especies estudiadas, en las que aún no se ha encontrado diferencias significativas debido al aislamiento por geografías importantes como los Andes o ríos profundos, como Desmodus rotundus o Noctilio leporinus, entre otros [Citation30,Citation31]. Este patrón podría deberse a diversos factores como aquellos relacionados al mecanismo de dispersión, comportamiento, preferencias de hábitats, dieta, entre otros. Contrariamente, algunas subespecies occidentales han sido diferenciadas de las orientales y elevadas a nivel de especie en base a análisis morfológicos y moleculares, tal como Lophostoma occidentalis que fue diferenciada de L. silvicola [Citation32,Citation33].
Por otro lado, los ríos Marañón y Amazonas en Perú, considerados como barrera biogeográfica para sus congéneres del complejo Carollia castanea como Carollia sp. y C. benkeithi [Citation34], no parecen influir en la variación intraespecífica tanto de C. brevicaudum como de C. perspicillata. No obstante, la diferenciación entre las especies del complejo C. castanea parece darse solo a nivel molecular, ya que a nivel morfológico y morfométrico son difícilmente diferenciables [Citation4,Citation5]. Es probable que el vuelo a larga distancia esté permitiendo a C. perspicillata cruzar ríos anchos, ya que se ha determinado que puede desplazarse hasta un máximo de 13.2 km [Citation35], así como también a otros murciélagos filostómidos de amplia distribución como Glossophaga soricina presente en la Amazonía (60 km [Citation36]). Dada la superposición de nichos y semejanza morfológica con C. perspicillata [Citation4–6,Citation12,Citation37], un patrón similar podría estar ocurriendo en C. brevicaudum. Por otro lado, la Depresión de Huancabamba (DH) y su influencia hasta el Valle Seco del Marañón en el oriente de los Andes en la cuenca media y alta del Marañón, como corredor para especies de murciélagos de tierras bajas [Citation14,Citation38,Citation39] han sido sugerida para algunas especies ampliamente distribuidas en el oriente como G. soricina o L. silvicola [Citation15,Citation32,Citation36]. Aunque no se evaluó directamente, C. brevicaudum y C. perspicillata están presentes en el Valle Seco del Marañón, pero no han sido registrados en los bosques del occidente de los Andes al sur de la DH y al occidente de Piura y sur de Tumbes. Estos dos últimos corresponden a ecosistemas muy perturbados por la agricultura y más secos, llegando a ser desérticos (Desierto de Sechura) y con poca oferta alimenticia para Carollia [Citation40,Citation41]. Si bien C. brevicaudum y C. perspicillata han demostrado ser especies muy versátiles y bien adaptadas a formaciones boscosas, habitando con gran éxito bosques primarios y perturbados [Citation42–44], estacionales o poco estacionales [Citation43,Citation45], con un amplio nicho trófico [Citation34,Citation46–49] y un amplio rango de elevación [Citation2,Citation4], no hay evidencia de su capacidad de colonizar los relictos de bosques montanos del occidente al sur de la DH en Perú.
Agradecimientos
Agradecemos a Jorge Brito (MECN, Quito) y Santiago Burneo (QCAZ, Quito) por permitirnos acceder a las Colecciones científicas de las que son responsables. Agradecemos también a Sandra Velazco por realizar comentarios críticos en el borrador del manuscrito. Este trabajo fue parcialmente financiado por el Programa Nacional de Innovación para la Competitividad y Productividad (INNÓVATE PERÚ) bajo el contrato N° 402-PNICP-PIBA-2014 y se encuentra dentro del marco de investigación del grupo de investigación DIMAPA del Vicerectorado de Investigación de la UNMSM.
Contribución de los autores
D. Ruelas conceptualizó el estudio, analizó los datos, preparó el primer borrador. V. Pacheco revisó y realizó comentarios críticos sobre el borrador. Ambos autores revisaron y aprobaron la versión final.
Conflicto de interés
Los autores no reportan conflictos de intereses.
Supplemental Material
Download MS Word (27.1 KB)Supplemental Material
Download MS Word (72 KB)Supplemental Material
Download MS Word (77.1 KB)Disclosure statement
No potential conflict of interest was reported by the author(s).
Supplementary material
Supplemental data for this article can be accessed online at https://doi.org/10.1080/23766808.2022.2093816
References
- Pine R. The bats of the genus Carollia. Technical Monograph, Texas Agricultural Experimental Station, Texas A & M University. 1972;8:1–125.
- McLellan L, and Koopman K. Subfamily Carolliinae Miller, 1924 Gardner, AL Mammals of South America Volume I. Marsupials, xenarthrans, sherws, and bats . , Chicago and London; The University of Chicago Press; 2008. 208–218.
- Terán M, Aguirre LF. Subfamilia Carolliinae. In: Aguirre LF, editor. Historia natural, distribución y conservación de los murciélagos de Bolivia. Santa Cruz Bolivia: Fundación Simón I. Patiño; 2007. p. 239–240.
- Ruelas D. Diferenciación morfológica de Carollia brevicauda y C. perspicillata (Chiroptera: phyllostomidae) de Perú y Ecuador. Rev Peru Biol. 2017;24:363–382.
- Ruelas D, López E. Análisis morfogeométrico de las especies peruanas de Carollia (Chiroptera: phyllostomidae). Mastozool Neotrop. 2018;25:419–438.
- Zurc D, Velazco PM. Análisis morfológico y morfométrico de Carollia colombiana Cuartas et al. 2001 y C. monohernandezi Muñoz et al. 2004 (Phyllostomidae: carollinae) en Colombia. Chiroptera Neotropical. 2010;16:567–572.
- Velazco PM. On the phylogenetic position of Carollia manu Pacheco et al., 2004 (Chiroptera: phyllostomidae: carolliinae). Zootaxa. 2013;3718:267–276.
- López-Aguirre C, Pérez-Torres J, Wilson LAB. Cranial and mandibular shape variation in the genus Carollia (Mammalia: chiroptera) from Colombia: biogeographic patterns and morphological modularity. PeerJ. 2015;3:e1197.
- Murillo-García OE. Murciélagos de cola corta (Carollia: phyllostomidae) del Parque Nacional Natural Gorgona (Colombia) y sus implicaciones biogeográficas. Rev Biol Trop. 2014;62:435–445.
- Mclellan LJ. A morphometric analysis of Carollia (Chiroptera, Phyllostomidae). Am Mus Novit. 1984;1:1–36.
- Hoffmann FG, Baker RJ. Comparative phylogeography of short-tailed bats (Carollia: phyllostomidae). Mol Ecol. 2003;12:3403–3414.
- Jarrín-V P, Menendez-Guerrero PA. Environmental components and boundaries of morphological variation in the short-tailed fruit bat (Carollia spp.) in Ecuador. Acta Chiropt. 2011;13:319–340.
- Jarrín VP, Flores C, Salcedo J. Morphological variation in the short-tailed fruit bat (Carollia) in Ecuador, with comments on the practical and philosophical aspects of boundaries among species. Integr Zool. 2010;5:226–240.
- Pacheco V, Patterson BD. Systematics and biogeographic analyses of four species of Sturnira (Chiroptera: phyllostomidae), with emphasis on Peruvian forms. Memorias del Museo de Historia Natural. 1992: 57–81
- Koopman KF. Zoogeography of Peruvian bats with special emphasis on the role of the Andes. Am Mus Novit. 1978;2651:1–33.
- Pacheco V. Mamíferos del Perú. In: Ceballos G, Simonetti J, editors. Diversidad y conservación de los mamíferos neotropicales. 2002. 503–539. Mexico DF: CONABIO-UNAM
- Patterson BD, Pacheco V, Ashley MV. On the origins of the western slope region of endemism: systematics of fig-eating bats, genus Artibeus. Memorias del Museo de Historia Natural, UNMSM. 1992;21:189–205.
- Patterson BD, Solari S, Velazco PM. The role of the Andes in the diversification and biogeography of Neotropical mammals. In: Patterson BD, Costa LP, editors. Bones, Clones, andBiomes. Chicago: The University of Chicago Press; 2012. p. 351–378.
- de BLAV, da R FR, Lorini ML. The application of Bergmann´s rule to Carollia perspicillata (Mammalia, Chiroptera). Chiroptera Neotropical. 2014;20:1243–1251.
- Ober HK, Hayes JP. Influence of vegetation on bat use of riparian breas at multiple spatial scales. J Wildl Manag. 2008;72:396–404.
- Amorim F, Jorge I, Beja P, et al. Following the water? Landscape‐scale temporal changes in bat spatial distribution in relation to Mediterranean summer drought. Ecol Evol. 2018;8:5801–5814.
- Urquizo JH, Bracamonte JC, Vaira M. Diversidad de murciélagos en ambientes ribereños de la Selva Pedemontana de las yungas de Jujuy, Argentina. Mastozool Neotrop. 2018;25:439–453.
- Mancina CA, Balseiro F. Variación en la forma de la mandíbula en Monophyllus redmani (Chiroptera: phyllostomidae): análisis geométrico de la variación sexual y geográfica. Mastozool Neotrop. 2010;17:87–95.
- Lemos TH, da Cunha Tavares V, Moras LM. Character variation and taxonomy of short-tailed fruit bats from Carollia in Brazil. Zoologia. 2020;37:1–7.
- Lau MK. Dunnett-Tukey-Kramer pairwise multiple comparison test adjusted for unequal variances and unequal sample sizes. R Package Version. 2013;35. Available from https://cran.r-project.org/package=DTK
- R Core Team. R: a language and environment for statistical computing. Vienna Austria: R Foundation for Statistical Computing; 2017.
- Korkmaz S, Goksuluk D, Zararsiz G. MVN: multivariate Normality Tests. 2019.
- Dray S, Dufour A-B. The ade4 package: implementing the duality diagram for ecologists. J Stat Soft. 2007; 22. doi: 10.18637/jss.v022.i04.
- Baker RJ, Hoffmann FG, Sergio S. A new Central American species from the Carollia brevicauda complex. Occasional Papers, Museum of Texas Tech University. 2002;217:1–12.
- Clare EL. Cryptic species? Patterns of maternal and paternal gene flow in eight Neotropical bats. PLoS ONE. 2011;6:e21460.
- Kwon M, and Gardner AL. Subfamily Desmodontinae Gardner, AL. Mammals of South America. Chicago and London; The University of Chicago Press; 2008. 218–224.
- Baker RJ, Fonseca RM, Parish DA, et al. New bat of the genus Lophostoma (Phyllostomidae: phyllostominae) from northwestern Ecuador. Occasional Papers, Museum of Texas Tech University. 2004; 232: 1–16.
- Velazco PM, Cadenillas R. On the identity of Lophostoma silvicolum occidentalis (Davis and Carter, 1978) (Chiroptera: phyllostomidae). Zootaxa. 2011;2962:1–20.
- Solari S, Baker R. Mitochondrial DNA sequence, karyotypic, and morphological variation in the Carollia castenea species complex (Chiroptera: phyllostomidae) with description of a new species. Occasional Papers, Museum of Texas Tech University. 2006;254:1–16.
- Fleming TH. The short-tailed fruit bat: a study in plant-animal interactions. Chicago: University of Chicago Press; 1988.
- Dias CAR, Santos Júnior JE, Perini FA, et al. Biogeographic scenarios for the diversification of a widespread Neotropical species, Glossophaga soricina (Chiroptera: phyllostomidae). Systematics and Biodiversity. 2017; 15: 440–450.
- Fleming TH. The relationship between body size, diet, and habitat use in frugivorous bats, genus Carollia (Phyllostomidae). J Mammal. 1991;72:493–501.
- Koopman K. Biogeography of bats of South America. In: Mares M, Genoways H, editors. Mammalian Biology in South America. Pittsburgh: Special Publications Series, Pymatuning Laboratory of Ecology, University of Pittsburgh; 1982. p. 237–302.
- Ruelas D, Pacheco V. Noteworthy records and distribution of Peruvian Long-tongued Bat, Platalina genovensium Thomas, 1928 (Chiroptera, Phyllostomidae). CheckList. 2018;14:937–944.
- Gálvez M, Barrionuevo R, Charcape M. El desierto de Sechura: flora, fauna y relaciones ecológicas. Universalia. 2006;11:33–43.
- Deza Rivasplata J, Tume Ruiz J, and Alarcón Delgado J. Cambios ambientales en el desierto de Sechura y alternativas para su aprovechamiento. Cien y Des. 2010;12:11–28.
- Hice CL, Velazco PM, and Willig MR. Bats of the Reserva Nacional Allpahuayo-Mishana, northeastern Peru, with notes on community structure. Acta Chiropt. 2004;6:319–334.
- Ruelas D, Pacheco V, and Espinoza N, et al. Bat diversity from the Río La Novia Conservation Concession, Ucayali, Peru. Rev Peru Biol. 2018;25:211–220.
- Arias E, Pacheco V, Cervantes K, et al. Diversidad y composición de murciélagos en los bosques montanos del Santuario Nacional Pampa Hermosa, Junín. Perú. Rev Peru biol. 2016; 23: 103–116.
- Pacheco V, Cadenillas R, Velazco S, et al. Noteworthy bat records from the Pacific Tropical rainforest region and adjacent dry forest in northwestern Peru. Acta Chiropt. 2007;9:409–422.
- Cloutier D, Thomas D. Carollia perspicillata. Mamm Species. 1992;417:1–9.
- York HA, Billings SA. Stable-isotope analysis of diets of short-tailed fruit bats (Chiroptera: phyllostomidae: carollia). J Mammal. 2009;90:1469–1477.
- Fleming TH, Heithaus ER. Seasonal foraging behavior of the frugivorous bat Carollia perspicillata. J Mammal. 1986;67:660–671.
- Novoa S, Cadenillas R, Pacheco V. Dispersión de semillas por murciélagos frugívoros en bosques del Parque Nacional Cerros de Amotape, Tumbes. Perú. Mastozool Neotrop. 2011;18:81–93.
