ABSTRACT
The northwestern region of Argentina has several gaps in ichthyogeographic knowledge and there are still bodies of water without records of the species that inhabit them. When planning mitigation projects or conservation or management actions, little knowledge of the biology of a species presents itself as a restriction. Therefore, the objective is to know the reproductive biology of the torrent catfish (H. macraei) in the Natural Protected Area La Ciénaga, San Juan, with the purpose of generating basic information as a tool for the future management of these populations. The torrent catfish, Hatcheria macraei (Girard, 1855) is a Siluriformes that belongs to the Trichomycteridae family, it is a rheophilic and phototactic negative species, which is characterized by living in cold and well-oxygenated waters with sandy and rocky substrates. In a period of one year, fecundity, reproductive potential, minimum reproductive size were determined, sexual dimorphism was evaluated, and the state of gonadal development was described. It was determined that the species presents an opportunistic strategy, presenting a prolonged reproduction period from October to November.
RESUMEN
La región noroeste de la Argentina tiene varias brechas en el conocimiento ictiogeográfico y todavía hay cuerpos de agua sin registros de las especies que los habitan. Al momento de planificar proyectos de mitigación o acciones de conservación o manejo se presenta como restricción el escaso conocimiento de la biología de una especie. Por ello, se plantea como objetivo conocer la biología reproductiva del bagre de torrente (H. macraei) en el Área Natural Protegida La Ciénaga, San Juan, con el propósito de generar información base como herramienta para el futuro manejo de estas poblaciones. El bagre de torrente, Hatcheria macraei (Girard, 1855) es un Siluriformes que pertenece a la familia Trichomycteridae, es una especie reofílica y fototáctica negativa, que se caracteriza por vivir en aguas frías y bien oxigenadas con sustratos arenosos y rocosos. En un periodo de un año, se determinó la fecundidad, el potencial reproductivo, la talla mínima reproductiva, se evaluó el dimorfismo sexual y se describió el estado del desarrollo gonadal. Se descubrió que la especie presenta una estrategia oportunista, presentando un periodo de reproducción prolongado de octubre a noviembre.
PALABRAS CLAVE:
Introducción
El conocimiento de la fauna de peces del oeste argentino ha sido incrementado y mejor detallado en los últimos años [Citation1,Citation2]. A pesar de este incremento, la información científica disponible para la mayoría de las especies y ambientes acuáticos es aún limitada [Citation2].
La región noroeste de la Argentina tiene varias brechas en el conocimiento ictiogeográfico y todavía hay cuerpos de agua sin registros de las especies que los habitan [Citation3]. Al momento de planificar proyectos de mitigación o acciones de conservación o manejo se presenta como restricción el escaso conocimiento de la biología de una especie [Citation4]. Por ello es indispensable mejorar el conocimiento de las poblaciones de peces andino-cuyanas, ya que son escasamente conocidas.
Las especies a lo largo de su historia evolutiva han desarrollado distintas estrategias o estilos reproductivos para optimizar la viabilidad de su descendencia [Citation5]. En peces estas estrategias son extremadamente variables [Citation6]. y están estrechamente ligadas al ambiente, especialmente a los cambios estacionales de luz y temperatura [Citation7], y varían considerablemente según la especie [Citation6–8]. Esto se interpreta generalmente como un mecanismo para asegurar la eclosión de las larvas en las condiciones ambientales que optimizan sus posibilidades de supervivencia [Citation9]. Así, el éxito obtenido por una especie está determinado, en general, por la capacidad de mantener poblaciones viables en ambientes variables a través de la reproducción [Citation10].
El Orden Siluriformes constituye el grupo más diverso y ampliamente distribuido de peces Ostariofisios [Citation11]. Los Siluriformes tienen una enorme abanico geográfico y ecológico en las aguas dulces y en los mares costeros de todo el mundo, excepto en la Antártida [Citation12]. La diversidad más alta se encuentra en la región tropical y subtropical, especialmente de Suramérica, África y Sudeste asiático [Citation13].
Este orden se caracteriza por ser el más representativo de la fauna suramericana y de los taxones lóticos, pero los antecedentes sobre su hábitat y ciclos de vida son escasos y generales, lo cual es básico para predecir sus respuestas a cambios drásticos de las poblaciones [Citation14]. A pesar de esto, Arratia [Citation15] y Aguirre et al. [Citation16] informan que las poblaciones están diezmadas debido a la contaminación, destrucción de la vegetación ribereña e introducción de especies exóticas, voraces y agresivas.
El bagre de torrente, Hatcheria macraei (Girard, 1855) perteneciente al orden Siluriformes es monotípico de la familia Trichomycteridae. Incluye ocho subfamilias y unas 200 especies de peces pequeños [Citation17] y presenta un alto potencial de colonización en entornos restringidos como arroyos de gran altitud ()). Hatcheria maraei es endémico de América del Sur [Citation18] y se distribuye ampliamente en Argentina y Chile [Citation19]. En Argentina es un taxón que domina sobre la ictiofauna Andino-Cuyana [Citation1]. Tiene una distribución continua desde el sistema del norte del río Colorado (río Grande, provincia de La Rioja) hacia el sur hasta el sistema del río Baker (río Blanco, provincia de Santa Cruz), encontrándose en las cuencas tanto del Atlántico como del Pacífico [Citation19]. En San Juan se reportan en los departamentos de Calingasta, Jáchal, Iglesia, Chimbas y 25 de Mayo 1. Bello y Ubeda [Citation20] la clasificaron como una especie en estado de conservación “No amenazada”, mientras que Chebez [Citation21] y Lopez et al. [Citation22] la consideraron una especie “Rara”. Es una especie reofílica y fototáctica negativa [Citation23], que se caracteriza por vivir en aguas frías y bien oxigenadas con sustratos arenosos y rocosos [Citation24]. Al igual que todos los bagres de la familia Trichomycteridae, cuenta con un sistema morfológico altamente especializado [Citation25]. H. macraei tiene un hábito general de alimentación basada en invertebrados bentónicos [Citation26] correspondiendo al tipo carnívoro bentófago [Citation27]. Las presas dominantes variaron en distintos estudios. Para San Juan existe un único registro de la especie en la que dominaron larvas de Chironomidae y Elmidae [Citation28], Barriga y Battini [Citation29] en la Patagonia encontraron larvas de Chironómidos, y Ferriz [Citation30] en un río de Chubut, determinó que se alimentaban principalmente de ninfas de efemerópteros seguidas de larvas de tricópteros.
Figura 1. Ubicación geográfica del área de estudio, a) Mapa de Argentina, b) Mapa del área natural protegida “La Ciénaga”. c) imagen de la especie Hatcheria macraei. Ejemplar perteneciente al Área Natural Protegida la Ciénaga.
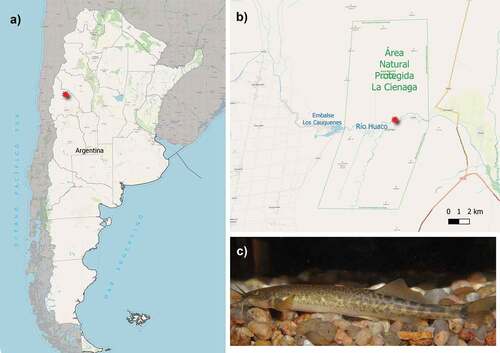
El Área Natural Protegida La Ciénaga, conserva un importante legado natural, biológico y geológico. Sin embargo, no existen registros de estudios biológicos de las poblaciones de peces. H. macraei es un importante indicador por ser altamente vulnerable a valores de contaminación o enrarecimiento de la calidad del agua [Citation31]. Es por esto que el objetivo de este trabajo se basa en conocer la biología reproductiva del bagre de torrente (H. macraei) en el Área Natural Protegida La Ciénaga, San Juan, con el propósito de generar información base como herramienta para el futuro manejo de estas poblaciones.
Metodología
Área de estudio
La localidad de “La Ciénaga” (30°8ʹ38.997”S, 68°34ʹ42.612”W) perteneciente al departamento Jáchal, ubicado al Norte de la Provincia de San Juan a 25 Km de la villa cabecera y a 10 Km de la localidad de Huaco, sobre Ruta 49. El Área Natural Protegida La Ciénaga (Ley Provincial N° 865-L) fue creada para conservar un importante legado natural, biológico y geológico. Está inserta en un marco imponente de sierras de mediana altura, que corresponden geológicamente a la Pre-Cordillera Central, faja plegada y corrida, situada al oeste de la República Argentina. El área de superficie cubierta es de más de 9.600 hectáreas de extensión ()).
Métodos de campo
La captura de los ejemplares se realizó a través de un método activo, debido a que H. macraei no se captura con frecuencia en los levantamientos de redes tradicionales porque se entierra en el sustrato [Citation32]. Esta técnica consiste en la utilización de un copo o red y como elemento para remover el sustrato se utilizó una anchada. El copo se coloca en el sitio seleccionado y con la anchada se remueve el sustrato, con el objetivo de que los ejemplares ingresen al copo. Los muestreos se realizaron durante un año, comprendido entre Diciembre de 2017 y Marzo, Abril, Julio, Agosto y Noviembre del 2018, con el fin de abarcar todas las estaciones.
Se colectaron aproximadamente 30 individuos por muestreo, se tomaron variables ambientales como la temperatura del agua y aire (°C) con un termómetro digital (TES TP-K01, 1.6 mm, Taipei, Taiwán) y la velocidad del agua (m/s). Los ejemplares capturados se fijaron con formol al 10% en el campo, se conservaron y almacenaron según las normas establecidas por Scrocchi y Kretzschmar [Citation33].
Métodos de laboratorio
En el laboratorio los ejemplares fueron etiquetados, enumerados y posteriormente se registraron 24 medidas morfométricas con un calibre digital (ESSEX, Digital caliper 0–200 mm), siguiendo la técnica propuesta por Barriga y Battini [Citation29]. Se midió la longitud total (LT), longitud estándar (LE), longitud pre-dorsal (LPD), profundidad del cuerpo detrás de la cabeza (PCDC), profundidad del cuerpo en la aleta ventral (PCAV), profundidad del cuerpo en la aleta adiposa (PCAA), longitud de la cabeza (LC), distancia pre-ventral (DPV), longitud pre-ventral (LPV), distancia ventral anal (DVA), largo hocico cloaca (LHC), longitud inter orbital (LIO), longitud orbital (LO), longitud de la aleta adiposa (LAA), longitud de la base de la aleta adiposa (LBAA), longitud de la base de la aleta anal (LbAD), longitud de la aleta anal (LAa), profundidad del pedúnculo caudal (PPC), ancho de cabeza (AC), ancho de boca (AB), longitud de la aleta pectoral (LAV), ancho del cuerpo en la aleta anal (ACAA), ancho de cuerpo en aleta pectoral (ACAP) y longitud de la aleta pélvica (LAP).
Los ejemplares se diseccionaron y se pesaron con una balanza digital de precisión Ohaus (precisión: 0,0001 g). Se registró para cada individuo el peso total, peso eviscerado, peso gonadal, peso del estómago e intestino, y peso del hígado.
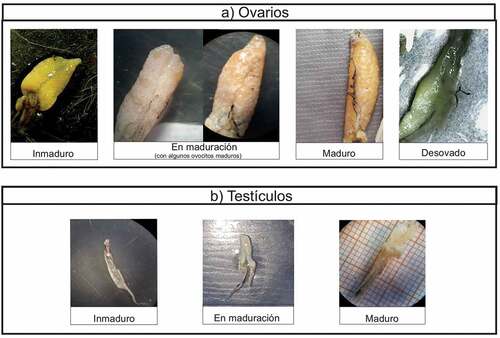
Las gónadas se clasificaron de forma macroscópica teniendo en cuenta las fases propuestas por Chiarello-Sosa et al. [Citation34]: (Fase I) Inmaduros: testículos pequeños, translúcidos y filiformes. Ovario pequeño, cilíndrico y hialino con ovocitos no visibles a simple vista e irrigación escasamente evidente. (Fase II) En maduración: testículos de tamaño medio, coloración que pasa de un color rosáceo transparente a un blanco lechoso en donde se hace evidente la irrigación. Ovario cilíndrico y amarillo con ovocitos escasamente visibles macroscópicamente. (Fase III) Maduros: testículos de mayor tamaño, blancos y muy irrigados. Ovarios irrigados ocupando gran parte de la cavidad abdominal con ovocitos amarillos y visibles. (Fase IV) Desove: testículos con gran irrigación que fluye libremente con una suave presión. Ovarios flácidos y opacos con disminución de volumen evidente.
Se calculó el potencial reproductivo, éste se basa en el número de ovocitos presentes en el ovario y el tamaño de los mismos, el cual se midió a partir del método gravimétrico [Citation35]. Este método consiste en pesar el ovario y contar el número de ovocitos en una serie de submuestras (alícuotas) de peso conocido y de diferentes sectores del ovario (generalmente tres), luego el número medio de huevos en las submuestras se eleva al peso total del ovario. Se realizó un análisis de regresión lineal no paramétrico, entre la fecundidad y el tamaño corporal de las hembras. Se calculó el diámetro promedio de los ovocitos maduros (la cual consiste en la medición de 5 ovocitos maduros por submuestra y se calculó el promedio para cada ovario).
Análisis de datos
Se testearon los supuestos de normalidad y homocedasticidad de varianzas a fin de utilizar estadística paramétrica. En los casos en que los datos no cumplieron algún supuesto se realizaron transformaciones y/o utilizaron los equivalentes en estadística no paramétrica. Se realizó un análisis de regresión lineal entre las medidas morfométricas y el largo estándar de cada ejemplar. En caso de mostrar relación lineal significativa se realizó un ANCOVA (análisis de la covarianza) con comparación de contraste LSD de Fisher, para remover el efecto tamaño sobre dimorfismo. El ANCOVA se efectuó con el fin de evaluar diferencias significativas de las medidas morfométricas entre sexos, y como covariable se utilizó el largo estándar. Se realizó una prueba de ANOVA para comprobar la existencia de diferencias significativas entre el desarrollo gonadal y los distintos meses.
La talla mínima de madurez sexual se estableció a partir del tamaño mínimo reproductivo, esto es, el ejemplar maduro que presenta el menor largo estándar (LE).
Los índices corporales relacionan el tamaño gonadal con el tamaño del cuerpo del individuo. En este estudio se analizaron tres índices, el índice gonadosomático, factor de condición, e índice hepatosomático. El índice gonadosomático o relación gonadosomática (IGS), es un indicador de madurez gonadal y se obtiene de la relación porcentual entre el peso de la gónada y el peso del organismo. Su valor máximo se considera como indicativo de la etapa previa a la reproducción y la disminución subsecuente de los valores promedio es un indicio de que ha ocurrido el desove 62. Este índice se estimó de acuerdo a García-Díaz et al. [Citation36], para cada hembra y macho mediante la siguiente expresión: IGSi = (PGi/Pi) * 100. Dónde: IGSi = Índice gonadosomático, PGi = Peso de la gónada (g), Pi = Peso total del organismo (g).
El factor de condición o índice de Fulton (K) determina el período en el cual los peces acumulan una mayor biomasa en su cuerpo y permite determinar la época de los cambios en las condiciones fisiológicas relacionadas con la edad, sexo y hábitats diferentes [Citation37]. El índice de condición para ambos sexos se calculó con el índice de Fulton: K = (Pt/L^3) *100 (Ricker 1975) Pt = Peso total del pez (g) L = Longitud estándar (mm).
Y el Índice hepatosomático o índice hepático (HSI), se utiliza con frecuencia como indicador del nivel de reservas del organismo y presenta una tendencia contraria a la del IGS, por eso, aunque la interpretación de los cambios cíclicos en el peso del hígado es más compleja, sirve como índice indirecto del estado de madurez sexual, aproximadamente. Este índice es útil sólo en aquellas especies en las que el hígado juega un papel importante en la acumulación de reservas alimenticias [Citation38] Índice hepático = (Peso del hígado/peso eviscerado) *100. Para el procesamiento de los datos se utilizó el software estadístico InfoStat, versión 2016 (4,0) (Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina).
Resultados
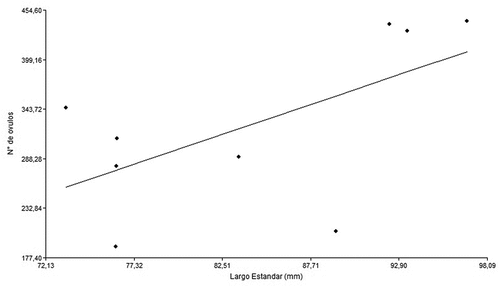
En promedio las hembras de H. macraei presentaron en su ovario un total de 330 ovocitos, con una mínima de 190 ovocitos y una máxima de 442. El diámetro promedio de los ovocitos maduros es de 1,38 mm. No existió se relación lineal significativa entre el número de ovocitos con el largo estándar (Regresión lineal: R^2 = 0,361; p = 0,0869) ().
Figura 2. Análisis de regresión lineal entre el número de ovocitos maduros y el largo estándar (mm) de hembras de Hatcheria macraei.
La proporción sexual no mostro diferencias significativas (1,02:1, Chi- cuadrado de Pearson: X^2 = 0,0044 p = 0,9471), con 114 hembras y 113 machos. Para las variables morfométricas solo se encontraron diferencias significativas entre sexos en dos variables, en LAa (longitud de aleta anal) (ANCOVA, F = 5,86; p = 0,0163) y en AB (ancho de boca) (ANCOVA: F = 20,34; p < 0,0001), donde los machos muestran mayores tamaños que las hembras.
En el análisis gonadal, que se realizó de forma macroscópica, se pudieron observar tres fases de madurez para machos (inmaduros, en maduración y maduros), mientras que en las hembras se pudieron registrar 5 fases (inmaduros, en maduración, con algunos óvulos en proceso de maduración, maduros y desove) (). Para el caso de las hembras se registró otro estadio, con algunos óvulos en proceso de maduración, que no estaba descrito en las fases propuestas por Chiarello-Sosa et al. [Citation34], en la cual en el interior del ovario se pudieron observar algunos ovocitos con una maduración más avanzada que otros, pero no superaban 1 mm de diámetro.
Figura 3. Distintas fases de desarrollo gonadal, para (a) hembras y (b) machos de Hatcheria macraei.
El desarrollo de la madurez gonadal de las hembras fue significativamente diferente entre meses (Kruskal-Wallis, H = 29,13, p < 0,0001), donde la mayor proporción de hembras maduras fue en Agosto, y la menor proporción de hembras se encontró en Diciembre. Para machos, el desarrollo testicular fue sincrónico con el ciclo gonadal de las hembras, y al igual que las hembras se observaron diferencias significativas entre los distintos meses (Kruskal-Wallis, H = 20,66, p < 0,0002), donde fue mayor el desarrollo testicular en el mes de agosto.
La talla mínima reproductiva teniendo en cuenta tres medidas morfométricas para hembras y machos fueron: LE 73,3 y 60,65 mm; LT 83,19 y 69,23 mm; y LHC 46,11 mm y 37,48 mm; respectivamente.
El peso total, el peso eviscerado, el peso de las gónadas y el peso del hígado mostraron diferencias significativas entre machos y hembras (). Mientras que el peso del hígado no mostro diferencias significativas diferencias entre los distintos meses, donde el peso fue mayor en el mes de agosto con una media de 0,0795 ± 0,0379 g y mínimo en julio con una media de 0,0495 ± 0,0351 g.
Tabla 1. Valores medios, desviación estándar y análisis de la varianza del peso total, peso eviscerado, peso de las gónadas y peso del hígado; de machos y hembras de H. macraei. (W = suma de los rangos; Valores con un nivel de significación p > 0.05 muestran diferencias significativas).
El índice gonadosomático (IGS) en machos no mostró diferencias significativas entre meses (Kruskal-Wallis: H = 2,86, p = 0,3397), mientras que en hembras si hubo diferencias significativas (Kruskal Wallis: H = 34,65, p < 0,0001) ()), siendo el IGS para ambos sexos mayor en agosto y menor en noviembre y diciembre.
Figura 4. a) variación mensual del índice gonadosomático, b) factor de condición (k) y c) índice hepático, en machos y hembras de Hatcheria macraei. Letras diferentes indican diferencias significativas. (mayúsculas hembras, minúsculas machos).
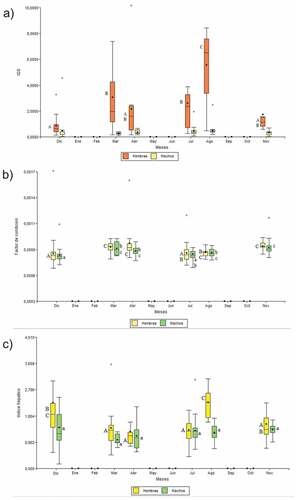
El factor de condición (k) no fue estadísticamente diferente entre sexos (MannWhitney: U = 12,121,00, p = 0,1240). Sin embargo, se encontraron diferencias significativas entre meses (Kruskal-Wallis: H = 52,38, p < 0.0001); en donde se observó que los individuos presentaron un mayor factor de condición en noviembre (0.00114 ± 0,000113) mientras que en diciembre se observó un menor valor del factor de condición (0.000899 ± 0.000319) ()).
El índice hepático fue significativamente diferente entre sexos (Mann-Whitney: U = 11,534,00, p = 0,0064). Por otro lado, los machos no mostraron variaciones mensuales significativas (Kruskal-Wallis: H = 9,19, p = 0,1081), mientras que las hembras si mostraron diferencias significativas entre meses (Kruskal-Wallis: H = 27,80, p = 0,0001; ()). Se observó un patrón bimodal en donde los valores máximos fueron en agosto (Machos = 1,1043 ± 0,055, Hembras = 1,8977 ± 0,122) y diciembre (Machos = 1,196 ± 0,130, Hembras = 1,912 ± 0,310).
Las variables medidas en el campo como temperatura del aire, temperatura del agua y velocidad del agua oscilaron en los distintos meses ()). La temperatura del agua sufrió variaciones en función de la temperatura del aire con un coeficiente de correlación de r = 0,94, n = 6. Mientras que la velocidad del agua no mostró variaciones ya que el área de muestreo se encuentra río abajo del Dique los Cauquenes, siendo su caudal regulado por el hombre.
Figura 5. a) variación mensual de la temperatura del agua y aire (°C) y la velocidad del agua (m/s), en el área de estudio. b) variación mensual del IGS (índice gonadosomático) de la especie Hatcheria macraei (sin diferenciación entre sexos) y de la temperatura del agua (°C) en los distintos meses.
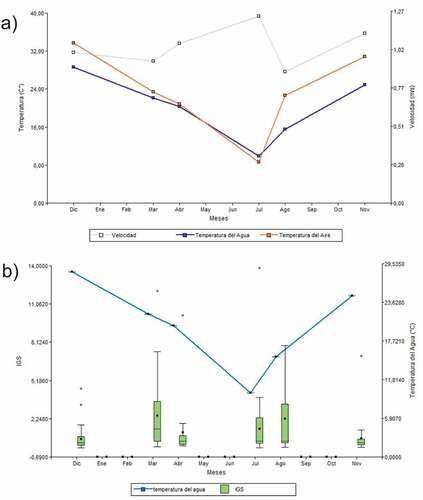
En el siguiente gráfico se puede observar como el IGS presenta oscilaciones en función de la temperatura del agua, mostrando relación lineal (Regresión lineal: R^2 = 0,02; p = 0,0181) ()).
Discusión
El potencial reproductivo de una especie refleja la relación de ésta con el funcionamiento del ambiente, dando una idea del estado expansionista de la población [Citation39]. Además, puede variar con el crecimiento, la densidad poblacional, la disponibilidad de alimentos y la tasa de mortalidad [Citation40]. Saborido-Rey [Citation35] describe dos tipos de fecundidad, fecundidad determinada en donde no hay reposición de ovocitos en estado de vitelogénesis y fecundidad indeterminada cuando hay aporte continuo de ovocitos. La fecundidad de la población de H. macraei presente en la Patagonia, es del tipo determinada porque no se reclutaron nuevos ovocitos durante la temporada de desove [Citation34], estos resultados coinciden con la población presente en la Ciénaga. Hay especies que pueden presentar una fecundidad alta, con presencia de millones a varios cientos de miles de ovocitos y especies que tienen una fecundidad baja, con unos cientos o pocos miles de ovocitos por hembra madura [Citation41]. H. macraei tiene una fecundidad baja en la población de la Ciénaga, coincidiendo con una población presente en Patagonia, que presenta entre los 115 a 480 ovocitos [Citation34] y el tamaño de los ovocitos es similar a otras especies de Trichomycteridae [Citation34]. Una fecundidad baja a menudo se ve compensada por grandes ovocitos que dan lugar a individuos con mayor capacidad para explorar el ambiente que aquellos que se originaron a partir de pequeños ovocitos [Citation42].
De acuerdo con Nikolski [Citation43], la proporción entre sexos varía considerablemente de una especie a otra, y también podría variar dentro de la misma población de un año a otro; esta fluctuación, en la proporción, se debe a diferencias por crecimiento, mortalidad, costos energéticos de la reproducción y migración diferencial o segregación espacial por sexo [Citation44]. Casatti [Citation45] encontró que Trichomycterus sp. tiene una proporción 1:1 que coincide con otra especie Horabagrus brachysoma [Citation46]. Caso contrario una disminución poblacional sucede con otro siluro, Diplomystes nahuelbutaensis, en donde la proporción resultó 36,3% hembras, 56 % machos y 7% indeterminados [Citation47]. Barriga y Battini [Citation29] determinaron que H. macraei en la Patagonia posee una proporción de sexos 1:1 en el término de un año, lo que coincide con nuestros resultados. Esto podría indicar que la población de peces estudiadas en la Ciénaga se encuentra estable, no hay una agregación de hembras y machos durante el periodo reproductivo.
Los caracteres sexuales secundarios pueden ser de vital importancia para muchas especies [Citation48]. Hatcheria macraei, presentó un dimorfismo sexual en relación a la talla, en la cual los machos mostraron mayor robustez que las hembras. Dentro de las variables morfométricas analizadas las que mostraron diferencias significativas son la longitud de la aleta anal y el ancho de la boca, en las que los machos mostraron las mayores medidas. Lo que sugiere que un cuerpo más robusto evolutivamente representa un instrumento para competir por territorio de apareamiento y alimentación con otros machos, microhábitats más turbulentos en cuanto al uso del espacio, cuidado parental, construcción de nidos (de confirmarse la existencia de este proceso) [Citation49]. Se ha registrado previamente este patrón en distintas especies del género, en donde los machos pueden ser más grandes que las hembras [Citation50], como algunos Loricariidae, Hypostomus ancistroides, H. hermanni, Chaetostoma fischeri y Ancistrus spp [Citation22].
Hatcheria macraei tiene una mayor longitud de la aleta anal en machos, estos resultados son similares con otro Siluriforme, Diplomystes cuyanus, lo que podría ser un instrumento utilizado en la dispersión de los gametos masculinos en el momento de la reproducción externa [Citation49]. Este patrón probablemente se repita en otras especies de siluros.
Los testículos de H. macraei son alargados y sin proyecciones [Citation34], son del tipo lobular [Citation51]. La población en la Ciénaga cuenta con machos maduros en todos los meses del año, pero son más frecuentes en el mes de agosto, mostrando sincronía con la maduración de los ovarios.
Se determinó que en la población H. macraei, en la Ciénaga, los ovarios son de tipo cistovario (en los que un ovocito madura dentro de un folículo en las láminas ováricas y se libera en la luz del ovario en el momento de la ovulación y luego pasa por el oviducto para ser liberado hacia el ambiente) [Citation51]. Además, en este estudio, la maduración de los ovocitos dentro de la gónada sería de tipo asincrónico, es decir, que cuenta con ovocitos en distinto periodo de maduración, lo que coincide con los resultados obtenidos por Chiarello-Sosa et al. [Citation52]. Este patrón asincrónico, se observa generalmente en especies que desovan varias veces durante el curso de una temporada de reproducción prolongada [Citation53]. El desove múltiple permite la separación temporal de la descendencia, lo que disminuye la probabilidad de un evento catastrófico impredecible que destruya toda la progenie del año [Citation54] y también una competencia intraespecífica al comienzo de la alimentación exógena [Citation52]. Se considera que esta estrategia reproductiva es selectivamente ventajosa en entornos inestables y desfavorables [Citation55].
El índice gonadosomático fue mayor en el mes de agosto para ambos sexos con una temperatura de 15.5°C (Figura 9). Se ha demostrado repetidamente que los ecosistemas de agua dulce responden significativamente a las fluctuaciones climáticas a gran escala [Citation56]. La temperatura condiciona o determina fuertemente los modos de vida de los organismos acuáticos y es considerado un factor primario de supervivencia. La variación estacional de la temperatura del agua también puede proporcionar la señal necesaria para estimular el movimiento de los peces adultos para el desove o de los juveniles que se reclutan en el hábitat adulto [Citation57]. Como hipótesis a comprobar se podría decir que la población de H. macraei de la Ciénaga, se encontraría fuertemente condicionada por la temperatura del agua; donde las temperaturas preferidas para la reproducción de la especie oscilarían entre los 15°C y los 25°C.
El tamaño de madurez sexual es muy variable dentro de la familia Trichomycteridae [Citation29]. Nuestros resultados muestran una talla mínima reproductiva para machos de 60,5 mm y hembras de 73,3 mm, esta última es considerablemente mayor en relación a hembras de la Patagonia. Esto se debe a que la talla de la madurez sexual se ve afectada por las condiciones ambientales de cada zona geográfica, la temperatura, el fotoperiodo y la disponibilidad de alimento [Citation58]. Las hembras tienen un tamaño mayor en relación a los machos, ya que los machos son maduros y fértiles a menores tallas porque destinan su energía a la producción de espermatozoides [Citation59] mientras que las hembras, retrasarían el destino de la energía a la maduración ovárica [Citation60] incrementando la talla corporal que es necesaria para proveer un mayor espacio en la cavidad celómica para la producción de ovocitos [Citation61].
Con el análisis macroscópico de las gónadas se pudo determinar en que fase de madurez se encontraba cada ejemplar, este análisis se correspondió con los valores de IGS. Cuando el IGS tiene un valor máximo es considerado como un indicativo de la etapa previa a la reproducción y la disminución subsecuente de los valores promedio es un indicio de que ha ocurrido el desove [Citation62]. El índice gonadosomático muestra una temporada reproductiva prolongada para H. macraei, varia gradualmente con el paso de las estaciones hasta alcanzar un valor máximo en el mes de agosto en ambos sexos, y presenta una caída brusca en el mes de noviembre, que corresponde al desove. Estos resultados difieren con otras especies de Trichomycterus analizadas en latitudes altas, como T. corduvensis [Citation63], T. spegazzinii [Citation11] inclusive varía con una población de H. macraei, presente en la Patagonia [Citation34] en donde el índice gonadosomatico aumenta gradualmente en septiembre hasta alcanzar su valor máximo en diciembre y baja drásticamente en el mes de marzo. Chiarello-Sosa et al. [Citation34] determinó que la temporada de desove de la población de H. macraei en la Patagonia se asocia con períodos de alta temperatura del agua, coincidiendo con la población analizada en la Ciénaga. Esto indica que existe un patrón en relación a las especies de latitudes bajas y altas. La sincronización del desove con estos períodos a menudo coincide con picos de disponibilidad de presas y niveles óptimos de temperatura de desarrollo que maximizan la supervivencia de la descendencia [Citation48].
El factor de condición se usa para comparar la condición corporal o bienestar en el que se encuentra una la población de peces, se basa en que los individuos de mayor peso a una determinada longitud presentan una mejor condición [Citation64]. La población analizada por Chiarello-Sosa et al. [Citation34] en la Patagonia no mostró diferencias significativas entre machos y hembras, al igual que los bagres analizados en este estudio. Se observó también una variación entre los distintos meses, en la cual la población presenta una baja condición durante el periodo reproductivo (cuando el IGS es elevado) y la condición mejora con valores de IGS menores. Esto muestra que los peces que pasan por el periodo reproductivo tienen un cierto deterioro de su condición general [Citation49], ya que el factor de condición está relacionado principalmente con el estado de alimentación, las fases gonadales [Citation48], y la tensión de anidación durante la reproducción [Citation65]. Esto explica el hecho que la actividad reproductiva genera un alto costo energético para los organismos [Citation66].
El índice hepatosomático responde a las variaciones que reflejan procesos de acumulación y utilización de reservas relacionadas con la reproducción e intensidad alimentaria [Citation67]. La movilización de las reservas energéticas tiene lugar durante el proceso madurativo de las gónadas [Citation40]. En los individuos de la población analizada, se puede observar que el índice hepatosomático disminuye durante el proceso de maduración de las gónadas, entre marzo y julio, con mayor intensidad en hembras que en machos. Los cambios cíclicos en el peso del hígado se producen por la acumulación de lípidos y la síntesis de vitelogenina precursora del vitelo almacenado en los ovocitos durante la vitelogénesis [Citation39]. El comportamiento reproductivo es otro gasto energético y puede deberse al movimiento para la elección del lugar de reproducción, preparar el lugar de desove, defensa del lugar, cortejo y cópula, y cuidado parental [Citation35]. Esto podría verse reflejado en la baja del índice que sufren los individuos entre agosto y noviembre. Podríamos decir que las reservas del hígado son utilizadas durante el desarrollo ovocitario y previo al desove.
Winemiller y Rose [Citation68], proponen un modelo triangular de evolución de historia de vida, para explicar la respuesta adaptativa a una variación ambiental, en la que reconoce tres tipos de estrategias; estrategia oportunista, una estrategia de equilibrio y por último las especies que presentan estrategias periódicas. Según el modelo propuesto, la población de H. macraei de la Ciénaga, sería una especie oportunista ya que presenta una temporada de reproducción prolongada, tamaño pequeño y baja fecundidad. Estos resultados coinciden con el tipo de estrategia que determina Chiarello-Sosa et al. [Citation34] para una población de H. macraei presente en la Patagonia. Esta estrategia es común en entornos desfavorables e impredecibles [Citation68], como los ríos de bajo orden ya que se encuentran más afectados por las fluctuaciones climáticas. En otras especies de la familia Trichomycteridae, algunas características reproductivas difieren ligeramente, pero la estrategia es la misma [Citation34]. Se espera que especies con tipo de estrategia oportunista muestren respuestas rápidas frente a hábitats que son sometidos a patrones de perturbación frecuente [Citation68].
Agradecimientos
Agradezco a los revisores anónimos y a Rodrigo Gómez Ales por los comentarios y sugerencias que ayudaron a enriquecer este trabajo. A la secretaria de ambiente y desarrollo sustentable por los permisos otorgados para la realización de este trabajo.
Disclosure statement
No potential conflict of interest was reported by the author(s). /Los autores no han referido ningún potencial conflicto de interés en relación con este artículo.
References
- Acosta JC, Laspiur A, and Blanco G. Ictiofauna de San Juan: diversidad y distribución. Carretero, EM . San Juan: En San Juan Ambiental (editores), editorial UNSJ. 2016 ; 1. pp. 237–257.
- Fernández L, Nadalin DO, López HL, et al. Lista de los peces de la provincia de Santiago del Estero. ProBiota, Serie Técnica y Didáctica. 2014;28:1–12.
- Zaniboni-Filho E, Ribolli J, and Hermes-Silva S, et al. Wide reproductive period of a long-distance migratory fish in a subtropical river, Brazil. Neotropical Ichthyology. 2017;15:1–7.
- Perez CHF, Minoli I, and Gosztonyi AE. La fauna íctica del río Olta y primer registro de Cheirodon interruptus (Characiformes: Characidae) en la provincia de La Rioja, Argentina. Nótulas Faunísticas - Segunda Serie. 2017. p.1-5.
- Campos H, Ruiz VH, Gavilán JF, et al. Peces del Río Biobío. Publicaciones de Divulgación EULA. 1993;5:100.
- Granado LC. De la Historia y el futuro de la ecología. In: Ecología de comunidades: el paradigma de los peces de agua dulce. Vol:59 Universidad de Sevilla . 2000. p. 94.
- Balon EK. Epigenesis of an epigeneticist: the development of some alternative concepts on the early ontogeny and evolution offishes. Guelph ichthyology reviews. 1990. p. 1–48.
- Cousseau MB. Ictiología, Aspectos Fundamentales, La vida de los Peces Sudamericanos Editorial: EUDEM Universitaria de Mar del Plata. 2010. p. 670.
- Bromage N. Porter M, and Randall C. The environmental regulation of maturation in farmed finfish with special reference to the role of photoperiod and melatonin. Aquaculture. 2001;197:63–98.
- Vazzoler AEAM. Manual de métodos para estudos biológicos de populações de peixes: reprodução e crescimento. CNPq Programa Nacional de Zoologia. Brasília. 1981. p.108.
- Romero NM, Vera-Mesone R. Cambios estacionales en los ovarios de peces Siluriformes: comparación de tres especies en un ambiente subtropical de Argentina. Cuadernos de Investigación UNED. 2010;2:255–262.
- Lundberg JG, Berra TM, Friel JP. First description of small juveniles of the primitive catfish Diplomystes (Siluriformes: Diplomystidae). Explor Freshwaters. 2004;15(1):71–82.
- Monasterio De Gonzo G. Peces de los ríos Bermejo, Juramento y Cuencas Endorreicas de la Provincia de Salta. EUNSA. Argentina: Salta; 2003.
- Power EM, Stout RJ, Cushing CE, et al. Biotic and abiotic controls in river and stream communities. J Nort Am Benthol Soc. 1988;7(4):456–479.
- Arratia G. Preferencias de hábitat de peces Siluriformes de aguas continentales de Chile (Fam. Diplomystidae y Trichomycteridae). Stud Neotrop Fauna Environ. 1983;18(4):217–237.
- Aguirre A, and Mendoza R Especies exóticas invasoras: impactos sobre las poblaciones de flora y fauna, los procesos ecológicos y la economía. Sarukhán, J.(Coord. gen.) . Capital natural de México, vol. II: estado de conservación y tendencias de cambio. Conabio. México; 2009. p. 277–318.
- De Pinna MCC. Phylogenetic relationships of Neotropical Siluriformes (Teleostei: Ostariophysi): historical overview and synthesis of hypotheses. In: Malabarba LR, Reis RE, Vari RP, Lucena ZM and Lucena CAS. (Eds.). Phylogeny and classification of neotropical fishes. Porto Alegre: EDIPUCRS; 1998. p. 279–330.
- Arratia G, and Menu-Marque S. Revision of the freshwater catfishes of the genus hatcheria (siluriformes, trichomycteridae) with commentaries on ecology and biogeography. Zool Anzeiger. 1981; 207 (1/2) :88–111.
- Unmack PJ, Barriga JP, Battini MA, et al. Phylogeography of the catfish Hatcheria macraei reveals a negligible role of drainage divides in structuring populations. Mol Ecol. 2012;21(4):942–959.
- Bello MT, and Ubeda CA. Estado de conservación de los peces de agua dulce de la Patagonia Argentina. Aplicación de una metodología objetiva. Gayana Zoologia. 1998 62.1 :45–60.
- Chebez JC. Los que se van. Albatros, Bs.As; 1994; p. 604.
- Lopez J, Roman-Valencia C. Sobre la biología del corroncho Chaetostoma fischeri (Steindachner, 1879) (Pisces: loricariidae) en el río de La Vieja, Alto Cauca, Colombia. Bol Ecotrópica Ecossistemas Tropicales. 1996;3:37–57.
- Menni RC. Peces y ambientes en la Argentina continental. Monografías del Museo Argentino de Ciencias Naturales. Naturales. Buenos Aires; 2004.
- Ringuelet RA, Aramburu RH. Los peces argentinos de agua dulce. Comisión Científica de la provincia de Buenos Aires, La Plata. Argentina: Buenos Aires; 1967. p. 602.
- Adriaens D, Baskin JN, Coppens H. Evolutionary morphology of trichomycteridae catfishes: about hanging on and digging in. In: Nelson JS, Schultze H-P, Wilson MVH, editors. Origin and phylogenetic interrelationships of Teleosts. Verlag Dr. Munich: Friedrich Pfeil; 2010. p. 337–362.
- Di Prinzio CY, Casaux RJ. Dietary overlap among native and non-native fish in Patagonian low-order streams. International Journal of Limnology. 48. 2012. p. 21–30.
- Ferriz RA. Dieta de Hatcheria macraei (Girard, 1855) (Teleostei, Siluriformes, Trichomycteridae) en el río Chubut, Argentina. Short Communication. Lat Am J Aquat Res. 2012;40(1):248–252.
- Garcia MI, Acosta JC, García ML. Trophic interactions between a native catfish (Trichomycteridae) and a non-native species, the rainbow trout, in an Andean stream, San Juan, Argentina. Aquat Ecosyst Health Manage. 2017;20(4):344–352.
- Barriga JP, Battini MA. Ecological significances of ontogenetic shifts in the stream-dwelling catfish, Hatcheria macraei (Siluriformes, Trichomycteridae), in a Patagonian river. Ecol Freshwater Fish. 2009;18(3):395–405.
- Ferriz RA. Alimentación de Olivaichthys viedmensis (Mac Donagh, 1931) y Hatcheria macraei (Girard, 1855) (Teleostei: siluriformes) en el Río Limay, Alicurá, Argentina. Naturalia Patagónica. 1994;2(1–2):83–88.
- Ortiz SG, Acosta JC, and Murua F. Fauna de vertebrados y actividad minera: estudio de lınea de base en la cuenca cuenca del Rıo Castaño, San Juan, Argentina (Vertebrate fauna and mining activity: baseline study in the Castaño river basin, San Juan, Argentina.Multequina . Vol 12. Mendoza, Argentina. 2003. p. 23–35.
- Unmack PJ, Habit EM, Johnson JB. New records of Hatcheria macraei (Siluriformes, Trichomycteridae) from Chilean province. Gayana. 2009;73:102–110.
- Scrocch G, and Kretzschmar S. Guía de métodos de captura y preparación de anfibios y reptiles para estudios científicos y manejo de colecciones herpetológicas. Miscelánea. Vol. 102. Tucuman: Fundación Miguel Lillo. Centro de Información Geobiológica - NOA; 1996. p. 3–44.
- Chiarello-Sosa JM, Battini MA, Barriga JP. Reproductive strategy of the Patagonian catfish Hatcheria macraei. J Fish Biol. 2016;89(3):1810–1827.
- Saborido-Rey F. Ecología de la reproducción y potencial reproductivo en las poblaciones de peces marinos. Vol. 34. España: Instituto de Investigaciones Marinas (CSIC) Universidad de Vigo Curso doctorado; 2004. p. 1–71.
- García-Díaz MM, Tuset VM, González JA, et al. Sex and reproductive aspects in serranus cabrilla (osteichthyes: serranidae): macroscopic and histological approaches. Mar Biol. 1997;127(3):379–386.
- Cren EDL, Le Cren ED. The Length-Weight relationship and seasonal cycle in gonad weight and condition in the perch (perca fluviatilis). J Anim Ecol. 1951;20(2):201–219.
- Bohemen CG, Lambert JGD, Peute J. Annual changes in plasma and liver in relation to vitellogenesis in the female rainbow trout, Salmo gairdneri. Gen Comp Endocrinol. 1981;44(1):94–107.
- Granado LC, Ecología DP. Universidad de Sevilla. Secretariado de Publicaciones Serie: Ciencias. 1996;45:353.
- Mcbride RS, Somarakis S, Fitzhugh GR, et al. Energy acquisition and allocation to egg production in relation to fish reproductive strategies. Fish Fisheries. 2013;16(1):23–57.
- Csirke BJ. Introducción a la dinámica de poblaciones de peces. Número 192 de FAO fisheries technical paper FAO. Documentos Técnicos de Pesca Food & Agriculture; 1980.
- Riesch R, Plath M, Schlupp I, et al. The offspring size/fecundity trade-off and female fitness in the Atlantic molly (Poecilia mexicana, Poeciliidae). Environ Biol Fish. 2012;94(2):457–463.
- Nikolski CV. The ecology of fishes. London: Academic Press; 1963. p. 352.
- Stergiou KI, Economidis P, Sinis A. Sex ratio, spawning season and size at maturity of red bandfish in the western Aegean Sea. J Fish Biol. 1996;49(4):561–572.
- Casatti L. Biology of acatfish, Trichomycterus sp. (Pisces, Siluriformes) in apristine stream in the Morro do Diabo State Park, Southeastern Brazil. Studies on Neotropical Fauna and Environment2003 ;38(2): 105–110.
- Lekshmi R, Chandran, Prasad G. Reproductive characters of yellow catfish Horabagrus brachysoma (horabagridae) from periyar river, Western Ghats. Dept. of Zoology, University of Kerala, Kariavattom, Thiruvananthapuram, Kerala. J Aquat Biol Fisher. 2014;2(1):154–161.
- Vila I, Contreras M, Fuentes L. Reproducción de Diplomystes nahuelbutensis Arratia, 1987 (Pises: diplomystidae). Gayana Oceanología. 1996;4:129–137.
- Wootton RJ. Ecology of Teleost fishes. Chapman and Hall. Fish Fisher Ser. 1990;1:404.
- Goméz F, Acosta JC, and Garcia M, et al. Reproducción de la especie vulnerable Olivaichthys cuyanus (Siluriformes: diplomystidae), en el río cordillerano Los Patos, San Juan, Argentina: bases para su conservación. Tesis de Licenciatura en Biología. San Juan, Argentina: Universidad Nacional de San Juan; 2018.
- Rapp PLH and Fernandes CC. Dimorfismo sexual em Siluriformes e Gymnotiformes (Ostariophysi) da Amazônia. Acta amazónica. 2005; 35: 97–110.
- Nagahama Y. The funtional morphology of teleosts gonads. In: Hoar WS, Randall DJ, Donaldson EM, editors. Fish physiology. Vol. XI: reproduction. New York: Academic Press; 1983. p. 223–275.
- Chiarello-Sosa JM. The importance of substrate size and interstitial space in the microhabitat selection by the stream-dwelling catfish Hatcheria macraei (Actinopterygii, Trichomycteridae). Hydrobiologia. 2013 ;705: 191–206.
- Jobling M. Environmental biology of fishes. 1st ed. London: Chapman & Hall; 1996.
- Matthews WJ. Morphology, habitat use, and life history. In: Matthews WJ, editor. Patterns in freshwater fish ecology. New York NY: Chapman & Hall; 1998. p. 455–531.
- Durham BW, Wilde GR. Asynchronous and synchronous spawning by smalleye shiner Notropis buccula from the Brazos River, Texas. Ecol Freshwater Fish. 2008;17(4):528–541.
- Schindler DW. Widespread effects of climatic warming on freshwater ecosystems in North America. Hydrol Process. 1997;11(8):1043–1067.
- Martin MH. The effects of temperature, river flow, and tidal cycles on the onset of glass eel and elver migration into freshwater in the American eel. J Fish Biol. 1995;46(5):891–902.
- Rahman M, Han H, and Kim K, et al. Apparent digestibility coefficients of the extruded pellet diets containing various fish meals for olive flounder, paralichthys olivaceus. Fish Aquat Sci. 2016 19(1) ;1–8.
- Graeff A, Tomazelli A, Pruner EN. Variação percentual e freqüencia de alimento fornecido no desenvolvimento final de jundiás (Rhamdia quelen) na fase de pós-larvas. Rev Electrón Vet. 2008;9:1–9.
- Licande R, Barrientos CAY, González MT. Age, growth rates, sex change and feeding habits of notothenioid fish Eleginops maclovinus from the central-southern Chilean coast. Environ Biol Fish. 2006;77(1):51–61.
- Shine R. Parental care in reptiles. In: Gans C, Huey RB, Alan R, editors. Biology of the reptilia. Vol. 16. New York: Liss; 1988. p. 275–330.
- Rodríguez GM. Técnicas de evaluación cuantitativa de la madurez gonádica en peces. México D.: FAGT Editor, S. A.; 1992.
- Habit E, Victoriano P, Campos H. [Trophic ecology and reproductive aspects of Trichomycterus areolatus (Pisces, Trichomycteridae) in irrigation canal environments]. Revista de Biología Tropical. 2005;53(1–2):195–210.
- Froese BR. Cube law, condition factor and weight–length relationships: history, meta-analysis and recommendations. J Appl Ichthyol. 2006;22(4):241–253.
- Sisneros JA, Alderks PW, Leon K, et al. Morphometric changes associated with the reproductive cycle and behaviour of the intertidal-nesting, male plainfin midshipman Porichthys notatus. J Fish Biol. 2009;74(1):18–36.
- Arellano MM, Rojas HA, and García F, et al. Ciclo reproductivo del pargo lunarejo Lutjanus guttatus (Steindachner, 1869) en las costas de Guerrero, México. Revista Biol Mar Oceanogr. 2001;36(1):1–8.
- Jaramillo AM. Estudio de la biología trófica de cinco especies de peces bentónicos de la Costa de cullera. Relaciones con la acumulación de metales pesados. Tesis doctoral universidad politécnica de valencia departamento de ingeniería hidráulica y medio ambiente; 2009.
- Winemiller KO y Rose KA. Patterns of life-history diversification in North American fishes: implications for population regulation. Can J Fisheries Aquat Sci. 1992;49(10):2196–2218.
