 ?Mathematical formulae have been encoded as MathML and are displayed in this HTML version using MathJax in order to improve their display. Uncheck the box to turn MathJax off. This feature requires Javascript. Click on a formula to zoom.
?Mathematical formulae have been encoded as MathML and are displayed in this HTML version using MathJax in order to improve their display. Uncheck the box to turn MathJax off. This feature requires Javascript. Click on a formula to zoom.RESUMEN
En este estudio, basándonos en evidencias morfológicas y moleculares, describimos una nueva especie del género Pristimantis que habita en las montañas y valles áridos de la provincia del Azuay, incluyendo zonas urbanas y periurbanas de la ciudad de Cuenca. La nueva especie se destaca por presentar una textura dermal externa fuertemente granulada, una papilla proyectada en la punta del hocico y un canto de advertencia que consiste en series combinadas de tres y dos notas, Morfológicamente, la nueva especie es similar con P. cajamarcensis, P. ceuthospilus, P. jimenezi, P. lojanus, P. phoxocephalus y P torresi, por presentar una quilla en la punta del hocico, sin embargo, su textura dermal fuertemente granular, ausencia de tubérculos, y su coloración rosácea con reticulaciones irregulares oscuras y una características barra interorbital blanca, la distinguen de estas especies. Con P. cajamarcensis, P. ceuthopilus y otras dos especies con incertidumbre taxonómica, forma un clado distribuido en el sur de Ecuador y norte de Perú. Nuestros resultados resaltan la importancia de aumentar estudios taxonómicos a fin de documentar eficazmente la biodiversidad en la región andina, así como, la importancia de desarrollar planes de monitoreo y conservación que incluyan a especies que habitan en áreas urbanas y semiurbanas.
Abstract
In this study, based on morphological and molecular evidence, we described a new species of the Pristimantis genus inhabiting the mountains and dry inter-Andean dry valleys in the Azuay province, including urban and semiurban areas in the city of Cuenca. The new species is characterized by coarsely granulated dermal texture, papillae in the tip of the snout, and an advertisement call consisting of a combined series of three and two notes. Morphologically, the new species is similar to P. cajamarcensis, P. ceuthospilus, P. jimenezi, P. lojanus, P. phoxocephalus, and P. torresi. However, it can be differentiated from this species by its dermal texture, absence of tubercles in the dorsum, and its pinkish-brown coloration with dark irregular reticulations and the interorbital white stripe. The new species forms a strongly supported clade distributed in southern Ecuador and northern Peru with P. cajamarcensis, P. ceuthopilus, and two other Pristimantis with taxonomic uncertainty. Our results highlight the importance of taxonomic studies to document the biodiversity in the Andean region and to develop monitoring and conservation plans that include species that inhabit urban and semi-urban areas.
Palabras clave:
Introducción
El género Pristimantis está conformado por ranas terrestres de desarrollo directo que habitan una variedad de ecosistemas en las regiones de sur y centro América. Actualmente, el género incluye a 588 especies formalmente descritas [Citation1], con un porcentaje importante de esta diversidad distribuido en los ecosistemas altoandinos de Colombia, Ecuador y Perú [Citation2,Citation3]. Estudios enfocados en la taxonomía y sistemática de Pristimantis han sido constantes, por ejemplo, solo en años recientes (2019–2021), se han documentado, delimitado y formalmente descrito 60 nuevas especies [Citation4–32]. Estas contribuciones taxonómicas han enriquecido nuestro conocimiento de la diversidad y complejas relaciones filogenéticas de Pristimantis, especialmente en ecosistemas de bosques montanos y páramos, donde la mayoría de nuevas especies han sido descritas [Citation4–6,Citation16,Citation20–25,Citation27,Citation29]. No obstante, estos estudios también sugieren que la diversidad de Pristimantis en estos ecosistemas aún no está completamente comprendida y requiere ser documentada [Citation5,Citation6,Citation16,Citation29].
La provincia del Azuay está ubicada en la región sur del Ecuador. La mayor parte de la provincia abarca diversos ecosistemas montanos y de páramo en las zonas orientales y occidentales de la cordillera de los Andes, así como ecosistemas de matorrales que son característicos de los valles interandinos [Citation33]. Sin embargo, la vegetación nativa en el Azuay al igual que, en otras regiones de los Andes, ha sufrido extensas modificaciones [Citation34,Citation35], especialmente en los valles interandinos [Citation36,Citation37], donde se encuentran los centros poblados más grandes (p. ej. Cuenca, la tercera ciudad más grande del Ecuador) y las áreas agrícolas son extensas. Como resultado, estos ecosistemas se encuentran fuertemente fragmentados [Citation36]. Esta discontinuidad del hábitat tiene el potencial de impactar directamente a poblaciones de pequeños vertebrados terrestres, como los anfibios [Citation37–39]. Así, estudios taxonómicos enfocados en documentar y describir la diversidad y distribución de anfibios en esta región son relevantes como punto de partida para explorar a futuro como poblaciones están siendo afectadas por presiones en sus hábitats y para aportar al entendimiento de relaciones evolutivas en grupos altamente diversos.
En este estudio, nosotros describimos una nueva especie de Pristimantis que se encuentra distribuida en el valle interandino en la provincia del Azuay, incluyendo localidades dentro de la zona urbana y periurbana de la ciudad de Cuenca. Delimitamos a la nueva especie con base en evidencia filogenética y comparaciones morfológicas con otras especies del género Pristimantis.
Métodos
Los muestreos se realizaron con la metodología de inventario de especies [Citation40], e incluyeron muestreos diurnos y nocturnos entre 09:00–11:00 y 19:00–23:00. Los especímenes fueron eutanasiados con roxicaína al 5%, fijados en formaldehido al 10% y preservados en alcohol etílico al 70% [Citation41]. El sexo y la edad de los especímenes se determinaron a través de caracteres externos y el reconocimiento de órganos sexuales internos mediante una incisión dorsolateral.
El material examinado para la descripción y comparación morfológica (Apéndice Tabla I) está depositado en las colecciones del Museo Zoología de la Universidad del Azuay (MZUA), Cuenca, Ecuador; Museo de Zoología de la Universidad San Francisco de Quito (ZSFQ), Quito, Ecuador; Museo de Zoología, Universidad Técnica Particular de Loja (MUTPL), Loja, Ecuador; Museo del Centro de Conservación de Anfibios Amaru (MCCAA), Cuenca, Ecuador; Museo de Zoología de la Universidad Católica del Ecuador (QCAZ), Quito, Ecuador y Kansas Museum of Natural History (KU), Kansas, USA.
Amplificación y secuenciación del ADN
Extrajimos ADN genómico de muestras de hígado preservados en etanol al 96% de cinco individuos (ZSFQ4149, ZFSQ4159, MZUA0109, MZUA1816, MZUA1817). El ADN de tres individuos con el código ZSFQ fue extraído usando Extract-N-Amp™ Tissue PCR Kit (Sigma-Aldrich) siguiendo los protocolos del fabricante, mientras que el ADN de los individuos con código MZUA fue extraído usando el protocolo diseñado por [Citation42]. Amplificamos dos regiones de gen mitocondrial (12S y 16S) y un gen nuclear (RAG-1) usando los cebadores detallados en la Tabla Apéndice II, siguiendo los protocolos descritos en [Citation43,Citation44]. Cada reacción de PCR tuvo una concentración final de 1.5 mM MgCl2, 0.5 mM dNTP, 0.25 U/μL de ADN polimerasa Taq (Invitrogen) y 0.2 μl de cada cebador, en un volumen total de 25 μL. La amplificación por PCR fue corroborada mediante electroforesis con un gel de agarosa al 1%. Los productos fueron purificados usando Exosap (ThermoFisher Scientific) y secuenciados en Macrogen Inc (Correa del Sur). Todas las secuencias obtenidas fueron limpiadas y ensambladas en Geneious 11.1.5.
Análisis filogenéticos y distancias genéticas
Las secuencias de individuos de la nueva especie fueron alineadas con las secuencias más similares que identificamos en BLAST, todas las secuencias resultaron en >88% de similitud con miembros del género Pristimantis por lo tanto buscamos incluir a los clados principales de Pristimantis basados en las filogenias de Guayasamin et al. y Páez & Ron [Citation5,Citation45], los códigos de acceso de los especímenes usados están detallados en la Tabla Apéndice III. Las secuencias fueron alineadas usando MAFFT V7 [Citation46], con la estrategia Auto-Primero realizamos el alineamiento con los parámetros por defecto, sin embargo, posteriormente incrementamos la penalidad de brecha (del inglés “gap”) a 1.7 para reducir la frecuencia de brechas innecesarias en el alineamiento. Definimos a Epipedobates boulengeri y Barycholos pucher como grupos externos. Primero, realizamos alineamientos independientes de los genes mitocondriales y el gen nuclear. Los alineamientos fueron revisados y editados en MEGA X. Realizamos correcciones manuales posteriores para remover brechas innecesarias y verificar que el marco de lectura sea el adecuado. Después, concatenamos los alineamientos de 12S, 16S y RAG-1 en una matriz que usamos para inferir las relaciones filogenéticas basadas en todos los genes. Usamos PartitionFinder2 [Citation47] bajo el criterio de información bayesiana para encontrar el mejor modelo de evolución. Posteriormente, realizamos árboles filogenéticos bajo el criterio de Máxima Verosimilitud en IQ-tree [Citation48], el soporte de los nodos fue obtenido generando 1000 muestras de boostrap ultra-rápido(bb). Adicionalmente, realizamos un árbol filogenético basado en inferencia bayesiana usando el alineamiento de los tres genes concatenados en MrBayes v.3.1.2 [Citation49]. Usamos dos corridas independientes de 5,000,000 generaciones y cuatro cadenas muestreando cada 1000 generaciones. Las primeras 1,250,000 generaciones fueron descartadas como burn-in. Para visualizar las muestras generadas a partir del análisis bayesiano y confirmar que la probabilidad posterior(pp) había alcanzado un máximo local estacionario, utilizamos TRACER [Citation50]. Finalmente, obtuvimos distancias p-genéticas no corregidas entre la nueva especie y clados cercanos, usando los fragmentos 12S y 16S en MEGA X.
Datos morfológicos
La descripción sigue el formato estándar de Lynch & Duellman [Citation2] y la clasificación sistemática de Heinicke et al. [Citation51]. Las medidas se realizaron con un calibrador de precisión e igualadas al 0,1 mm más cercano y las abreviaciones utilizadas siguen el formato de Duellman & Lehr [Citation3]: DON = distancia órbita-narina (desde el margen anterior de la órbita hasta el margen posterior de la narina); LC = longitud cefálica (desde el margen posterior de la mandíbula hasta el extremo del rostro); AC = ancho cefálico (entre las comisuras de la boca); DIO = distancia interorbital (entre los bordes internos de las órbitas en vista dorsal); DIN = distancia internarial (entre los bordes internos de las narinas); LRC = longitud rostro-cloacal (desde la punta del hocico hasta la cloaca); LT = longitud de la tibia (distancia desde la rodilla hasta el borde distal de la tibia); LP = longitud del pie (desde el margen proximal del tubérculo metatarsal interno hasta la punta del dedo IV); LM = longitud de la mano (desde la base del tubérculo tenar hasta la punta del dedo III); DT = diámetro horizontal del tímpano; DO = longitud horizontal del ojo; AP = ancho del párpado (entre los bordes externo e internos del párpado).
Los patrones de coloración en vida y demás características importantes, fueron tomados de las notas de campo de los autores y fotografías de los especímenes en campo y laboratorio. Las coordenadas y elevación de los sitios de muestreo fueron registradas con GPS Garmin, modelos Etrex 10 y 64SC. Los créditos fotográficos e información asociada por parte de los autores siguen las siguientes siglas: Eduardo Toral (ETC), Juan C. Sánchez (JCS), Verónica L. Urgiles (VLU).
Análisis del canto de anuncio
ETC, JCS y Lorena Orellana, grabaron los cantos de dos machos (ZSFQ 4150–51), el 19 de septiembre de 2020, en la localidad de Challuabamba, Quebrada de Apangoras (−2.854194S, −78.898917O, 2379 m de elevación). Los individuos estaban ubicados en hojas de arbustos (Dodonaea) y pencos (Agave), a 100 y 50 cm respectivamente. Las grabaciones se realizaron a una distancia lineal de dos metros, iniciando a las 19:10 h y finalizando a las 21:00 h (temperatura = 14.3°C, humedad relativa = 89.2%, velocidad del viento = 0.5 m/s).
Utilizando una grabadora manual (ZOOM H1), con micrófonos estéreos incorporados e X/Y a 90°. La frecuencia de muestreo fue de 44 kHz y resolución de 24 bits, en formato de archivo WAV. La temperatura del aire y la humedad se tomaron con un medidor meteorológico/ambiental (Kestrel 5400). Medimos los parámetros temporales de los oscilogramas y los parámetros espectrales de los espectrogramas al 90% de superposición en un ancho de banda de 1024 puntos y un límite espectral de 4 kHz, con el software Raven Studio 1.5 [Citation52]. El canto fue graficado en un audioespectrograma utilizando R [Citation53], mediante los paquetes seewave y tuneR [Citation54,Citation55]. Las grabaciones fueron depositadas en el repositorio de cantos del Museo de Zoología de la Pontificia Universidad Católica del Ecuador (PUCE).
La terminología y las mediciones de los parámetros siguen a las sugerencias realizadas por Köhler et al. [Citation56], midiendo los siguientes parámetros temporales y espectrales: (1) duración de la nota: la duración de una sola nota dentro del canto, medida desde el principio hasta el final de la nota; (2) intervalo entre notas: el intervalo entre dos notas consecutivas dentro del mismo canto, medido desde el final de una nota hasta el comienzo de la nota consecutiva; (3) tasa de notas: número de notas por segundo, medido como el tiempo entre el comienzo de la primera nota y el comienzo de la última nota; (4) frecuencia dominante: la frecuencia que contiene la energía sonora más alta, medida a lo largo de todo el canto; (5) la duración del canto y; (6) número de notas por canto.
Resultados
Filogenia y distancias genéticas
La matriz final estuvo conformada por 171 terminales e incluyó un fragmento concatenado de los genes mitocondriales y nucleares de 3265pb. El mejor esquema de partición incluyo tres subconjuntos. El primer subconjunto incluyo el fragmento 12S y 16S y el mejor modelo de sustitución fue GTR+I + G. El segundo subconjunto incluyó al primer y segundo codón del gen RAG-1 y el mejor modelo de sustitución fue HKY+I + G, mientras que el tercer conjunto incluyó al tercer codón de RAG-1 y el mejor modelo de sustitución fue HKY+G. Los análisis con inferencia bayesiana y de máxima verosimilitud muestran un clado fuertemente soportado (bb = 100%, pp = 1), conformado por siete individuos de la nueva especie, incluyendo a dos especímenes QCAZ29206 y MZUTI3936 que corresponden a secuencias previamente disponibles en GenBank. La nueva especie es cercana a P. cajamarcensis, P. ceuthospilus y otros Pristimantis no identificados (QCAZ4510, QCAZ45210, QCAZ47353), con los cuales, forma un clado fuertemente soportado (bb = 100%, pp = 0.99). Las distancias genéticas entre la nueva especie y especies cercanamente relacionadas son >9% (, ). La filogenia basada en máxima verosimilitud incluyendo las 171 terminales se presenta en Material suplementario.
Figura 1. Relaciones filogenéticas de Pristimantis morlaco sp. nov. Fragmento del árbol de máxima verosimilitud obtenido a partir de análisis de secuencias de ADN mitocondrial (12S y 16S) y nuclear (RAG-1). Los valores de soporte bootstrap (bb) se muestran para cada nodo; (*) representa bb = 100. El código de museo para cada terminal se presenta antes del nombre de la especie.
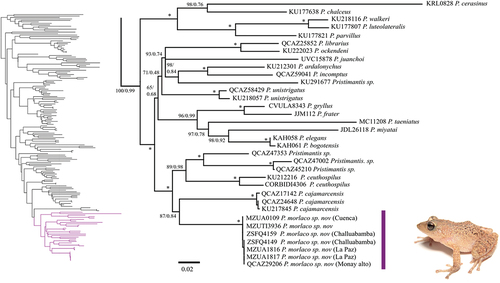
Tabla 1. Promedio de distancias genéticas no corregidas, por pares, entre Pristimantis morlaco sp. nov. y especies genéticamente cercanas. Los datos de la diagonal en negrita corresponden a distancias genéticas intraespecíficas, los datos entre paréntesis corresponden a las distancias mínimas y máximas por pares.
Pristimantis morlaco sp. nov. ()
Figura 2. Mapa de distribución de Pristimantis morlaco sp. nov. En el recuadro ampliado se muestran los registros del material tipo (triángulo verde y círculos rojos) y observaciones adicionales (círculos amarillos), rango de elevación y ríos limitantes.
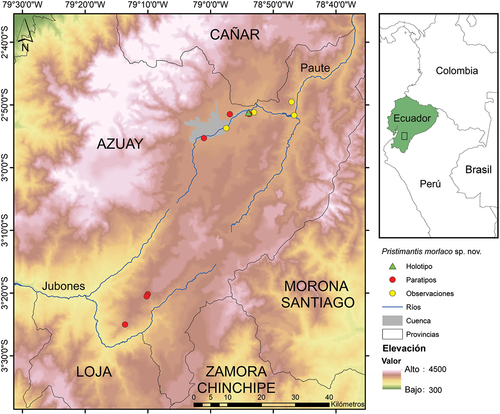
Figura 3. Vistas: a) dorsal, b) ventral, c) frontal y d) lateral del holotipo (ZSFQ 4150) de Pristimantis morlaco sp. nov., macho adulto, en vida (LRC = 25.5 mm). Fotografías: JCS.

Figura 4. Vista dorsal (a) y ventral (b) del holotipo (ZSFQ 4150) de pristimantis morlaco sp. nov., macho adulto, en preservado (LRC = 25.5 mm). fotografías: JCS.

Figura 5. Detalle de la cabeza en vistas: a) dorsal, b) lateral. Vista ventral de: c) manos y detalle de excrecencia nupcial (arriba indicado con flecha roja), d) pies, del holotipo (ZSFQ 4150) de pristimantis morlaco sp. nov., en preservado. fotografías: JCS.

Figura 6. Variación de coloración de Pristimantis morlaco sp. nov: a) MZUA AN 1821, macho subadulto (LRC = 20.1 mm), b–d) MZUA AN 1816–7, ZSFQ 4151, machos adultos (LRC = 24.4, 24.6, 25.8 mm), e–g) MZUA AN 0535–6, ZSFQ 4149, hembras adultas (LRC = 25.2, 25.6, 26.4 mm). Fotografías: JCS.

Figura 7. Espectrogramas y oscilogramas del canto de anuncio del holotipo (ZSFQ 4150) de Pristimantis morlaco sp. nov. LRC = 25.5 mm, temperatura = 14.3°C, humedad relativa = 89.2%, velocidad del viento = 0.5 m/s. Las figuras corresponden a las series 1 (izquierda) y 2 (derecha) que componen al canto.
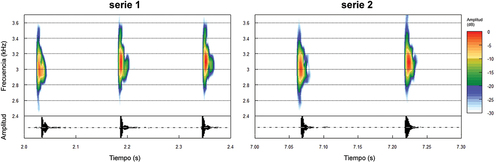
Figura 8. Hábitat e historia natural de Pristimantis morlaco sp. nov. a) Individuos encontrados en vegetación junto a quebradas estacionales en zonas áridas, con abundancia de arbustos, bromelias y hierbas. b) Paratipo MZUA AN 0108 oculto en el interior de una bromelia durante el día. c) Pareja en amplexus. Fotografías: JCS (a, b) y José M. Falcón (c).

Pristimantis sp. aff. phoxocephalus Siavichay-Pesántez et al. 2016
Pristimantis phoxocephalus (GenBank: MZUTI 3936) Herrera 2019
Pristimantis sp. (GenBank: QCAZ 29206) Páez & Ron 2019
LSID: CC8DA7EB-66ED-4DBB-81F4-A5ED175F7A19
Nombre común en español: Cutín morlaco
Nombre común en inglés: Morlaco Rainfrog
Holotipo
ZSFQ 4150 macho adulto, colectado en la Quebrada de Apangoras, sector de Challuabamba (−2.854194S, −78.898917O, 2379 m de elevación), cantón Cuenca, provincia del Azuay, Ecuador, por JCS, ETC y Lorena Orellana el 19 de septiembre de 2020 ().
Paratipos
ZSFQ 4149, hembra adulta y ZSFQ 4151, macho adulto, con los mismos datos del Holotipo. MZUA AN 0108, macho adulto y MZUA AN 0109 hembra adulta, colectados en el sector de Mall del Río (−2.921584S, −79.017427O, 2550 m de elevación), cantón Cuenca, provincia del Azuay, por ETC y JCS, el 15 de noviembre de 2009. MZUA AN 0535, MZUA AN 0536 hembras adultas, colectadas en la hacienda “El Gullán” (−3.336451S, −79.166580O, 2979 m de elevación), cantón La Paz, provincia del Azuay, por JCS, Elvis Celi y Valentina Posse, el 18 de mayo de 2014. MZUA AN 1816, MZUA AN 1817, machos adultos, colectados en la hacienda “El Gullán” (−3.342153S, −79.169602O, 2938 m de elevación), cantón La Paz, provincia del Azuay, por VLU y Karla Neira, el 05 de enero de 2017. MUTPL 1007, macho adulto, colectado en Susudel (−3.416967S, −79.227122O, 2767 m de elevación), cantón San Felipe de Oña, provincia del Azuay, por Paul Székely y Diana Székely, el 08 de enero de 2021. CCM-A 0300, CCM-A 0301, machos adultos y CCM-A 0299, hembra adulta, colectados en el sector de Ricaurte (−2.858062S, −78.948629O, 2463 m de elevación), Cuenca, provincia del Azuay, por Fausto Siavichay, el 24 de julio de 2017 ().
Etimología
La asignación específica morlaco proviene del calificativo “Morlaco”, puesto por Francisco José de Caldas en el siglo XVIII, a los habitantes de la ciudad de Cuenca y todo el Azuay, usado coloquialmente para referirse a personas nacidas en esta provincia.
Definición
Pristimantis morlaco (, ) se caracteriza por presentar la siguiente combinación de caracteres: (1) piel de la cabeza y dorso, flancos, vientre y extremidades granular con verrugas redondeadas elevadas; pliegues dorsolatelares ausentes; pliegue discoidal presente, completo; (2) membrana y anillo timpánico presentes, equivale al 46% del DO, borde inferior del anillo timpánico con dos tubérculos postrictales; (3) hocico largo subacuminado en vista lateral y dorsal, con una papila rostral en la punta del hocico; (4) DIO mayor a AP; crestas craneales ausentes; (5) coanas parcialmente ocultas por el piso palatal del maxilar, procesos odontóforos vomerinos oblicuos, debajo del nivel de las coanas y ampliamente separados entre sí, con diminutos dientes (1, 2); (6) hendiduras bucales y saco vocal presente, subgular; (7) excrecencias nupciales presentes en machos, poco engrosados con textura rugosa, orientados posteriormente en la primer falange del dedo I; (8) dedo I de la mano más corto que II; terminaciones digitales expandidas, discos con margen truncado o apenas elíptico; tubérculo palmar en forma de “U”; (9) dedo V del pie más largo que III que alcanza el tubérculo subarticular distal del dedo IV; dígitos expandidos, discos con margen truncado o apenas elíptico; tubérculos metatarsales, interno oval, tres veces del tamaño del externo, redondeado, tubérculos supernumerarios plantares numerosos y redondeados; (10) dedos de los pies y manos con finos rebordes cutáneos laterales, membranas interdigitales basales; tubérculos subarticulares grandes, pronunciados, más gruesos que el ancho del dedo; almohadillas digitales del pie tan grandes como las de las manos; (11) coloración dorsal y flancos café rojizo o crema rosáceo con pequeñas reticulaciones irregulares, finas, café oscuro; generalmente presenta una evidente barra interorbital blanca, incluyendo párpados, con márgenes café oscuro; vientre crema rosáceo, región gular y pectoral amarillenta; iris color bronce con finas reticulaciones café oscuro; (12) LRC en hembras de 25.2–33.6 mm ( 27.4 mm, n = 5), machos de 24.1–26.6 mm (
25.2 mm, n = 8); (13) canto de anuncio de tres y dos notas (tik-tik-tik – tik-tik), frecuencias dominantes (0.25–0.39 kHz), duración (3.57–5.21s).
Tabla 2. Medidas (en mm) de la serie tipo de Pristimantis morlaco sp. nov. Para cada sexo o estado de desarrollo, el rango y la desviación estándar ± se presentan entre paréntesis. Abreviaturas: DON = distancia órbita-narina; LC = longitud cefálica; AC = ancho cefálico; DIO = distancia interorbital; DIN = distancia internarial; LRC = longitud rostro-cloacal; LT = longitud de la tibia; LP = longitud del pie; LM = longitud de la mano; DT = diámetro horizontal del tímpano; DO = longitud horizontal del ojo; AP = ancho del párpado.
Diagnosis
Pristimantis morlaco sp. nov., se reconoce por su textura dermal densamente granular, cabeza con un perfil subacuminado, con una quilla en la punta del hocico, ausencia de crestas craneales, la presencia de excrecencias nupciales rugosas, coloración dorsal crema rosáceo con pequeñas reticulaciones oscuras y una barra interorbital blanca en la cabeza. La nueva especie se asemeja morfológicamente a P. cajamarcensis, P. ceuthospilus, P. jimenezi, P. lojanus, P. phoxocephalus y P torresi, provenientes de los Andes suroccidentales de Ecuador y noroccidentales de Perú [Citation5,Citation29,Citation57–59], por ser de tamaño pequeño (LRC≈ 20.0–40.0 mm), presentar una quilla en la punta del hocico que le otorga un perfil subacuminado en vista dorsal y, membrana y anillo timpánico prominentes. Pristimantis morlaco sp. nov. (características en paréntesis), se puede de distinguir (), de P. cajamarcensis, P. phoxocephalus, P. torresi y P. jimenezi, con textura dermal levemente granular, de P. lojanus, con textura dermal finamente tuberculada y, P. ceuthospilus, con textura áspera (fuertemente granular); de P. cajamarcensis, R. torresi, P. jimenezi y P. lojanus, por presentar tubérculos en párpados (ausentes); de P. cajamarcensis, P. phoxocephalus, P. ceuthospilus, por ausencia de tubérculos en talón (uno, bajo); de P. ceuthospilus, por ausencia de excrecencias nupciales (presentes). Pristimantis morlaco sp. nov., P. cajamarcensis, P. ceuthospilus y dos especies con incertidumbre taxonómica de Ecuador (QCAZ47002, QCAZ45210), forman un mismo clado y presentan un pliegue escapular delgado en forma de › ‹ (ausente). P. cajamarcensis, P. jimenezi y P. phoxocephalus, y las dos especies con incertidumbre taxonómica, presentan manchas con colores brillantes, amarillo o naranja, en ingles y superficies ocultas de los muslos (ausentes); P. cajamarcensis, P. ceuthospilus, P. jimenezi, P. lojanus, P. torresi, P. phoxocephalus y las dos especies con incertidumbre taxonómica, muestran múltiples diseños en patrones de coloración dorsal, combinando, tonos claros y oscuros de café, sobre colores de fondo café claro o café rojizo, con manchas negras o blancas que se pueden extender a los costados, incluyendo bandas o líneas dorsolaterales o mediodorsales de color claro (café rojizo o crema rosáceo con pequeñas reticulaciones irregulares, finas, café oscuro y una barra interorbital blanca).
Tabla 3. Características morfológicas cualitativas de Pristimantis morlaco sp. nov., con especies similares.
Descripción del Holotipo
Macho adulto (), cabeza del mismo ancho que el cuerpo, 34% de la LRC; hocico largo, subacuminado en vista dorsal y lateral, con una papila rostral inclinada postero-ventralmente, Canthus rostralis recto, narinas dirigidas latero-dorsalmente, región interorbital granular, más ancha que el párpado superior (67% de la distancia interorbital); crestas craneales ausentes; membrana y anillo timpánico prominentes, redondeados, con el margen superior del anillo timpánico cubierto por un pliegue supratimpánico, diámetro del tímpano 40% del diámetro del ojo, coanas redondeadas, no cubiertas por el piso palatar; procesos odontóforos vomerinos presentes, oblicuos, con 3 y 4 dientes; lengua más ancha que larga, la región posterior de la lengua sujeta al piso de la boca en un 30%.
Piel del dorso, flancos y extremidades fuertemente granular; pliegues dorsolaterales ausentes; vientre areolado, superficie de la garganta débilmente areolada. Pliegue discoidal visible; cloaca y la región posterior del urostilo areolado (). Superficie ulnar y tarsal granular con tubérculos redondeados más pronunciados, un tubérculo tarsal más pronunciado, redondeado; tubérculos supernumerarios palmares y plantares redondeados notorios, tubérculo palmar externo forma una “U” y es del mismo largo que interno; tubérculos subarticulares redondeados proyectados en dirección a la punta de los dígitos en vista lateral; dedos de manos y pies con delgados rebordes cutáneos, con membranas interdigitales basales entre los dedos de los pies; dedo manual I más corto que dedo II, discos truncados a apenas elípticos y medianamente expandidos lateralmente a excepción de disco I que es apenas expandido, todos los discos con rebordes circunferenciales bien definidos ().
Extremidades posteriores largas, largo de la tibia 53% de LRC; talón con numerosos tubérculos redondeados, pliegue metatarsal presente; discos de los dedos de los pies truncados a apenas elípticos, medianamente expandidos lateralmente a excepción de los dedos I y II que son apenas expandidos; largo relativo de los dedos de los pies 1 < 2 < 3 < 5 < 4; dedo pedial V sobrepasa el borde distal del último tubérculo subarticular del dedo IV; dedo pedial III alcanza el borde distal del penúltimo tubérculo subarticular del dedo IV; tubérculo metatarsal interno oval tres veces más grande que el tubérculo metatarsal externo que es redondeado y proyectado antero-ventralmente ().
Coloración del Holotipo en preservado
Dorsalmente, coloración de fondo salmón con reticulaciones de color café oscuro y una delgada línea vertebral café oscura, en la cabeza presenta una barra interorbital crema con márgenes irregulares café oscuro, párpados y región occipital gris. Iris gris con reticulaciones gris opaco. Lateralmente, el patrón de coloración dorsal se extiende hasta el primer tercio superior de los flancos, desde ese límite, en dirección ventral presenta una coloración crema rosáceo-amarillento. Ingles y superficies ocultas de los muslos crema rosáceo-amarillento. Ventralmente de color uniforme, crema rosáceo-amarillento, a excepción de la región gular y extremidades anteriores donde, el tono amarillento es un poco más fuerte ().
Coloración del Holotipo en vida
Dorsalmente, coloración de fondo rosa con reticulaciones y una fina línea vertebral negras, la barra interorbital de color blanco con márgenes irregulares café oscuro, el color crema se extiende como una línea sobre el párpado, en el margen que está en contacto con el ojo. Iris gris claro, rodeado en un anillo negro y densamente reticulado de negro, una banda transversal café rojizo. Lateralmente, mantiene el color rosa de fondo y las reticulaciones de color negro llegan hasta el primer tercio superior; ingles y superficies ocultas de los muslos rosa. Ventralmente, es de color blanco rosáceo y las areolas blanco puro, la garganta es de un tono rosa translúcido ().
Medidas del holotipo (mm)
DON = 2.8, LC = 8.2, AC = 9.6, DIO = 3.1, DIN = 1.9, LRC = 25.5, LT = 13.6, LP = 12.1, LM = 7.5, DT = 1.1, DO = 2.7, AP = 2.1.
Variación
Pristimantis morlaco sp. nov., presenta dimorfismo sexual. Los machos tienen un saco vocal subgular de color amarillo brillante, con la piel parcialmente translúcida, evidente, excrecencias nupciales pálidas de textura rugosa. Los machos son ligeramente más pequeños que las hembras (9%), las variaciones morfométricas entre ellos se presentan en la . Los patrones de coloración dorsal varían desde un fondo salmón, rojo apagado, rosa y naranja; las reticulaciones se presentan desde unas pocas manchas finas hasta reticulaciones gruesas; la barra interorbital blanca en la cabeza varía en grosor y a pesar de ser consistente en casi todas las observaciones, registramos un individuo sin ella. Ventralmente no hay variación a excepción de la característica translucidez gular en machos ().
Descripción del canto de anuncio
El canto de Pristimantis morlaco se compone de una combinación de tres (serie 1) y dos (serie 2) notas, con frecuencia modulada donde, el inicio de la nota tiene una mayor amplitud y progresivamente decrece (). El canto tiene una duración entre 3.57–5.21s (serie 1: 0.43–0.35s; serie 2: 0.17–0.18s), intervalos entre notas 0.02s, frecuencias dominantes 0.25–0.39 kHz (serie 1: 0.25–0.28 kHz; serie 2: 0.31–0.39 kHz), frecuencias máximas 3.03–3.19 kHz (serie 1: 3.03–3.19 kHz; serie 2: 3.05–3.14 kHz) y mínimas 2.77–2.87 kHz (serie 1: 2.77–2.87 kHz; serie 2: 2.77–2.87 kHz) y un promedio de 13.67 cantos por minuto ().
Tabla 4. Variables medidas en el análisis del canto de anuncio del holotipo (ZSFQ 4150) de Pristimantis morlaco sp. nov., individuo adulto (LRC = 25.5 mm), temperatura = 14.3°C, humedad relativa = 89.2%, velocidad del viento = 0.5 m/s.
Distribución e historia natural
Pristimantis morlaco sp. nov. ha sido registrada únicamente en la provincia del Azuay, en áreas de matorral interandino, dentro de los límites de los ríos que forman los drenajes de los ríos Paute (al norte) y Jubones (al sur), entre los 2219 y 2979 metros de altura (). Individuos de esta nueva especie han sido observados cerca de pequeños arroyos estacionales rodeados de arbustos y dentro de bromelias (). En áreas al interior de la ciudad de Cuenca, se ha observado en riachuelos con pequeños remanentes de vegetación cerca de vías fuertemente transitadas. En áreas aledañas a la ciudad de Cuenca, ha sido observada en vegetación arbustiva nativa comúnmente utilizada como cercas para delimitar arroyos, huertos o jardines de casas. El amplexus es axilar y fue observado en el interior de una grieta en el suelo, dentro de un área de extracción de áridos, en la localidad de El Cabo (Tabla Apéndice I), a una altura entre 60 y 80 cm del suelo, entre las 21:00 y 22:00 horas (). La actividad se incrementa en los periodos de lluvia, donde, varios machos se pueden escuchar vocalizando en distancias cortas entre sí (aprox. 12 m.).
Amenazas para su conservación
Pristimantis morlaco sp. nov. ha sido registrada en zonas donde la vegetación natural, así como la topografía del terreno, han sufrido significativas modificaciones primordialmente debido producto del cambio de uso del suelo y el reemplazo de las especies nativas por introducidas (p. ej. Pinus sp. y Eucalyptus sp.) [Citation39]. Muchas de las pequeñas quebradas estacionales o intermitentes donde registramos individuos de esta especie han sido modificadas o destruidas, principalmente en los alrededores de la ciudad de Cuenca. En base a observaciones en el campo es posible que la nueva especie use bromelias como refugio y sustrato para el depósito de sus huevos, sin embargo, estudios enfocados en la historia natural y distribución de esta especie son necesarios. Por el momento, no tenemos información para evaluar su estado de conservación y, por tanto, la asignamos con la categoría de Datos Deficientes (DD), según los criterios de la IUCN [Citation60]. No obstante, sugerimos que la gradual urbanización, remoción de vegetación y modificación del entorno, pueden significar amenazas directas para la estabilidad de estas poblaciones.
Discusión
Previamente, individuos que definimos en nuestro estudio como Pristimantis morlaco sp nov. fueron erróneamente asignados en Genbank como P. phoxocephalus (QCAZ29206 y MZUTI3936) [Citation61]. Evidentemente, la nueva especie es genéticamente distinta de P. phoxocephalus sensu stricto y no forma parte del recientemente definido subgénero Huicudomantis [Citation5]. Esta asignación, probablemente fue basada en similitudes morfológicas con P. phoxocephalus, que incluyen la presencia de una quilla en la punta del hocico, el cual le confiere un perfil subacuminado a la cabeza, presente en varias especies del grupo de especies Pristimantis phoxocephalus [Citation5] (e.j. P. jimenezi, P. lojanus, P. torresi y P. totoroi) que también fueron confundidas con P. phoxocephalus en el pasado [Citation5,Citation29]. Sin embargo, la nueva especie es claramente distinguible de P. phoxocephalus por su particular textura dermal (fuertemente rugosa, sin tubérculos destacados) y patrones de coloración (rosáceo con reticulaciones finas oscuras y una barra interorbital blanca).
La nueva especie junto con P. cajamarcensis, P. ceuthospilus y dos Pristimantis con incertidumbre taxonómica, forman un clado presente en el sur del Ecuador y norte del Perú. La cercanía genética entre P. cajamarcensis y P. ceuthospilus es concordante con las relaciones filogenéticas inferidas para el género en otros estudios [Citation62] y, junto con P. morlaco sp. nov. forman un clado hermano (bb = 65, pp = 0.68) a un clado que incluye a P. ardalonychus, P. bogotensis, P. elegans, P. frater, P. gryllus, P. incomptus, P. juanchoi, P. librarius, P. minutulus, P. miyatai, P. ockendeni, P. taeniatus y P. unistrigatus (). Las relaciones taxonómicas inferidas en miembros de estos dos clados han sido históricamente variables. Por ejemplo, basados en similitudes morfológicas, P. cajamarcensis, P. ceuthospilus, P. minutulus y P. unistrigatus fueron incluidas en el grupo de especies Pristimantis unistrigatus, mientras que, P. librarius, P. frater y P. miyatai fueron definidas como miembros del grupo de especies Pristimantis frater [Citation2]. Sin embargo, filogenéticamente los grupos de especies P. frater y P. unistrigatus no son monofiléticos y por tanto estas agrupaciones fueron desestimadas [Citation62]. Otro ejemplo de la complejidad taxonómica en miembros de este clado es Pristimantis ockendeni que fue separada en cuatro especies distintas por Elmer y Cannatella [Citation63], basados en evidencia genética y morfológica, aunque revisiones taxonómicas en otras poblaciones aún son necesarias [Citation64–66]. La alta semejanza fenotípica entre miembros de estos clados también ha sido notada en otros estudios en la región altoandina, los cuales han sugerido la presencia de especies cripticas que necesitan ser estudiadas [Citation5]. Estos ejemplos resaltan la importancia de combinar evidencia genética, comparaciones morfológicas y muestreos en distintas localidades geográficas para resolver las complejas relaciones evolutivas en estos clados.
Pristimantis morlaco sp. nov., es una de las pocas especies conocidas del género, que habita dentro y en los alrededores de una ciudad densamente poblada en la región altoandina. Otras especies del género que han sido registradas en áreas pobladas en la región altoandina incluyen a P. bogotensis (Bogotá, Colombia), P. lojanus (Loja, Ecuador) y P. unistrigatus (Quito, Ecuador) [Citation29,Citation67–70]. Junto con la nueva especie que describimos aquí, se conocen ocho especies de anfibios nativos formalmente descritos en el área urbana y periurbana de la ciudad de Cuenca incluyendo a Atelopus bomolochos, Hyloxalus vertebralis, Ctenophryne aequatorialis, Gastrotheca litonedis, y las recientemente descritas Gastrotheca cuencana, y Pristimantis lutzae [Citation5,Citation69,Citation70].
La presencia de una especie nueva de anuro en áreas urbanas, representa un reto para la conservación [Citation71]. En general en el caso de ranas Pristimantis, aún se desconocen aspectos básicos de su biología reproductiva. Al ser especies de desarrollo directo, las características de los sitios de depósito de sus huevos, aunque sumamente relevantes, aún son desconocidos en la mayoría de especies [Citation67]. Actualmente, tampoco conocemos acerca del estado poblacional de la nueva especie y su respuesta a procesos de urbanización y modificación del paisaje, sin embargo, la reciente evaluación del estado de conservación de los anfibios de Ecuador, identifica que más del 60% de las Pristimantis ecuatorianas están amenazadas por perdida de hábitat, recalcando la importancia de la descripción de nuevas especies y resolución taxonómica, como un paso necesario para realizar planes de investigación, monitoreo y acciones de conservación [Citation72].
Agradecimientos
Este trabajo fue financiado por la Unidad de Negocios Hidropaute de CELEC EP a través del Fondo del agua para la conservación de la cuenca del Río Paute-FONAPA. Los individuos fueron colectados bajo los permisos de investigación científica N: 058-DPA-MA-2014; 117–2016-DPAA/MA; MAE-DNB-CM-2018-0106. Eduardo Toral quiere agradecer a Tito Torres, Pablo Guzmán, David Vázquez y Pedro Alvarado por el respaldo a este estudio. Los autores agradecen a Lorena Orellana, Elvis Celi, Valentina Posse y Karla Neira por su apoyo en el campo y laboratorio. Juan C. Sánchez agradece a la valiosa información proporcionada por José M. Falcón, Jaime Fajardo Torres y Pedro Guerra. Agradecemos a Mario H. Yánez-Muñoz (INABIO), Santiago R. Ron (QCAZ), Fausto Siavichay (MCCAA), a Paul Székely (MUTPL) y al personal del MZUA, por permitirnos incluir su material en este trabajo. Los autores extienden un especial agradecimiento a Paul Székely por su apoyo con los análisis moleculares y a Jackson Phillips por fotografías de especímenes tipo usadas en las comparaciones morfológicas. Finalmente, un especial agradecimiento a Sebastián Duarte por su guía en los análisis acústicos.
Contribución de los autores
JCS colecto especímenes en el campo, tomo grabaciones, realizó las comparaciones morfológicas y escribió el texto. ETC, realizó las colectas, grabaciones y revisó y editó el texto. VLU colectó especímenes en el campo, realizó los análisis moleculares, escribió y editó el texto.
Disclosure statement
No potential conflict of interest was reported by the author(s).
Additional information
Funding
References
- Frost DR. 2021. Amphibian species of the world: an online reference. version 6.1. Electronic Database. https://amphibiansoftheworld.amnh.org/index.php, Electronic Database
- Hedges SB, Duellman WE, Heinicke MP. New world direct-developing frogs (Anura: terrarana): molecular phylogeny, classification, biogeography, and conservation. Zootaxa. 2008;1737(1):1–182.
- Duellman WE, Lehr E. Terrestrial-breeding frogs (strabomantidae) in Peru. Natur und Tier Verlag. Berlin. 2009.
- Yánez-Muñoz MH, Veintimilla-Yánez D, Batallas-Revelo D, et al. A new giant Pristimantis (Anura, Craugastoridae) from the paramos of the podocarpus national park, southern Ecuador. ZooKeys. 2019;852:137–156.
- Páez NB, Ron SR. Systematics of huicundomantis, a new subgenus of pristimantis (anura, strabomantidae) with extraordinary cryptic diversity and eleven new species. ZooKeys. 2019;868:1–112.
- Urgilés VL, Székely P, Székely D, et al. Genetic delimitation of pristimantis orestes (Lynch, 1979) and P. saturninoi Brito et al., 2017 and description of two new terrestrial frogs from the Pristimantis orestes species group (Anura, Strabomantidae). ZooKeys. 2019;864:111–146.
- Ospina-Sarria JJ, Duellman WE. Two new species of pristimantis (Amphibia: Anura: strabomantidae) from southwestern Colombia. Herpetologica. 2019;75(1):85–95.
- Amézquita A, Suárez G, Palacios-Rodríguez P, et al. A new species of pristimantis (Anura: craugastoridae) from the cloud forests of colombian western Andes. Zootaxa. 2019;4648(3):537–548.
- Reyes-Puig C, Reyes-Puig JP, Velarde-Garcéz DA, et al. A new species of terrestrial frog pristimantis (Strabomantidae) from the upper basin of the pastaza river, Ecuador. ZooKeys. 2019;832:113–133.
- Valencia JH, Valladares-Suntasig F, Tipantiza-Tuguminago L, et al. A new species of terrestrial-breeding frog of the genus pristzimantis (Anura: terrarana: craugastoridae) from the eastern Andean slopes of the southern Ecuador. Zootaxa. 2019;4658(3):509–525.
- Reyes-Puig C, Yánez-Muñoz MH, Ortega JA, et al. Relaciones filogenéticas del subgénero Hypodictyon (Anura: strabomantidae: pristimantis) con la descripción de tres especies nuevas de la región del Chocó. Rev Mex Biodivers. 2020;91(e913013):1–38.
- Ron SR, Carrión-Olmedo JC, Caminer MA, et al. Three new species of frogs of the genus pristimantis (Anura, Strabomantidae) with a redefinition of the P. lacrimosus species group. ZooKeys. 2020;993:121–155.
- Acevedo-Rincón AA, Armesto O, Palma RE. Two new species of pristimantis (Anura: craugastoridae) with notes on the distribution of the genus in northeastern Colombia. Zootaxa. 2020;4750(4):499–523.
- Acosta-Galvis AR, Saldarriaga-Gómez AM, Ramírez B, et al. A new Terrarana frog of genus Pristimantis from an unexplored cloud forest from the eastern Andes, Colombia. ZooKeys. 2020;961:129–156.
- Araujo de Oliveira E, da Silva La, Guimarães KLA, et al. Four new species of pristimantis jiménez de la espada, 1870 (Anura: craugastoridae) in the eastern Amazon. PLoS (Public Library of Science) One. 2020;15(3: e0229971):1–28.
- Székely P, Eguiguren JS, Ordóñez-Delgado L, et al. Fifty years after: a taxonomic revision of the amphibian species from the ecuadorian biodiversity hotspot abra de zamora, with description of two new PRISTIMANTIS species. PLoS (Public Library of Science) One. 2020;15(9: e0238306):1–59.
- Taucce PPG, Nascimento JS, Trevisan CC, et al. A new rupicolous species of the pristimantis conspicillatus group (Anura: brachycephaloidea: craugastoridae) from central Bahia, Brazil. J Herpetol. 2020;54(2):245–257.
- Moravec J, Lehr E, Kodejš K. A new species of Pristimantis (Amphibia, Anura, Strabomantidae) from the Pui Pui Protected Forest (central Peru), with comments on Pristimantis albertus. Duellman & Hedges, 2007.ZooKeys. 2020;994:125–148.
- Rivera-Correa M, Daza-R JM. Out of the blue: a new rain frog species of the genus pristimantis (Anura: craugastoridae) from the northern cordillera central in Colombia. Zootaxa. 2020;4838(1):83–101.
- Tito A, Catenazzi A. Pristimantis achupalla sp. n., a new minute species of direct-developing frog (amphibia, anura, strabomantidae) inhabiting bromeliads of the montane forest of the amazonian andes of puno. Peru. PeerJ. 2021;9(e11878):1–17.
- Cuellar-Valencia OM, Arriaga-Jaramillo FG, García-Gómez I, et al. Two new species of pristimantis (anura: strabomantidae) from the serranía de los paraguas: a priority site for conservation of amphibians in Colombia. Herpetologica. 2021;77(1):72–84.
- Sánchez-Nivicela JC, Urgilés VL, Cedeño-Palacios J, et al. Una fantástica nueva especie del grupo Pristimantis orcesi de los Andes sur de Ecuador. Neotropical Biodivers. 2021;6(1):224–237.
- Lehr E, Lyu S, Catenazzi A. A new, critically endangered species of pristimantis (amphibia: anura: strabomantidae) from a mining area in the cordillera occidental of northern peru (región cajamarca). Salamandra. 2021;57:15–26.
- Rivera-Correa M, González-Durán GA, Saldarriaga-Gómez AM, et al. Biodiversity in the andean mountains: two new rain frogs of the genus pristimantis (anura: craugastoridae) from the northern Cordillera Central in Colombia. Zootaxa. 2021;5040(3):334–364.
- Brito-Zapata D, Reyes-Puig C, Cisneros-Heredia DF, et al. Description of a new minute frog of the genus pristimantis (anura: strabomantidae) from cordillera del condor, Ecuador. Zootaxa. 2021;5072(4):351–372.
- Ortega-Andrade HM, Deichmann JL, Chaparro JC. Two new cryptic pristimantis (anura, craugastoridae) from the southern amazon basin of peru with taxonomic comments on pristimantis imitatrix.Duellman, 1978. South American Journal of Herpetology. 2021;21:2141–62.
- Venegas PJ, García Ayachi LA, Catenazzi A. Two new species of Pristimantis (Anura: strabomantidae) from Amazonas Department in northeastern Peru. Taxonomy. 2021;20–40. doi:10.3390/taxonomy2010002
- Brito-Zapata D, Reyes-Puig C. A new species of terrestrial-breeding frog pristimantis (anura: strabomantidae) from the cordillera del cóndor, Zamora Chinchipe, Ecuador. Neotropical Biodivers. 2021;7(1):213–222.
- Székely P, Székely D, Ordóñez-Delgado L, et al. Our unknown neighbor: a new species of rain frog of the genus Pristimantis (Amphibia: anura: strabomantidae) from the city of Loja, southern Ecuador. PLoS (Public Library of Science) One. 2021;16(10: e0258454):1–24.
- Zumel D, Buckley D, Ron SR. The pristimantis trachyblepharis species group, a clade of miniaturized frogs: description of four new species and insights into the evolution of body size in the genus. Zool J Linn Soc. 2021;1–40.
- Carrión-Olmedo JC, Ron SR. A new cryptic species of the pristimantis lacrimosus group (anura, strabomantidae) from the eastern slopes of the ecuadorian Andes. Evolutionary Systematics. 2021;5:151–175.
- Chávez G, García Ayachi LA, Catenazzi A. Beauty is in the eye of the beholder: cruciform eye reveals new species of direct-developing frog (strabomantidae, Pristimantis) in the Amazonian Andes. Evolutionary Systematics. 2021;5(1):81–92.
- Minga D, Guzmán N, Jiménez M, et al., Plantas nativas de los ecossistemas del Azuay, um acercamiento conceptual al Jardín Botánico de Cuenca-Ecuador. Universidad del Azuay. 2021;
- Galarza E, Gómez R. Cities in the andes: threats and hopes. Environment & Poverty Times. 2005;4.
- Bonilla-Bedoya S, Mora A, Vaca A, et al. Modelling the relationship between urban expansion processes and urban forest characteristics: an application to the metropolitan district of Quito. Comput Environ Urban Syst. 2020;79:101420.
- Stern MJ. An inter-andean forest relict: vegetation change on pasochoa volcano, Ecuador. Mt Res Dev. 1995;15(4):339–348.
- Ron SR, Duellman WE, Coloma LA, et al. Population decline of the jambato toad atelopus ignescens (anura: bufonidae) in the andes of Ecuador. J Herpetol. 2003;37(1):116–126.
- Cushman SA. Effects of habitat loss and fragmentation on amphibians: a review and prospectus. Biol Conserv. 2006;128(2):231–240.
- Hof C, Araújo MB, Jetz W, et al. Additive threats from pathogens, climate and land-use change for global amphibian diversity. Nature. 2011;480(7378):516–519.
- Angulo A, Rueda-Almonacid JV, Rodríguez-Mahecha JV, La Marca E. (Eds). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo No 2. Panamericana Formas e Impresos S.A.,Bogotá DC. 2006, p. 137–158.
- Heyer WR, Donnelly MAC. Medición y monitoreo de la diversidad biológica: métodos estandarizados para anfibios (No. Gn3150). Editorial Universitaria de la Patagonia. 1994; 364 pages.
- Peñafiel N, Flores DM, Rivero De Aguilar J, et al. A cost-effective protocol for total DNA isolation from animal tissue. Neotrop Biodivers. 2020;5:69–75.
- Darst CR, Cannatella DC. Novel relationships among hyloid frogs inferred from 12S and 16S mitochondrial DNA sequences. Mol Phylogenet Evol. 2004;31(2):462–475.
- Heinicke MP, Duellman WE, Hedges SB. Major caribbean and central American frog faunas originated by ancient oceanic dispersal. Proc Nat Acad Sci. 2007;104(24):10092–10097.
- Guayasamin JM, Hutter CR, Tapia EE, et al. Diversification of the rainfrog Pristimantis ornatissimus in the lowlands and Andean foothills of Ecuador. PLoS One. 2017;12(3: e0172615):1–21.
- Katoh K, Standley DM. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Mol Biol Evol. 2013;30(4):772–780.
- Lanfear R, Frandsen PB, Wright AM, et al. PartitionFinder 2: new methods for selecting partitioned models of evolution for molecular and morphological phylogenetic analyses. Mol Biol Evol. 2010;27(5):1173–1180.
- Nguyen LT, Schmidt HA, von Haeseler A, et al. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Mol Biol Evol. 2015;32(1):268–274.
- Ronquist F, Teslenko M, van der Mark P, et al. MrBayes 3.2: efficient bayesian phylogenetic inference and model choice across a large model space. Systematics Biology. 2012;61(3):539–542.
- Rambaut A, Suchard MA, Xie D, et al. Tracer v1.5, Available from: http://beast.bio.ed.ac.uk/Tracer. 2014.
- Heinicke MP, Lemmon AR, Lemmon EM, et al. Phylogenomic support for evolutionary relationships of new world direct-developing frogs (Anura: Terraranae). Mol Phylogenet Evol. 2018;118:145–155.
- Center for Conservation Bioacoustics. Raven Pro: interactive Sound Analysis Software (Version 1.5) [Computer software]. Ithaca, NY: The Cornell Lab of Ornithology. 2014. http://ravensoundsoftware.com/
- R development core team. R: a language and environment for statistical computing (version 3.5.3). Vienna Austria: R Foundation for Statistical Computing. Available from: http://www.R-project.org. 2019.
- Sueur J, Aubin T, Simonis C. Seewave: a free modular tool for sound analysis and synthesis. Bioacoustics. 2008;18(2):213–226.
- Ligges U, Krey S, Mersmann O, et al.: Analysis of music. R package versión 1.3.3. Available from: https://CRAN.R project.org/package=tuner. 2018.
- Köhler J, Jansen M, Rodríguez A, et al. The use of bioacoustics in anuran taxonomy: theory, terminology, methods and recommendations for best practice. Zootaxa. 2017;4251(1):1–124.
- Lynch JD. Leptodactylid frogs of the genus Eleutherodactylus from the Andes of Southern Ecuador. Vol. 66. The University of Kansas, Museum of Natural History, Miscellaneous Publications, USA; 1979. p. 1–62.
- Barbour T, Noble GK. Some amphibians from nothwestern Per. with a revision of the genera Phyllobates and Telmatobius. Bulletin of the Museum of Comparative Zoology at Harvard College. 1920;63:395–427
- Duellman WE, Wild ER. Anuran amphibians from the cordillera de huancabamba, Northern Peru: systematics, ecology, and biogeography. Museum of Natural History, the University of Kansas. 1993;
- IUCN. The Iucn red list of threatened species. Version. 2020-2; https://www.iucnredlist.org Descargado 09 de julio de 2020
- Herrera CC. Molecular phylogenetics of the pristimantis lacrimosus species group (anura: strabomantidae). Tesis de licenciatura en biología. universidad san francisco de quito, colegio de ciencias biológicas y Ambientales. Quito, Ecuador; 2019.
- Padial JM, Grant T, Frost DR. Molecular systematics of terraranas (Anura: brachycephaloidea) with an assessment of the effects of alignment and optimality criteria. Zootaxa. 2014;3825(1):1–132.
- Elmer KR, Cannatella DC. Three new species of leaflitter frogs from the upper amazon forests: cryptic diversity within pristimantis “ockendeni”(anura: Strabomantidae) in Ecuador. Zootaxa. 2008;178(1):11–38.
- Ocampo M, Aparicio J, Wallace R. Southernmost record for the leaflitter frog pristimantis ockendeni (boulenger, 1912) (anura: craugastoridae). Check List. 2017;13(1):1.
- Peters WCH. Über eine neue Schlangen-Gattung, Styporhynchus, und verschiedene andere Amphibien des zoologischen Museum. Monatsberichte der Königlichen Preussische Akademie des Wissenschaften zu Berlin. 1863: 399–413
- Günther ACLG. Second list of cold-blooded vertebrata collected by Mr. Fraser in the Andes of western Ecuador. Proceedings of the Zoological Society of London. 1859; 402–420.
- Ron SR, Merino-Viteri A, Ortiz DAADE. Version 2019.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. https://bioweb.bio/faunaweb/amphibiaweb, fecha de acceso 20 de marzo, 2022.
- Lynch JD, Renjifo JM. Guía de Anfibios y Reptiles de Bogotá y Sus Alrededores: departamento Técnico Administrativo de Medio Ambiente. Alcaldía Mayor de Bogotá D C. 2001: 56
- Siavichay-Pesántez F, Maldonado-Cedeño G, Mejía-Coronel D. Anfibios urbanos de Cuenca, Comisión de Gestión Ambiental. Cuenca, Ecuador. 2016.
- Carvajal-Endara S, Coloma LA, Morales-Mite MA, et al. Phylogenetic systematics, ecology, and conservation of marsupial frogs (anura: hemiphractidae) from the andes of southern ecuador, with descriptions of four new biphasic species. Zootaxa. 2019;4562(1):zootaxa–4562.
- Babini MS, Salas NE, de Lourdes Bionda C, et al. Implicaciones de la urbanización en la presencia, distribución y ecología reproductiva de la fauna de anuros de una ciudad del área central de Argentina. Rev Mex Biodivers. 2015;86(1):188–195.
- Ortega-Andrade HM, Rodes Blanco M, Cisneros-Heredia DF, et al. Red list assessment of amphibian species of ecuador: a multidimensional approach for their conservation. PloS one. 2021;16(5):e0251027.
Apéndices
Table 1. En esta tabla incluimos a los especímenes utilizados en la descripción morfológica. Para cada individuo: número de museo, nombre de la especie, localidad, coordenadas, elevación y sexo. Para las especies comparadas con base en sus descripciones, se presenta la fuente de referencia. Las abreviaturas de los museos son: MZUA (Museo de Zoología, Universidad del Azuay, Ecuador), ZSFQ (Museo de Zoología, Universidad San Francisco de Quito, Ecuador), MUTPL (Museo de Zoología, Universidad Técnica Particular de Loja, Ecuador), CCM-A (Colección Científica, Centro de Conservación de Anfibios-Amaru, Cuenca, Ecuador), QCAZ (Museo de Zoología, Universidad Católica del Ecuador, Quito, Ecuador), KU (Museo de Historia Natural de Kansas, Kansas, USA). Las abreviaturas de la localidad de recolección son: EC (Ecuador), PE (Perú). Los números asignados en el campo de Sexo/estado de desarrollo (en paréntesis) corresponden al número de observaciones realizadas en estas categorías.
Table 2. Cebadores usados para amplificación de 12s, 16s y RAG-1.
Table 3. Especies incluidas en los análisis filogenéticos. Los grupos externos se especifican con asterisco (*). Para cada individuo se detalla el número de acceso de GenBank.
