RESUME
Les sources sont nombreuses dans les Aurès. Elles constituent une opportunité aux populations des montagnes ou le raccordement au réseau AEP est souvent difficile. Elles sont utilisées pour l’AEP, mais en majorité pour l’irrigation des cultures. Dans ce papier nous tentons de classer une vingtaine de sources pérennes et de chercher l’origine de la minéralisation en rattachant chaque classe à un contexte lithologique. Ces sources appartiennent à plusieurs familles chimiques dont les faciès apparents ne reflètent pas forcément les compositions lithologiques des aquifères correspondants. Ainsi, une eau carbonatée traversant des formations évaporitiques peut acquérir un nouveau faciès, ce qui complique davantage les interprétations. La combinaison entre la simulation thermodynamique, la statistique et l’hydrochimie a donné des résultats satisfaisants sur l’identité chimique de ces eaux. Il s’agit, en effet, de deux familles : une des eaux carbonatées ; dominante avec 63% des prélèvements. L’autre gypsifère avec 37% des échantillons contrôlés. Le rapport rHCO3/rSO4 donne souvent des valeurs supérieures à 1 qui peuvent atteindre le seuil de 5. Les résultats indiquent que : Ca, SO4, HCO3 et Mg contrôlent la minéralisation des eaux. Les phénomènes qui ont générés ces deux familles sont multiples et concernent essentiellement la composition lithologique des aquifères ainsi que les mécanismes d’acquisition de la minéralisation durant le parcours souterrain avant d’atteindre la surface.
ABSTRACT
There are several springs in the “Aures”. They represent an opportunity for mountain populations where connection to the drinking water is difficult. They are used for human consumption, but mostly for agriculture. In this paper we try to classify about twenty perennial springs and identify the origin of the mineralisation by linking each class to a lithological context. These sources belong to several chemical groups whose apparent type do not necessarily reflect the lithological composition of the corresponding aquifers. Thus, a carbonated water passing through evaporitic formations can acquire a new facies, which further complicates the interpretations. The combination of thermodynamic simulation, statistics and hydrochemistry has given satisfactory results on the chemical identity of these waters. There are, in fact, two groups : one of the carbonated waters ; dominant with 63% of samples. The other gypsum with 37% of the samples checked. The rHCO3/rSO4 ratio often gives values superior than 1 which can reach the threshold of 5. The results indicate that : Ca, SO4, HCO3 and Mg control the mineralisation of the water. The phenomena that generated these two groups are multiple and mainly concern the lithological composition of aquifers as well as the mechanisms of mineralisation acquisition during the underground journey before reaching the surface.
1. Introduction
La dissolution des minéraux de la roche encaissante dans l’eau, est le facteur prédominant qui contrôle la composition chimique de ces eaux. L’étude hydrochimique des sources d’eau est relativement compliquée dans la mesure où leurs eaux traversent dans leurs parcours vers la surface des lithologies différentes.
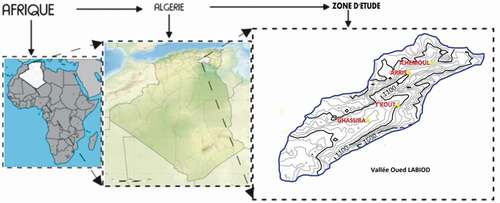
La région, objet de cette étude, est typiquement montagneuse avec ses reliefs et ses forets ; il s’agit de la partie nord de la vallée de l’oued Labiod qui appartient au massif des Aurès, composante principale de l’Atlas saharien de l’Algérie orientale. Elle englobe les régions d’Ichemoul, Arris, T’kout et Ghassira. Administrativement cette région se trouve dans la wilaya de Batna aux frontières immédiates de la wilaya de Biskra au sud .
Les eaux de la vallée aboutissent en fin de parcours dans le barrage de Foum El Gharsa. L’exutoire naturel est le chott Melghir au sud de Biskra. Morphologiquement le bassin se présente comme une vallée allongée entre les grands reliefs de Dj.Azreg (1937 m) et Dj.Zellatoo (1994 m) à l’ouest et Dj. Ahmar Khadou à l’est.
L’ensemble de la vallée qui s’étend jusqu’aux territoires de la wilaya de Biskra est soumis à un climat très contrasté entre la partie nord, de type méditerranéen où la pluviométrie atteint 450 mm/an avec plus de 20 jours de neige durant l’année, et le sud caractérisé par un climat variant du subsaharien à aride enregistrant une pluviométrie ne dépassant pas 200 mm/an.
Les sources sont très nombreuses sur les versants des montagnes et au milieu des collines de la zone d’étude. Elles constituaient, jadis, la seule ressource en eau. Plusieurs d’entre elles n’existent plus à cause des pompages intensifs à partir du nombre important des forages implantés dans la région ; d’autres dépendent de l’importance de la pluviométrie.
On s’intéresse dans ce papier à la classification hydrochimique et statistique d’une vingtaine de sources pérennes dans la région en tentant de suivre la dynamique des ions dissous dans l’eau et rattacher, éventuellement, chaque classe à une entité lithologique bien déterminée.
2. Contexte geologique et hydrogeologique
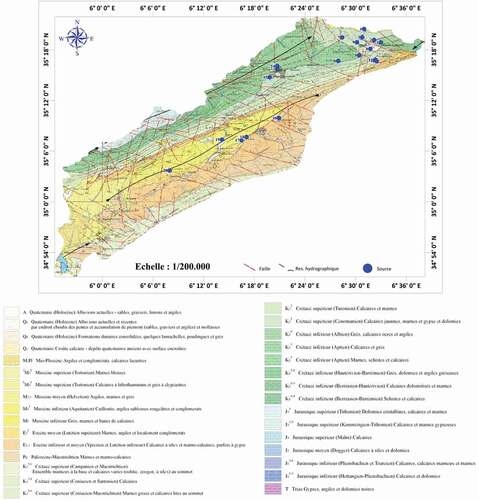
Le massif des Aurès constitue l’extrémité nord orientale de la chaîne Atlasique. La série stratigraphique identifiée au niveau de la vallée de l’oued Labiod est plus ou moins continue du Trias au quaternaire. La est le résultat de l’assemblage de 4 cartes géologique (Batna, Barika, M’Ziraa et Biskra) au 200 000 (Agence Nationale des Ressources Hydrauliques [ANRH], Citation2008), elle indique les affleurements qui concerne la zone d’étude. Les formations d’âge secondaire, notamment d’âge Crétacé sont essentiellement carbonatées formant des aquifères karstiques captifs à extension régionale souvent multicouche à cause des intercalations marneuses, produisant des eaux de bonne qualité. Les formations tertiaires contiennent des aquifères moins importants que ceux du secondaire, il s’agit de l’Eocène inférieur constitué de calcaires à silex, d’âge Yprésien–Lutétien inférieur comportant parfois des formations gypsifères (Hamel, Citation2009). Son épaisseur diminue du Nord vers le Sud où il se trouve enfouis sous les dépôts de l’Oligo–Miocène à une profondeur de 300 m. Le Miocène est formé de poudingues, sables et grés intercalés d’argiles. L’ensemble se termine par les conglomérats du Pliocène. Ce sont des dépôts de remplissage souvent en continuité avec les alluvions du Quaternaire. Ce dernier aquifère est en majorité libre.
Figure 2. Géologie de la zone d’étude (ANRH, Citation2008).
Du point de vu tectonique, la région a subi différentes phases orogéniques qui ont fait naître les structures synclinales et anticlinales, la phase Atlasique (Lutétien sup) et la phase post Miocène supérieur (Laffitte, Citation1939).
3. Matériels et méthodes
L’échantillonnage a intéressé une vingtaine de sources d’eau, dans le cadre d’une étude réalisée par la SONATRACH (société nationale de transport et de la commercialisation des hydrocarbures) pour le compte de la Direction d’Hydraulique de la wilaya de Batna. Les analyses ont été réalisées au laboratoire de l’Agence Nationale des Ressources Hydriques (ANRH) de Constantine.
Les sources ne sont pas toutes aménagées et donc les échantillons ont été pris après nettoyage de la zone de prélèvement. Des exigences strictes ont été respectées pendant toute l’opération de prélèvement. Concernant les paramètres sensibles tels que la température, la conductivité électrique (CE) et le pH, ils ont été mesurés sur le terrain à l’aide d’une sonde multi-paramètre de type HANNA (HI 9812-5). Les ions analysés au laboratoire sont le calcium, le magnésium, le sodium, le potassium, le chlorure, le bicarbonate, le sulphate, et les nitrates (). Les méthodes utilisées sont celles préconisées par (Rodier et al., Citation2009). La balance ionique entre cations et anions est inférieure à 8%.
Tableau 1. Caractéristiques statistiques des analyses physico-chimiques
Le dépouillement des résultats d’analyse a permis, tout d’abord, la détermination des faciès chimiques en utilisant le diagramme de piper (Ben Alaya et al., Citation2014 ; Daniele et al., Citation2008) et ainsi les ions dominants ont fait l’objet d’un traitement statistique par une corrélation simple () pour identifier le degré de dépendance entre eux, puis par une corrélation multiple en adoptant la classification ascendante hiérarchique (CAH) à l’aide du logiciel XLSTAT Citation2007.1 -(version Demo) ; l’objectif est de déterminer les principaux facteurs qui contrôlent le chimisme de ces eaux. Cette méthode statistique a été largement appliquée pour enquêter sur des phénomènes de l’environnement et les processus hydrogéochimiques à travers le monde (Ahoussi et al., Citation2010 ; Amadou et al., Citation2014 ; Belkhiri et al., Citation2010 ; Brinis et al., Citation2015 ; Montcoudiol et al., Citation2015 ; Ngouala Mabonzo, Citation2020 ; Templ et al., Citation2008)
Tableau 2. Matrice de corrélation des paramètres chimiques mesurés
Par ailleurs, l’équilibre eau-roche est atteint lorsque l’indice de saturation IS = 0. Si IS>0, l’eau est sursaturée, la précipitation des minéraux est nécessaire pour atteindre l’équilibre, par contre si IS<0, l’eau est sous-saturée, la dissolution des minéraux est nécessaire pour atteindre l’équilibre (Yidana et al., Citation2008). Il est important d’étudier cet indice pour vérifier l’état des minéraux dans l’eau. Pour cela, une simulation à l’aide du logiciel PHREEQC, (Demirel & Güler, Citation2006 ; Parkhurst & Appelo, Citation2013) a été réalisée.
Pour suivre la dynamique des différents paramètres de la minéralisation et leur évolution par rapport à la concentration globale dans l’eau, nous avons calculé le facteur de concentration dont l’estimation se fait en utilisant un traceur chimique. Il fait partie de la composition chimique des eaux étudiées et ne doit pas participer à des phénomènes de précipitation ou d’échange avec la roche réservoir. Ceci peut se traduire par la relation simple de proportionnalité entre la molalité de ce traceur à l’état initial et sa molalité à l’état final (Barbiero, Citation1992)
Les ions chlorures sont généralement utilisés comme traceur chimique pour déterminer l’état de concentration ou de dilution d’une eau. Cela signifie que pour classer une série de solutions en fonction de leur concentration, on utilise généralement le quotient entre la teneur en ions chlorures de la solution considérée avec la plus petite teneur en ions chlorures observée dans l’ensemble des solutions (Gallali, Citation1980).
Enfin, quelques couples chimiques ont été testés pour faire ressortir certains phénomènes relatifs à la dynamique simultanée de ces ions.
4. Résultats et discussion
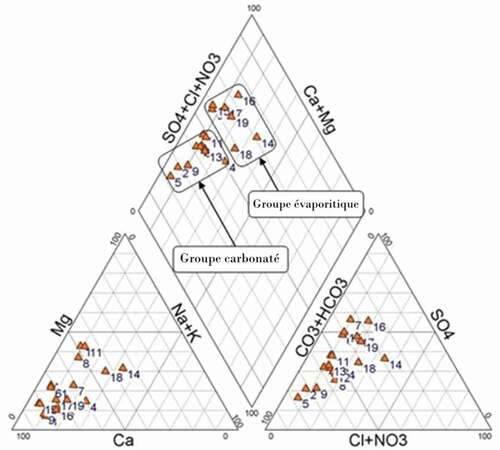
La projection de ces résultats sur le diagramme de Piper à l’aide du logiciel « Diagrammes » (Simler, Citation2012) laisse apparaitre deux familles :
Une famille des eaux carbonatées avec un faciès bicarbonaté calcique représentant 63% de l’ensemble des prélèvements. Le rapport rHCO3/rSO4 varie entre 1.2 et 4.7 et est dans 75% des cas supérieur à 1.5.
Une famille des eaux évaporitiques ; le faciès caractéristique est sulfaté calcique, ce qui représente 37% des échantillons analysés. Le rapport rHCO3/rSO4 varie dans la totalité des sources entre 0.5 et 0.9.
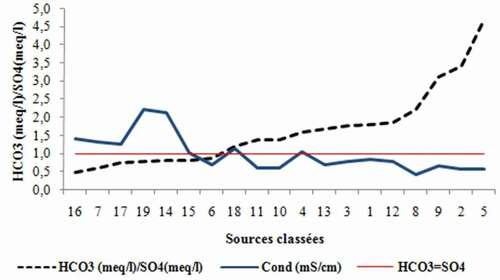
On remarque par ailleurs que les eaux évaporitiques sont caractérisées par des conductivités élevées contrairement aux eaux carbonatées ().
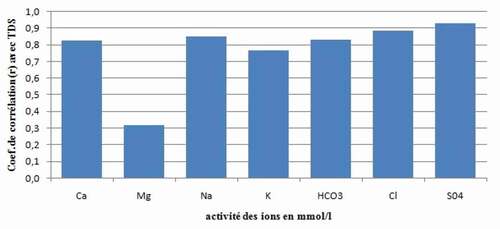
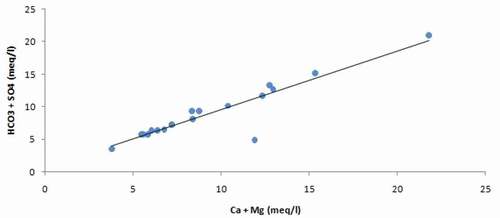
Enfin, le calcul du coefficient de corrélation entre l’activité des ions en mmol/l (simulation à l’aide Phreeq.C) avec le TDS confirme l’influence des ions Ca, Na, K, HCO3, Cl et SO4 sur le chimisme des eaux ().
4.1. Analyse statistique des paramètres mesurés
L’analyse statistique cherche à déceler la variabilité des teneurs dans l’espace (coefficient de variation « CV% ») ainsi que les liaisons (corrélation simple et multiple) pouvant exister entre les paramètres mesurés et donner par conséquent une approche sur la dynamique spatiale de ces paramètres.
4.1.1. Statistique descriptive
Le tableau1 ci-après présente un résumé de la statistique descriptive des paramètres mesurés. On admet qu’un CV inférieur à 50% témoigne d’une certaine homogénéité dans l’amplitude des teneurs observées entre valeurs minimales et maximales ce qui veut dire que les valeurs observées sont proches de la moyenne calculée. Par contre, les paramètres présentant un CV supérieusr à 50% indiquent une grande déviation par rapport à la moyenne de l’ensemble des observations.
On remarque que l’écart à la moyenne (CV%) est considérable pour la totalité des éléments (à l’exception du pH). Le pourcentage de l’écart avoisine 100 % de la valeur de la moyenne et même le dépasse parfois. Ce coefficient donne déjà une idée sur la variabilité de la répartition spatiale des paramètres étudiés ; ceci peut être expliqué surtout par l’appartenance des eaux à des aquifères différents dont le lessivage des roches traversées ne se fait pas de la même manière. Par exemple, les eaux qui traversent les terrains évaporitiques se chargent plus rapidement en sels dissous que les eaux qui traversent des terrains carbonatés.
4.1.2. Corrélation simple (élément à élément)
Un essai de corrélation () des différents paramètres étudiés a mis en évidence une relation étroite entre Ca, Mg, Na, SO4, Cl et la conductivité électrique (CE). Cette relation se traduit par des coefficients de corrélation se rapprochant de « 1 ». Les liens significatifs peuvent être probablement attribués à des origines communes de certains de ces éléments.
4.1.3. Corrélation multiple
Puis ces résultats ont fait l’objet d’un traitement statistique par la méthode de la Classification Ascendante Hiérarchique (CAH) à l’aide du logiciel XLSTAT Citation2007.1 cha (version Demo).
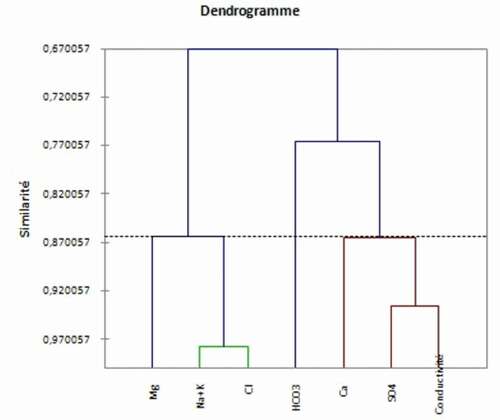
4.1.4. Classification des variables
Le graphique de la classification des variables montre le regroupement des variables dans deux ensembles principaux ; le premier englobant les sulphates, le calcium, les bicarbonates et la conductivité électrique. Ce groupe contrôle la minéralisation des eaux des sources étudiées et représente l’influence principale sur la conductivité. En effet, les faciès bicarbonaté et gypsifère sont dominants. Le deuxième groupe englobe les variables ; chlorure, sodium, magnésium et potassium. Ces ions sont moins importants en teneurs que ceux du premier groupe.
4.2. Dynamique des ions avec le facteur de concentration (FC)
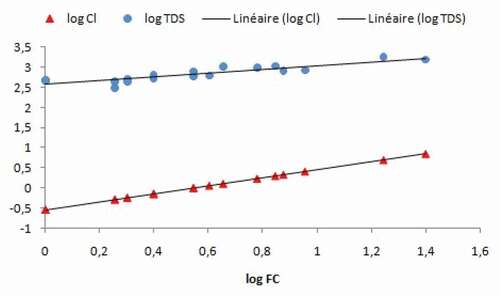
On sait que l’importance du paramètre TDS reflète celle de la concentration des ions dans l’eau.
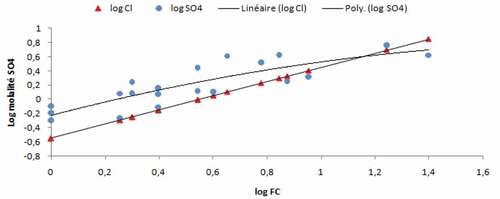
Le diagramme montre que la droite de l’évolution du log (TDS) est presque parallèle à celle du log (facteur de concentration) (r « TDS/FC » = 0,8275) et se fait selon la même pente, ceci confirme la possibilité d’utilisation des chlorures comme traceur pour le suivi de la concentration globale.
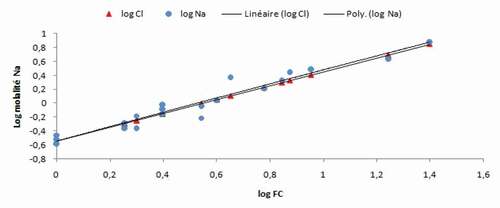
4.2.1. Dynamique du sodium
L’observation du graphique de la montre que la dynamique du sodium suit parfaitement celle de la concentration globale, ceci peut être expliqué par l’origine commune de cet ion et les chlorures (la halite).
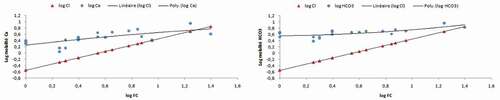
4.2.2. Dynamique des bicarbonates et du calcium
Les diagrammes de concentration indiquent que les eaux se trouvent déjà riches et saturées en calcium et bicarbonate au début de la concentration (Fc = 1), toutefois, on remarque que la pente de la droite caractérisant la dynamique du Ca est plus importante que celle des bicarbonates ce qui laisse supposer qu’en plus de la calcite, le Ca est généré par une autre source, il s’agit ici probablement, du gypse (sulphates de calcium).
Vers la fin, soit à partir du log FC entre 1 – 1.4, (lorsque les eaux deviennent plus concentrées), la courbe de tendance du calcium semble s’incurver légèrement indiquant ainsi sa participation à des précipitations ou annonçant l’existence d’autres phénomènes provoquant sa diminution dans les eaux. Alors que celle des bicarbonates est relativement stable.
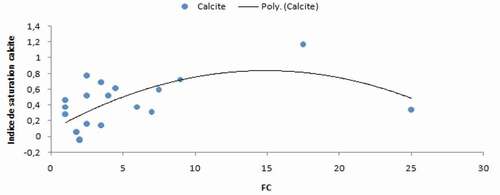
Pour mieux comprendre ce qui se passe réellement et faire ressortir tous les phénomènes possibles, nous avons utilisé l’indice de saturation (SI) de la calcite (CaCO3) que nous avons combiné dans le même graphique avec le facteur de concentration (). Le résultat montre :
Au début de la concentration les eaux sont équilibrées à légèrement sous-saturées par rapport à la calcite (SI entre −0.05 à+0.06),
Puis elles tendent vers la saturation avec l’augmentation de la minéralisation jusqu’à un seuil de SI = 1.17.
Enfin, elles ont tendance à revenir vers l’état d’équilibre avec la calcite (SI = 0.34).
4.2.3. Dynamique des sulphates
L’évolution des sulphates est illustrée dans le diagramme de la qui trace une évolution simultanée avec log (FC). Le nuage de points présente à la fin de la concentration pour une valeur du log (FC) entre 1.2 à 1.4 une diminution semblable dans une certaine limite à celle remarquée dans le diagramme du calcium.
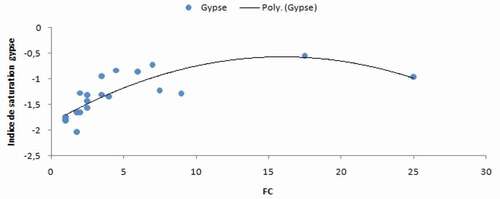
De même que pour la calcite, le diagramme qui trace la combinaison de l’indice de saturation du gypse avec le facteur de concentration montre que le nuage de points s’oriente au départ vers un équilibre puis revient à un état de sous-saturation.
4.2.4. Dynamique du magnésium
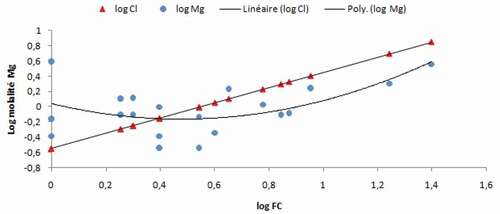
Concernant le magnésium, , on remarque que son diagramme de concentration suit grossièrement le facteur de concentration, cependant, on note une diminution puis une légère augmentation de sa concentration.
L’importance du calcium masque l’apparition du faciès magnésien. Schoeller, Citation1962 ; explique ce phénomène dans ses études « Dans les dolomies les phénomènes sont du même genre que dans les calcaires. Mais, d’une manière générale, il semble que le rapport rMg/rCa soit plus petit dans l’eau que dans les roches, en particulier dans les calcaires dolomitiques. La calcite est, en effet, plus soluble que la dolomite. »
Rappelant, par ailleurs, que cet ion (Mg) provient à la fois des roches carbonatées et évaporitiques et participe souvent à des échanges de base.
4.3. Discussion
La dynamique du calcium, des sulphates, de la calcite et du gypse indique une concentration des eaux en sels puis une dilution. Nous pensons que les eaux se chargent en profondeur par les minéraux de la dissolution des roches carbonatées. Arrivant en surface, deux tendances peuvent se remarquer :
Première tendance : Les eaux sortent directement dans les calcaires et le caractère carbonaté est conservé (63 % des eaux prélevés sont de faciès carbonaté). Effectivement, les points concernés par ce faciès émergent dans des affleurements carbonatés notamment ceux d’Ichemoul et Arris ().
Deuxième tendance : Ces eaux se diluent en entrant en contact avec les eaux des roches gypsifères, et participent par l’occasion à la dilution de ces dernières. Il s’agit des points qui émergent dans les affleurements tertiares ou les formations quaternaires notamment ceux des régions de T’kout et Ghassira ().
Pourquoi nous pensons que les eaux du faciès gypsifère se mélangent (diluent) avec les eaux carbonatées avant leur émergence ? La réponse réside dans le rapport « rHCO3/rSO4 » qui varie entre 0.5 et 4.7 ; ce qui veut dire que dans certains cas, les bicarbonates dépassent de 5 fois la teneur des sulphates, alors que dans les eaux gypsifères étudiées, la teneur en sulphates ne dépassent pas, dans les meilleurs des cas, le double des bicarbonates. D’autant plus que les teneurs en sulphates ne sont pas vraiment importantes (SO4 moy = 204 mg/l) malgré la présence des roches gypsifères qui normalement, une fois traversées par les eaux atteignent très rapidement de hautes teneurs en CaSO4 allant très souvent jusqu’à saturation dépassant dans tous les cas les teneurs en CaCO3. (Schoeller, Citation1962)
Nous remarquons que le phénomène de dilution qui contrôle la concentration du calcium, des bicarbonates et des sulphates ne semble pas affecter le magnésium. La position de cet ion le chimisme des eaux étudiées est un peu ambiguë : Il présente un coefficient de corrélation avec les chlorures de l’ordre de 0.8. Il se place, aussi, dans le même groupe avec ces derniers ainsi que le sodium et le potassium dans la classification ascendante hiérarchique (CAH) ce qui laisse supposer la possibilité de son évolution avec les chlorures, or un essai de combinaison dans le même graphique de ces deux ions (chlorures et magnésium) ne semble pas indiquer une dépendance ; par contre, la représentation de la relation r(SO4+HCO3) – r(Ca+Mg), donne un alignement parfait du nuage des points.
Les eaux dans leur ascendance à partir des profondeurs contiennent mais à des faibles teneurs du magnésium, une fois proche de la surface, elles se chargent davantage, en contact avec les terrains gypsifères en magnésium ainsi que d’autres éléments.
En effet, « Il est à remarquer que l’augmentation du SO4 entraîne non seulement une augmentation du calcium, mais aussi du magnésium, le gypse renfermant toujours une proportion plus ou moins grande de Mg. D’ailleurs, une fois la saturation de CaS04 atteinte, Ca ne peut plus augmenter. Seul MgSO4 peut encore se dissoudre » (Schoeller, Citation1962).
Le magnésium aurait donc un rôle dans le chimisme des eaux des sources étudiées en dépit de son absence parmi les faciès dominants.
5. Conclusion
La vallée de l’oued Labiod fait partie du massif des Aurès dans l’atlas saharien au nord-est algérien ou le paysage est façonné dans des calcaires qui appartiennent à plusieurs niveaux géologiques, notamment d’âge secondaire (maestrichtien, turonien, albien, aptien …) dont les compositions minérales ainsi que le mode de fissuration ne sont pas totalement identiques. S’ajoutant à cela les passages marneux, parfois argileux qui caractérisent ces niveaux et la présence de formations évaporitiques notamment dans les niveaux d’âge tertiaire (oligocène, lutétien) ; tous ces facteurs font que les sources d’eau de ce massif présentent plusieurs groupes chimiques en relation avec cette lithologie, pouvant être regroupées dans deux familles principales : carbonatée (63%) et gypsifère (37%).
Le traitement statistique confirme la présence de ces groupes et met en évidence un coefficient de variation (CV) très important témoignant d’une variabilité de la distribution des teneurs de ces ions dans les eaux. Toutefois, la corrélation entre ces éléments indique une dépendance entre Ca, Mg, Na, SO4, Cl et la conductivité électrique (CE).
La manière selon laquelle se fait la dynamique des éléments chimiques indique une concentration des eaux en sels puis une dilution. En effet, les eaux se chargent en profondeur par les minéraux de la dissolution des roches carbonatées, arrivant en surface, les eaux peuvent sortir directement dans les calcaires et le caractère carbonaté est conservé (63 % des eaux prélevés sont de faciès carbonaté), ou se diluent en entrant en contact avec les eaux des roches gypsifères, pauvres en bicarbonates, et participent par l’occasion à la dilution des eaux contenues dans ces roches.
Le magnésium qui n’apparaît pas comme faciès dominant, masqué par l’importance du calcium, joue un rôle dans le chimisme des eaux des sources étudiées. Les eaux dans leur ascendance à partir des profondeurs sont pauvres en cet ion. Une fois proche de la surface, elles se chargent en contact avec les terrains gypsifères d’avantage en magnésium ainsi que d’autres ions.
Remerciements
Au prof. A. Pulido-Bosch pour la lecture critique du papier et ses suggestions qui ont contribué à son amélioration.
Disclosure statement
No potential conflict of interest was reported by the author(s).
Références
- Agence Nationale des Ressources Hydrauliques. (2008). Carte géologique interprétative. Assemblage des cartes géologiques.
- Ahoussi, E., Soro, N., Kouassi, A., Soro, G., Koffi, Y., & Zade, S. (2010). Application des méthodes d’analyses statistiques multivariées à l’étude de l’origine des métaux lourds (Cu2+, Mn2+, Zn2+ et Pb2+) dans les eaux des nappes phréatiques de la ville d’Abidjan. International Journal of Biological and Chemical Sciences, 4(5), 1753–1765. https://doi.org/https://doi.org/10.4314/ijbcs.v4i5.65537
- Amadou, H., Laouali, M., & Manzola, A. (2014). Application des méthodes d’analyses statistiques multivariées à l’étude de la minéralisation des eaux de la zone de Zinder (Sud-Est du Niger). International Journal of Biological and Chemical Sciences, 8(4), 1904. https://doi.org/https://doi.org/10.4314/ijbcs.v8i4.50
- Barbiéro Laurent, Valles V. (1992). Aspects géochimiques de l'alcalinisation des sols dans la vallée du Dallol Bosso (République du Niger). Cahiers ORSTOM. Série Pédologie, 27(2), 143–152.
- Belkhiri, L., Boudoukha, A., Mouni, L., & Baouz, T. (2010). Application of multivariate statistical methods and inverse geochemical modeling for characterization of groundwater – A case study: Ain Azel plain (Algeria). Geoderma, 159(3–4), 390–398. https://doi.org/https://doi.org/10.1016/j.geoderma.2010.08.016
- Ben Alaya, M., Zemni, T., Mamou, A., & Zargouni, F. (2014). Acquisition de salinité et qualité des eaux d’une nappe profonde en Tunisie : Approche statistique et géochimique. Hydrological Sciences Journal, 59(2), 395–419. https://doi.org/https://doi.org/10.1080/02626667.2013.870663
- Brinis N., Boudoukha A., & Hamel A. (2015). Analyse statistique et géochimique de la Dynamique des paramètres physico-chimiques des Eaux souterraines du synclinal de ghassira Algérie orientale. Publication au Larhyss Journal, 22(juin), 123–137. http://larhyss.net/ojs/index.php/larhyss/article/view/282
- Daniele, L., Bosch, A. P., Vallejos, A., & Molina, L. (2008, June 1). Geostatistical analysis to identify hydrogeochemical processes in complex aquifers: A case study (Aguadulce Unit, Almeria, SE Spain). AMBIO : A Journal of the Human Environment, 37(4), 249–253. https://doi.org/https://doi.org/10.1579/0044-7447(2008)37[249:GATIHP]2.0.CO;2
- Demirel, Z., & Güler, C. (2006). Hydrogeochemical evolution of groundwater in a Mediterranean coastal aquifer, Mersin-Erdemli basin (Turkey). Environmental Geology, 49(3), 477–487. https://doi.org/https://doi.org/10.1007/s00254-005-0114-z
- Droubi A., Cheverry C., Fritz B., & Tardy Y. (1976). Géochimie des eaux et des sels dans les sols des polders du lac Tchad : Application d’un modèle thermodynamique de simulation de l’évaporation. Chemical Geology, 17, 165–177. https://doi.org/https://doi.org/10.1016/0009-2541(76)90033-4. (https://www.sciencedirect.com/science/article/pii/0009254176900334)
- Gallali, G. (1980) Transferts sels-matière organique en zones arides méditerranéennes [Th. Doc. Sc]. Université de Nancy, Vol. 1, pp. 202.
- Hamel, A. (2009). Hydrogéologie des systèmes aquifères en pays montagneux a climat semi-aride. cas de la vallée d’oued el abiod (Aurès). Mémoire de magister de l’université Mentouri Constantine.
- Laffitte, R. (1939). Etude géologique de l’Aurès et esquisse géologique des Aures, Thèse, Paris, Bull. Service de la carte géologique de L’Algérie, Alger, 2eme éd., pp. 484.
- Montcoudiol. N., Molson, J., Lemieux, J.-M., &. Cloutier, V. (2015). A conceptual model for groundwater flow and geochemical evolution in the southern Outaouais Region, Québec, Canada. Applied Geochemistry, 58, 62–77. https://doi.org/https://doi.org/10.1016/j.apgeochem.2015.03.007
- Ngouala Mabonzo, M. (2020). Caractérisation hydrochimique des eaux souterraines de la zone de contact du bassin sédimentaire côtier et du socle du Précambrien inférieur au sud-ouest de la République du Congo. Cinq Continents, 10(21), 60–85. http://cinqcontinents.geo.unibuc.ro/10/10_21_Complete.pdf
- Parkhurst, D., & Appelo, T. (2013). Description of input and examples for PHREEQC version 3 – a computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations. US Geological Survey Techniques and Methods, book 6, chap A43, p 497. http://pubs.usgs.gov/tm/06/a43
- Rodier, J., Legube, B., & Merlet, N. (2009). L’analyse de l’eau ( 9éme éd.). Dunod (éditeur).
- Schoeller, H. (1962). Les Eaux Souterraines. Hydrologie dynamique et chimique, Recherche, Exploitation et Évaluation des Ressources. 187 fig. Paris : Masson et Cie, Éditeurs 1962. p. 306-316-362.
- Simler, R. (2012). Software ‘Diagrammes’. Laboratoire d’Hydrologie d’Avignon, Université d’Avignon et pays du Vaucluse, France. http://www.lha.univ-avignon.fr
- Templ, M., Filzmoser, P., & Reimann, C. (2008). Cluster analysis applied to regional geochemical data: Problems and possibilities. Applied Geochemistry, 23(8), 2198–2213. https://doi.org/https://doi.org/10.1016/j.apgeochem.2008.03.004
- Xlstat. (2007). Addinsoft ( Version demo). www.xlstat.com
- Yidana, S. M., Ophori, D., & Banoeng-Yakubo, B. (2008). Hydrogeological and hydrochemical characterization of the Voltaian Basin: The Afram Plains area, Ghana. Environmental Geology, 53(6), 1213–1223. https://doi.org/https://doi.org/10.1007/s00254-007-0710-1