Abstract
Polychlorinated biphenyls (PCBs) are highly toxic. Strategies to prohibit the sale, improve control, handling and disposal have been developed. The aim of this study was to quantify the presence of 10 dioxin-like PCBs, in three species of fish (channel catfish, tilapia and largemouth bass) caught commercially in Tamaulipas, México. PCBs were extracted from the fat using a column chromatographic separation technique and analyzed by gas chromatography with electron capture detector. The PCB 156 occurred more frequently in the three species. The PCB 167 showed the highest bioaccumulation (4.82 ng/g of muscle). The PCB 126, considered the most toxic, occurred in low concentrations in specimens of the three species. The results indicate that the dam had low incidence of dioxin-like PCBs. Catfish was the species that accumulated more PCBs. It is necessary to inform to the public of its maximum consumption.
Los bifenilos policlorados (BPCs) son sustancias altamente tóxicas. Se han desarrollado estrategias para prohibir su venta, mejorar su control, manejo y disposición. El objetivo del presente estudio fue cuantificar la presencia de 10 BPCs tipo dioxina en tres especies de pescado (bagre, tilapia y lobina) capturadas comercialmente en Tamaulipas, México. Los BPCs se extrajeron de la grasa por separación cromatográfica en columnas y se analizaron por cromatografía de gases con detector de captura de electrones. El BPC 156 se presentó con mayor frecuencia en las tres especies. El BPC 167 mostró la mayor bioacumulación (4,82 ng/g de músculo). El BPC 126, considerado el más tóxico, se presentó en baja concentración en especímenes de las tres especies. Los resultados señalan que la presa presentó baja incidencia de BPCs tipo dioxina. Los bagres fueron los peces que más bioacumularon BPC. Sería necesario informar de su consumo máximo a la población.
Introducción
En mayo de 2001, 151 países, incluyendo a México, firmaron el Convenio de Estocolmo, que establece directivas para el manejo y control de los Contaminantes Orgánicos Persistentes y que incluye una docena de compuestos químicos conocida como “docena sucia”, abarcando bifenilos policlorados, plaguicidas organoclorados, dioxinas y furanos (Bordajandi et al., Citation2003). Los bifenilos policlorados (BPCs) se incluyen en la lista de contaminantes orgánicos persistentes. Los BPCs se empezaron a comercializar en 1929 y se empezaron a prohibir en los países industrializados en la década de 1970 (Erickson, Citation1997). Debido a su baja conductividad eléctrica y alta resistencia al calor y degradación térmica, los BPCs se usaron como fluidos dieléctricos en capacitores y transformadores eléctricos (Sather, Newman, & Ikonomou, Citation2003). Estos compuestos son persistentes en el ambiente, resisten los procesos de degradación fotolítica, química y biológica, son semivolátiles, presentan baja solubilidad en agua pero se disuelven fácilmente en grasas y aceites (Vaclavik et al., Citation2006). La volatilidad de los BPCs permite que sean desplazados en el aire a grandes distancias de donde fueron vertidos, por lo que su presencia se ha detectado incluso, en el tejido graso de organismos que habitan en regiones alejadas de donde son usados o emitidos (Ritter, Solomon, Forget, Stemeroff, & O'Leary, 1995). En un ecosistema las concentraciones de BPCs se ven incrementadas a medida que pasan hacia los niveles superiores de la cadena alimentaria debido a procesos de bioconcentración y biomagnificación (Covaci, Ryan, & Schepens, Citation2002; Kart, Rufo, & Kart-Heinz, 2004; Kumar et al., Citation2001). Los seres humanos quedan expuestos a los BPCs a través de la cadena trófica, particularmente con el consumo de pescado, carne de vaca y la variedad de productos lácteos que contienen un nivel relativamente alto de grasa (Watson, Citation2004). En humanos la toxicidad de los BPCs afecta principalmente la piel, el hígado, el sistema nervioso, el sistema inmunológico y el sistema endocrino, además se pueden presentar efectos en el desarrollo embrionario y son carcinogénicos (Storelli, Barone, & Marcotrigiano, Citation2007). Existen estudios de estos compuestos que evidencian que pueden ser transmitidos a niños en el periodo de lactancia (Fuerhacker et al., Citation2006).
En México la Secretaría de Medio Ambiente y Recursos Naturales desarrolló en 2007 el Plan Nacional de Implementación del Convenio de Estocolmo sobre COP de México, estableciendo la necesidad de realizar inventarios de BPCs y de capacidades analíticas para la determinación de BPCs en diferentes matrices ambientales que permitan definir los riesgos toxicológicos en distintos ecosistemas. Sin embargo, a la fecha existe escasa información científica sobre la presencia de estoscompuestos en ecosistemas, alimentos o seres humanos (Miller-Pérez, Sanchez-Islas, Mucio-Ramirez, Mendoza-Sotelo, & Leon-Olea, 2009). Se ha reportado la presencia de BPCs en especies acuáticas que habitan en la Laguna de Términos Campeche en concentraciones por debajo de los niveles tóxicos (Carvalho, Villeneuve, Cattini, Rendon, & de Oliveira, Citation2009). La concentración de BPCs fue menor en peces que habitan la laguna de Celestún y la reserva ecológica de Dzilam, en la península Yucatán, comparada con la concentración encontrada en peces que habitan en laLaguna de Términos (Zapata-Pérez et al., Citation2007). La presencia dedioxinas fue reportada en peces capturados en la Laguna de Pátzcuaro y los puertos marinos de Ciudad del Carmen, El Barril y Ensenada. El nivel de contaminación para los peces fue menor en concentración en el orden señalado de los ecosistemas. En todos los casos los valores estuvieron por debajo de los niveles de riesgo establecidos para el consumo diario tolerable (Canedo-Lopez & Macias-Zamora, 2007).
Existen 209 congéneres de BPCs, pero en particular 12 BPCs coplanares poseen una estructura similar a la 2,3,7,8-tetraclorodibenzo-p-dioxina (2,3,7,8-TCDD). Por esto son denominados “BPCs tipo dioxinas” y representan una clase particularmente peligrosa de sustancias para las cuales se han determinado Factores de Equivalencia Tóxica (TEF), análogos a los valores de toxicidad correspondientes de las dioxinas y furanos (Lewis & Van Pelt, 2002). El objetivo de este trabajo fue establecer la presencia de 10 BPCs denominados “tipo dioxina” por su alta toxicidad (77, 81, 105, 114, 118, 126, 156, 157, 167 y 189) en especies que se capturan en forma comercial o deportiva en la presa República Española, Tamaulipas, México.
Materiales y métodos
Obtención de la materia prima
Se trabajó con tres especies de pescado: Ictalurus punctatus (bagre), Micropterus salmoides (lobina) y Oreochromis niloticus (tilapia). Los especímenes se adquirieron recién capturados durante el período de invierno de 2004 en una cooperativa pesquera local dela presa República Española. Los ejemplares analizados en este estudio fueron los peces más grandes del total de peces obtenidos en la pesca del día. Los pescados fueron almacenados en hielo para su transporte al laboratorio (cuatro horas). Los peces fueron pesados, eviscerados y fileteados en el laboratorio. Losfiletes se molieron y se empacaron en bolsas de polietileno debidamente etiquetadas antes de ser almacenadas en congelación a −20°C hasta su análisis.
La presa República Española se localiza en el municipio de Aldama, Tamaulipas entre los 23°17′40″ latitud norte y 97°59′00″ de longitud oeste (). La presa fue construida en el periodo entre 1979 y 1983 para contener las avenidas del río Pedregoso y destinada al riego de tierras de cultivo. Tiene una extensión de 963 hectáreas y un volumen de almacenamiento de 54,77 millones de metros cúbicos.
Análisis biométricos y de composición química del pescado
El peso de los animales se obtuvo empleando balanza granataria digital con capacidad de 2 decimales. El tamaño se obtuvo usando una cinta métrica comercial. El porcentaje de humedad se determinó por secado en estufa a 110°C hasta peso constante. Para obtener el contenido de grasa en el músculo se empleó un equipo soxhlet automatizado (Soxtec, HT2, Tecator, USA), utilizando el método 3541 aprobado por la EPA para muestras contaminadas por BPCs. Se usaron 5 g de músculo de pescado, homogenizándolos con 20 g desulfato de sodio para atrapar la humedad y se sometieron por dos horas a extracción continua con una solución de acetona-hexano (1:1 v/v) concentrándose hasta un mililitro.
Cuantificación de los Bifenilos policlorados
De los 209 BPCs existentes se eligió estudiar diez de los más tóxicos con un efecto tipo dioxina: los no-ortho-clorados 77, 81 y 126 y los mono-ortho-clorados 105, 118, 157, 167, 114, 156 y 189. Los BPCs de referencia fueron adquiridos de la empresa Chem Service (PA, USA). Se obtuvo una solución de trabajo para cada estándar, conteniendo 400 mg/L del compuesto y disolviendo 40 mg en 100 ml de isooctano.
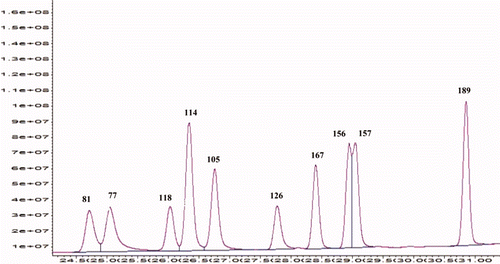
Se realizaron curvas de calibración en el detector de captura de electrones con concentraciones de 0, 20, 50, 100, 200, 300 y 400 μg/L, estableciéndose los tiempos de retención (). Usando el sistema de validación estadístico y quimiométrico se determinaron los límites de cuantificación de cada BPC (). Los límites de detección se establecieron como la masa de analito que diera una señal 3σ arriba de la señal del blanco (siendo σ la desviación estándar de la señal del blanco). Los límites de cuantificación se establecieron como la masa de analito que diera una señal 10σ arriba de la señal del blanco (Sánchez-Ávila, Mata-Granados, Ruiz-Jiménez, & Luque de Castro Citation1999).
El porcentaje de recuperación se estableció inyectando mezclas de BPCs en concentraciones individuales de 20, 50, 100, 200, 300 y 400 μg/kg en músculo de pescado y se determinó la concentración de los analitos. Se analizó músculo de pescado control no inyectado con BPCs, restando a las muestras inyectadas la concentración encontrada en los controles. Los resultados se muestran en la .
Para asegurar la limpieza del material de vidrio se siguió el procedimiento descrito en el método 1668 A de la EPA. Todos los solventes utilizados fueron grado HPLC o plaguicida: metanol, acetona, cloruro de metileno, éter etílico, tolueno, isooctano, éter de petróleo (TEDIA, USA).
Extracción de los Bifenilos policlorados de las muestras
El proceso de extracción de los BPCs del músculo de pescado se realizó empleando una columna de sílice multicapas de acuerdo al método EPS 1/RM/31 reportado por el Centro de Tecnología Ambiental de Canadá (Environment Canada, 1977). Se introdujo 1 ml de grasa-solvente extraída del pescado por una columna de sílice multicapas compuesta por capas progresivas de alúmina, sílice neutra, Sílice/AgNO3,Sílice/NaOH, Sílice/H2SO4 y sulfato de sodio. La muestra se eluyó con 180 ml de hexano, los cuales se recuperaron en matraz Erlenmeyer y se concentraron en rotavapor hasta tener un poco menos de 1 ml y posteriormente se ajustó el volumen a 1 ml en viales graduados. El extracto recuperado se introdujo en columna de alúmina conteniendo una capa previa de sulfato de sodio. La muestra se eluyó con 30 ml de hexano y posteriormente con 20 ml de diclorometano-hexano 95% (diclorometano 95:5 hexano v/v), para tener más afinidad con los analitos y permitir una mejor separación de los BPCs de las impurezas no deseadas. El solvente se recuperó en un matraz Erlenmeyer y se concentró en rotavapor hasta tener un poco menos de 1 ml y después se ajustó el volumen a 1 ml en viales graduados. Se adicionó un paso al método oficial, que consistió en hacer pasar el ml de muestra por un cartucho de extracción en fase sólida que contiene carbón activado (ENVI-Carb), en una cámara de vacío, lo que permitió obtener una mayor pureza de los analitos de interés y con ello mejorar la resolución de los cromatogramas facilitando su análisis ().
Análisis cromatográficos de los Bifenilos policlorados
La presencia de los analitos en las muestras se estableció mediante cromatógrafo de gases marca Agilent Technologies modelo 6890N equipado con un inyector modelo 7683 y acoplado a un equipo detector de μ-captura de electrones (GC/ECD) con una fuente de Ni63. Se empleó una columna capilar ZB-1 (Phenomenex), de 30 m de longitud, 0.25 mm de diámetro interno y 1 μm de fase estacionaria (5% fenil- 95% dimetilpolisiloxano). El método utilizado fue el BPC-RTL2Ml con una condición de puerto en el modo splitless, inyectando la cantidad de 1μL. Se utilizó un ciclo variable de temperatura que siguió el siguiente orden: temperatura inicial de 70°C por 2 min; incremento de temperatura de 25°C por min hasta alcanzar 150°C; incremento de temperatura de 3°C por min hasta alcanzar 200°C; incremento de temperatura de 8°C por min hasta alcanzar 280°C, manteniendo la temperatura por 10 min. Tiempo de corrida: 42 min. Posteriormente se disminuyó la temperatura a 70°C por 3 min antes de analizar otra muestra. La temperatura del detector se mantuvo a 320°C y un flujo de 60ml/min. Después de cada muestra de pescado, se analizó una muestra de solvente para confirmar que en la columna no quedaran pesticidas residuales atrapados que alterasen los valores reportados.
Resultados y discusión
Las características de peso, talla y músculo de las especies de pescado de bagre, tilapia y lobina se presentan en la , donde se observa que la especie más grande fue el bagre, con registros de peso total que fluctúan entre 1.735 y 4.655 g y una longitud de 54 a 73 cm; los ejemplares de lobinas variaron entre 1.115 a 2.755 g y midieron entre 43 y 56 cm. Las tilapias fueron en general los especímenes más pequeños, con pesos de 820 a 1.410 g y una longitud de 34 y 41 cm. Los porcentajes de músculo o porción comestible en la lobina oscilaron en el rango del 33,19 al 39.29%, en el bagre del 30,82 al 45,82% y para la tilapia del 31,61 al 37,07%. No se observó una asociación entre el peso o longitud con la porción comestible.
La composición química de los especímenes de pescado se muestra en la . La proporción de humedad en todas las muestras varió entre 76,66 y 83,55% y el contenido de sólidos totales entre 16,45 y 23,34%. El contenido de grasa de los ejemplares de lobina varió entre 0,92 y 3,46% y el de los de tilapia entre 1,41 y 2,36%, indicando que ambas especies son magras. En los especímenes de bagre el contenido delípidos fue más alto, variando entre 2,26 y 5,61%, indicando que es una especie semi-grasa (The Norwegian Food Safety Authority, 2006).
Los resultados del análisis de BPCs presentes en los músculos de pescado se determinaron en la grasa de pescado y se expresaron como ng/g de músculo tomando en cuenta la concentración de grasa para cada espécimen reportada en la . Se puede observar que el tipo y concentración de BPC varió entre especies y entre piezas de una misma especie (). No se detectó la presencia del BPC 77 en ninguno de los muestras estudiadas, en tanto que el BPC 81, 157 y 189 estuvieron presentes en niveles por debajo del límite de cuantificación del presente estudio (). El BPC 156 fue el congénere que se encontró con mayor incidencia en las tres especies ().
En los especímenes de bagre no se encontraron los BPCs 77 y 81. En tanto que los BPCs 157 y 189 estuvieron presentes a niveles traza. El BPC 167 fue el congénere que se presentó en mayor concentración y frecuencia en esta especie. En la lobina no se detectaron los BPCs 77, 81, 114 y 157. En tanto que los BPCs 118, 167 y 169 se encontraron en niveles traza. El BPC 156 fue el congénere 156 que se presentó con mayor frecuencia, pero el BPC presentó la mayor concentración en un ejemplar (1,74 ng/g). En las muestras de tilapia no se encontraron los BPCs 77 y 105. Los BPCs 81, 114, 118, 126, 157, 167 y 189 estuvieron en niveles traza en uno o todos los especímenes. En esta especie solo se cuantificó la presencia del BPC 156 en un rango de 0,24 a 1,12 ng/g.
La sumatoria de BPCs indica que los valores máximos encontrados para estas especies fue de 7,11ng/g de músculo para bagre, 2,02 ng/g de músculo para lobina y 1,12 para tilapia. Estos valores están muy por debajo del valor máximo permisible de 2.000 ng/g de músculo de pescado establecido por el Departamento de Drogas y Alimentos de Estados Unidos para considerar que un pescado representa riesgo para consumo humano por presencia de BPCs (USFDA, 2001). La baja concentración de BPCs en la República Española podría estar asociada con su reciente creación, su ubicación geográfica, alejada de grandes ciudades y por estar alimentada por un pequeño río que desciende de la zona montañosa recorriendo áreas poco pobladas ().
El contenido de BPCs en el músculo no mostró correlación con ninguno de los parámetros biométricos (tamaño, peso o porción comestible) ni con los parámetros de composición química (contenido de humedad, sólidos o grasa) para los individuos de cada especie. Sinembargo los especímenes de bagre presentaron mayor contenido de grasa en músculo y una mayor incidencia de contenido total de BPCs, lo que sugiere que el contenido de grasa influye en la concentración deBPCs por especie. Es probable que la dieta de los animales sea un factor importante para la concentración de estos compuestos orgánicos persistentes, ya la dieta del bagre incluye insectos y peces de menor tamaño y suele alimentarse en el fondo del ecosistema.
La toxicidad de los BPCs varía con la estructura química y se ha establecido un sistema denominado Factor de Equivalencia Tóxica (TEF) que permite comparar el nivel de toxicidad entre los diferentes congéneres, en relación con el nivel tóxico de las dioxinas. La dioxina 2,3,7,8-TCDD es considerada la más tóxica y se le asigna el valor 1. El único compuesto tipo dioxina con valor 1 es el 1,2,3,7,8-PnCDD. Los BPCs tienen diferentes valores de TEF, siendo el más alto el del BPC 126 con un valor de 0.1 (Pie de página de la ). El valor Equivalente Tóxico (TEQ) se obtuvo multiplicando el valor TEF de cadaBPC por su concentración en el músculo para cada espécimen y los resultados se muestran en la Tablaadicional 4. Los ejemplares de bagre presentaron los valores más altos de toxicidad (ΣTEQ) debido principalmente a la presencia del BPC 126. Una muestra de lobina presentó un alto valor de toxicidad, en tanto que las tilapias presentron valores muy bajos de toxicidad, tanto por el bajo contenido como por el tipo de BPCs presentes en el músculo. Este resultado podría estar asociado al hábito alimenticio herbívoro de las tilapias, que en general prefieren plantas superiores o plancton, aunque en condiciones de escasez pueden consumir otros organismos. Los resultados encontrados en el presente estudio concuerdan con los reportados para el caso de la tilapia (Sapozhnikova, Bawardi, & Schlenk, Citation2004), donde se encontró que los individuos de Tilapia mozambica acumularon menos niveles de BPCs tipo dioxina que los de corvina (Cynoscion xanthulus) capturados en el lago salino Salton Sea en el oeste de California.
Los BPCs son sustancias que se acumulan en la fase lipídica de los organismos, por lo que existe un efecto de bioconcentración y biomagnificación que afecta alser humano, ubicado en el eslabón superior de la cadena alimentaria junto a otras especies depredadoras. Es por ello que la Agencia de Protección Ambiental (EPA) de Estados Unidos generó guías que permiten establecer las recomendaciones para el consumo de pescado, considerando el efecto carcinogénico y no carcinogénico que tienen los BPCs en el ser humano, así como el contenido de BPCs presentes en la porción de músculo comestible (USEPA, 2000). En el presente estudio se usó la sumatoria de BPCs de cada espécimen y el valor promedio por especie, para determinar los límites de porciones de consumo máximo recomendado (). En el caso de que no exista riesgo de toxicidad se indica un consumo no restringido (>16 porciones). Es importante señalar que los BPCs tiene un mayor riesgo como agentes carcinogénicos, por lo que los límites de consumo son más estrictos con respecto a este efecto. Los especímenes de bagre presentaron mayor concentración de BPCs, por lo que la recomendación de consumo para esta especie es de cuatro porciones de 0,227 kg al mes para evitar el riesgo de cáncer inducido por estas sustancias. Es importante señalar que esta recomendación equivale a un consumo de 11,804 kg al año, que está por debajo del consumo promedio de pescado en México, estimado en 8,3 kg per cápita. Sin embargo, las personas que habitan en la región o frecuentan la presa para abastecerse de estos peces como alimento deben ser alertadas del riesgo que existe para su salud en su consumo. En el caso de la lobina y la tilapia los niveles máximos de consumo recomendado son de 16 porciones mensuales respectivamente.
Conclusiones
La presa República Española es un ecosistema acuático con bajo índice de contaminación de BPCs probablemente asociado con su reciente creación y ubicación geográfica alejada de zonas densamente pobladas. El BPC 156 fue el congénere con mayor presencia en la Presa República Española, encontrándose presente en las tres especies estudiadas. Es importante destacar que el BPC 126, considerado el más tóxico, se cuantificó en dos ejemplares de bagre, uno de lobina y se presentó a niveles traza en todos los especímenes de tilapia. La especie bagre fue la que mostró mayor concentración de BPCs en músculo, y valores más altos de TEQ, siendo la especie con mayor restricción en los niveles máximos de consumo recomendado (menos de cuatro raciones por mes). No se encontró asociación entre la acumulación de BPCs y el contenido de grasa, peso o talla dentro de una misma especie. Sin embargo los especímenes debagre presentaron mayor proporción de grasa y contenido de BPCs. Es necesario informar sobre la ingesta máxima recomendado de esta especie para los habitantes de la región que consumen con regularidad los peces de la presa.
Material complementario
El material complementario para este artículo está disponible en línea en http://dx.doi.org/10.1080/19476337.2011.603098
tcyt_a_603098_sup_27125836.pdf
Download PDF (644.6 KB)Referencias
- Bordajandi , L. R. , Gómez , G. M. , Fernández , A. , Abad , E. , Rivera , J. and González , M. J. 2003 . Study on BPCs, PCDD/Fs, organochlorine pesticides, heavy metals and arsenic content in freshwater fish species from the River Turia (Spain) . Chemosphere , 53 : 163 – 171 .
- Canedo-López , Y. and Macías-Zamora , J. V. 2007 . Polychlorinated dibenzo-p-dioxins and dibenzofurans in fish from four different regions of Mexico . Ciencias Marinas , 33 : 217 – 227 .
- Carvalho , F. P. , Villeneuve , J. P. , Cattini , C. , Rendon , J. and deOliveira , J.M. 2009 . Ecological risk assessment of PCBs and other organic contaminant residues in Laguna de Términos, México . Ecotoxicology , 18 : 403 – 416 .
- Covaci , A. , Ryan , J. J. and Schepens , P. 2002 . Patterns of PCBs and PCDD/PCDFs in chicken and pork fatfollowing a Belgian food contamination incident . Chemosphere , 47 : 207 – 217 .
- Environment Canada. 1997 . Reference method for the analysis of polychlorinated biphenyls (EPS 1/RM/31) , Ottawa : Environment Canada .
- Erickson , M. D. 1997 . Analytical chemistry of PCBs, Appendix A , 2nd ed., pp. 581–583 , Boca Raton , FL : Lewis Publishers .
- Fuerhacker , M. , Loutfy , N. , Tundo , P. , Raccanelli , S. , El Dien , A.G. and Tawfic , Ahmed, M. 2006 . Dietary intake of dioxins and dioxin-like PCBs, due to the consumption of dairy products, fish/seafood and meat from Ismailia city, Egypt . Science of the Total Environment , 370 : 1 – 8 .
- Kart , H. , Rufo , U. and Kart-Heinz , S. 2004 . Dioxins, dioxin like PCBs and organochlorine pesticides in salmon of various origins . Organohalogen Compounds , 66 : 1684 – 1690 .
- Kumar , K. S. , Kannan , K. , Paramasivan , O. N. , Shanmugasundaram , V. P. , Nakanishi , J. , Giesy , J. P. and Masunaga , S. 2001 . PCDDs, PCDFs, and dioxinlike PCBs in humans and wildlife samples from India . Organohalogen Compounds , 52 : 305 – 309 .
- Lewis , C. M. and Van Pelt , R. February, 2002 . “ Natural Remediation at Savannah River site ” . In Waste Management 2002 Symposium , 1 – 12 . Tucson , AZ (US) : WM Symposia, Inc .
- Miller-Pérez , C. , Sánchez-Islas , E. , Mucio-Ramírez , S. , Mendoza-Sotelo , J. and León-Olea , M. 2009 . The polychlorinated biphenyls (PCBS) environmental pollutants and their effects on the nervous system and health . Salud Mental , 32 : 335 – 346 .
- Ritter , L. , Solomon , K. R. , Forget , J. , Stemeroff , M. and O’Leary , C. 1995 . A review of selected persistent organic pollutants. Report for the International Programme on Chemical Safety (UNEP/ILO/WHO) , Geneva : UNEP Chemicals, International Labour Office, World Health Organization .
- Sánchez-Ávila , N. , Mata-Granados , J. M. , Ruiz-Jiménez , J. and Luque de Castro , M.D. 1999 . Fast, sensitive and highly discriminant gas chromatography–mass spectrometry method for profiling analysis of fatty acids in serum . Journal of Chromatography A , 1216 : 6864 – 6872 .
- Sapozhnikova , Y. , Bawardi , O. and Schlenk , D. 2004 . Pesticides and PCBs in sediments and fish from the Salton Sea, California, USA . Chemosphere , 55 : 797 – 809 .
- Sather , P. J. , Newman , J. W. and Ikonomou , M. G. 2003 . Congener-based aroclor quantification and speciation techniques: A comparison of the strengths, weaknesses, and proper use of two alternative approaches . Environment Science and Technology , 37 : 5678 – 5686 .
- SEMARNAT (2007). Plan nacional de implementación del Convenio de Estocolmo. Secretaría de Medio Ambiente y Recursos Naturales. Libro en formato electrónico que puede descargarse desde http://www.ine.gob.mx
- Storelli , M. M. , Barone , G. G. and Marcotrigiano , G. O. 2007 . Residues of polychlorinated biphenyls in edible fish of the Adriatic Sea: Assessment of human exposure . Journal of Food Science , 72 : C183 – C187 .
- The Norwegian Food Safety Authority, The Norwegian Directorate of Health, University of Oslo. 2006 . The Norwegian Food Composition Table 2006 Retrieved from www.matportalen.no/matvaretabellen
- US Environmental Protection Agency. 2000 . Guidance for assessing chemical contaminant data for use in fish advisories. Vol 2 – Risk assessment and fish consumption limits , 3rded. , Washington , DC : USEPA. EPA 823-B-00-008 .
- US Food and Drug Administration (USFDA). 2001 . Fish and fisheries products hazards and controls guidance. Appendix5 , 3rd ed. , FDA & EPA Safety levels in regulations and guidance. Washington, DC: USFDA .
- Vaclavik , E. , Tjonneland , A. , Stripp , C. , Overvad , K. , Weber , J. P. and Raaschou-Nielsen , O. 2006 . Organochlorines in Danish women: Predictors of adipose tissue concentrations . Environmental Research , 100 : 362 – 370 .
- Watson , D. H. 2004 . Pesticide, veterinary and other residues in food (pp. 519–525) , 519 – 525 . Cambridge : Woodhead Publishing .
- Zapata-Pérez , O. , Ceja-Moreno , V. , Olmos , M. R. , Pérez , M. T. , Del , Río-García, M. , Yarto , M. … and Gold-Bouchot , G. 2007 . Ecotoxicological effects of POPs on ariidae Ariopsis felis (Linnaeus, 1766) from three coastal ecosystems in the Southern Gulf of Mexico and Yucatan Peninsula . Journal of Environmental Science and Health, Part A – Toxic/Hazardous Substances & Environmental Engineering , 42 : 1513 – 1520 .
Supplementary material
Figura adicional 1. Ubicación geográfica de la presa República Española.
Supplementary . Location dam República Española.
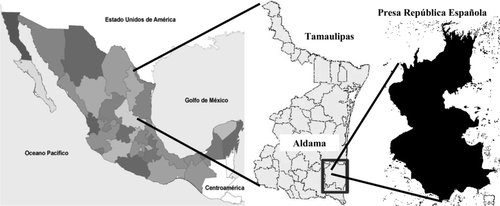
Figura adicional 2. Cromatograma de los BPCs estudiados.
Supplementary . Chromatogram of PCBs studied.