Abstract
In recent years different emerging technologies have been evaluated such as ultrasound, which is usually combined with other preservation factors in order to increase microbial inactivation. Staphylococcus aureus inactivation was performed by simultaneous application of heat (40, 50, or 60 °C) and low frequency ultrasound (20 kHz) at selected wave amplitudes (60, 75, or 90 µm) in culture broth (a w 0.96, and pH 3.5) with different concentrations of vanillin (200, 350, or 500 mg/kg). Death curves were fitted with the Fermi model. A synergic effect was observed when temperature is near to 40 °C at different ultrasonic amplitude waves and vanillin concentrations. Several studied combinations of ultrasound, temperature, and vanillin concentration could be applied in the food industry.
En los últimos años se han evaluado diversas tecnologías emergentes como el ultrasonido, el cual es combinado con otros factores de conservación para aumentar su eficacia para la inactivación microbiana. La inactivación de Staphylococcus aureus, se llevó a cabo aplicando simultáneamente temperatura (40, 50 o 60 °C), ultrasonido de baja frecuencia (20 kHz) con diferentes amplitudes de onda (60, 75 o 90 µm), y diferentes concentraciones de vainillina (200, 350 o 500 mg/kg) como antimicrobiano, en medios de cultivo con a w 0,96 y pH 3,5. Se modelaron las curvas de muerte con el modelo de Fermi. Se encontró un efecto sinérgico de los factores estudiados, especialmente a temperaturas cercanas a 40 °C con diferentes amplitudes de onda ultrasónicas y concentraciones de vainillina. Los resultados obtenidos demuestran que varias de las combinaciones estudiadas podrían tener aplicación en la industria de alimentos.
Introducción
En los últimos años se han evaluado diferentes tecnologías para la conservación de alimentos denominadas emergentes, entre las que se encuentran las altas presiones, pulsos eléctricos, campos magnéticos, luz ultravioleta y ultrasonido de baja frecuencia, las cuales se están evaluando como alternativa a los tratamientos térmicos (Condón, Raso, & Pagán, 2005), para la inactivación de microorganismos y enzimas reduciendo de forma importante el uso de calor o incluso eliminándolo (Señorans, Ibáñez, & Cifuentes, Citation2003). El ultrasonido de alta intensidad y baja frecuencia, consiste en ondas sonoras cuyas frecuencias se encuentran por encima del umbral de detección del ser humano (>16 kHz). El daño que genera el ultrasonido en las células microbianas es provocado por un fenómeno conocido como cavitación (Gould, Citation1988). Éste causa la alteración de la membrana celular mediante la formación de pequeñas burbujas, que al romperse cerca de la célula generan ciclos de compresión/expansión (Raso & Barbosa-Cánovas, Citation2003). Cuando se utilizan bajas frecuencias y altas intensidades, la onda ultrasónica genera altos gradientes de presión, corte y temperatura, provocando el colapso celular mediante la formación de una gran cantidad de poros en la membrana, causando la fuga del líquido intracelular (Piyasena, Moharelo, & McKellar, Citation2003). También durante la cavitación se generan altas temperaturas que pueden tener efecto sobre los microorganismos, pero estos cambios de temperatura ocurren momentáneamente y sólo en el líquido que rodea a las células, con el consiguiente daño a un número limitado de éstas (López-Malo, Guerrero, & Alzamora, Citation1999).
El tratamiento con ultrasonido por sí sólo no es suficientemente eficaz para inactivar a los microorganismos presentes en un alimento, por lo que debe combinarse con otros factores que aumenten de forma considerable su efectividad. Se ha comprobado que cuando el ultrasonido se combina con niveles moderados de otros factores como presión (manosonicación), temperatura (termosonicación) o ambos (manotermosonicación), hay un incremento notable en el efecto letal sobre los microorganismos, sin que se presenten alteraciones considerables de las características físicas, químicas y/o sensoriales del alimento (Guerrero, López-Malo, & Alzamora, Citation2001; López-Malo, Palou, Jiménez-Fernández, Alzamora, & Guerrero, Citation2005; Mañas & Pagán, Citation2005). Asimismo, el ultrasonido y la adición de antimicrobianos naturales como la vainillina, tienen la capacidad de inactivar el crecimiento microbiano reduciendo la intensidad del tratamiento térmico (López-Malo, Alzamora, & Argaiz, Citation1995). La vainillina (4-hidroxi-3-metoxibenzaldehido) es uno de los compuestos de aroma y sabor más utilizados en la industria de los alimentos el cual es generalmente reconocido como seguro. La vainillina posee propiedades antimicrobianas en una gran variedad de hongos y levaduras tanto en estudios in vitro como en sistemas alimenticios y diferentes bebidas (Cerruti & Alzamora, 1996; Fitzgerald, Stratford, Gasson, & Narbad, Citation2005). Debido a su carácter hidrofóbico, la vainillina se une a los lípidos de la membrana celular y mitocondria haciéndolas más permeables, de esta manera se promueve la salida de componentes celulares, metabolitos e iones, además desestabiliza la membrana citoplasmática y perturba sistemas como el transporte activo de electrones o la fuerza motriz de protones (Burt, Citation2004).
La combinación de los factores antes mencionados junto con otros como la modificación del pH y a w, así como la adición de compuestos antimicrobianos, genera un ambiente adverso para el desarrollo de microorganismos indeseables, alterando los mecanismos homeostáticos en las células vegetativas y/o esporas microbianas de una forma cooperativa o sinérgica. Si el proceso involucra la interferencia multifactorial, los requerimientos o niveles de los distintos factores de conservación serán teóricamente menores y, por lo tanto, se producirá un menor daño en la calidad del alimento (Gould, Citation1995; Mañas, Pagán, & Raso, Citation2000; Alzamora & López-Malo, 2002). Tradicionalmente se conoce a este tipo de combinaciones multifactoriales como métodos combinados o tecnología de barreras. Aunque se han realizado un gran número de estudios relacionados con la tecnología de barreras, no existe todavía un enfoque sistemático de la aplicación de este concepto, limitado actualmente a muchas tecnologías empíricas artesanales y a algunos cuantos desarrollos intencionales de nuevos productos (Alzamora, Cerruti, Guerrero, & López-Malo, Citation1995; Señorans et al., Citation2003; Broda, Citation2007; Kuldiloke, Eshtioghi, Zenker, & Knorr, Citation2007).
Para comprender mejor y evaluar la acción que los diversos factores de conservación presentes en la tecnología de barreras ejercen sobre la inactivación de microorganismos, es necesario recurrir al uso de modelos matemáticos. Éstos describen y predicen el crecimiento, supervivencia e inactivación microbiana. Para aplicar modelos matemáticos, primero se obtienen datos poblacionales en función del tiempo, de microorganismos que son cultivados en condiciones controladas con diferentes factores de conservación. Una vez obtenidos los resultados del comportamiento microbiano, se realiza una modelización de tipo primario por medio de ajustes con ecuaciones matemáticas específicas, con la finalidad de obtener diferentes parámetros, los cuales describen los cambios de una población con respecto al tiempo y además dan información acerca del comportamiento del microorganismo (por ejemplo la duración de la fase lag). Posteriormente se lleva a cabo la modelización secundaria, en la cual los parámetros obtenidos en el modelado primario son analizados estadísticamente, con la finalidad de observar cambios en los parámetros por efecto de los factores de conservación estudiados. En este punto se determina qué factores son significativos en el desarrollo del microorganismo, así como la posible existencia de interacciones entre dichos factores. Por último, el análisis estadístico genera ecuaciones que se usan para modelar y/o predecir las respuestas del microorganismo bajo nuevas condiciones (o sus combinaciones), permitiendo la interpolación dentro de los intervalos estudiados (Buchanan & Whiting, 1997; Peleg & Cole, Citation1998; Alzamora, Tapia, & López-Malo, 2000; Betts & Everis, 2005; Lebert & Lebert, Citation2006).
El propósito del presente trabajo fue modelizar la inactivación termosónica de Staphylococcus aureus, mediante la aplicación simultánea de ultrasonido de baja frecuencia a diferentes amplitudes de onda, alta temperatura, y diferentes concentraciones de vainillina, en un medio de cultivo con a w y pH controlados.
Materiales y métodos
Staphylococcus aureus
Se utilizó Staphylococcus aureus (ATCC 29213) obtenido en el laboratorio de microbiología de la Universidad de las Américas Puebla, México. El microorganismo se conservó en agar de soya tripticaseina (Merck, México D.F., México). Para la realización de los diferentes experimentos, el microorganismo se hizo crecer a fase exponencial (109 UFC/mL) inoculando una asada del cultivo puro en 10 mL de caldo soya tripticaseina e incubándolo a 35 °C durante 18 h.
Aplicación de tratamientos termosónicos
Los tratamientos termosónicos fueron realizados en un vaso de doble pared estéril (4,5 cm de diámetro interno, 8,5 cm de altura), en el cual circulaba agua con temperatura controlada mediante un baño de recirculación (modelo 1268–24, Cole-Palmer, Chicago, IL, USA), para mantener la temperatura en 40, 50 ó 60 °C. Se aplicó ultrasonido a 20 kHz con una punta de 25,4 mm de diámetro (CPX-400, Cole-Parmer, Chicago, IL, USA), utilizando amplitudes de 60, 75 ó 90 µm. La punta se mantuvo a 4 cm de distancia del fondo del vaso (López-Malo et al., Citation2005).
Las combinaciones de los diferentes factores (temperatura, amplitud de onda ultrasónica y concentración de vainillina) a estudiar fueron producidas en el programa Design-Expert (versión 6.0.6, Stat Ease Inc., Minneapolis MN, USA) mediante la aplicación del diseño de superficie de respuesta Box Behnken de un solo bloque (Montgomery, Citation1998), generándose 17 experimentos a tres niveles (). Para cada tratamiento se inoculó 1mL del microorganismo (≈104 UFC/mL) en 50 mL de caldo soya tripticaseina ajustado a a w 0,96 con sacarosa y pH de 3,5 con ácido clorhídrico 1N (Fisher, México D.F., México) previamente esterilizado por filtración (tamaño de poro de 10 µm). Se agregó vainillina (Sigma-Aldrich, St. Louis, MO, USA) en solución alcohólica (10 g/L), la cual fue previamente esterilizada por filtración (10 µm) para ajustar los sistemas a 200, 350 ó 500 mg/kg.
Tabla 1. Diseño experimental Box-Behnken y parámetros del modelo de Fermi (a y t
c
).
. Box-Behnken's experimental design and Fermi model parameters (a and t
c
).
Se tomaron muestras de los medios formulados sujetos a los diversos tratamientos termosónicos, a las que se realizaron diluciones seriadas (1 g/L peptona de caseína, Merck, México D.F., México) y se sembraron en cajas de agar soya tripticaseina por medio del sistema de siembra por dilución en espiral (Autoplate 4000, Spiral Biotech, Norwood, MA, USA) y se incubaron a 35 °C durante 24 h para su lectura en el contador automático de colonias (Q-Count, Spiral Biotech, Norwood, MA, USA). Cada análisis se realizó por triplicado.
Modelización matemática
Las curvas de muerte termosónica de Staphylococcus aureus fueron ajustadas mediante regresión no lineal utilizando el modelo de Fermi (Peleg, Citation1997), de la cual se obtuvieron los parámetros tc y a (Ecuación 1) utilizando el programa Kaleida Graph (versión 4.0, Synergy Software, Reading PA, USA):
La modelización secundaria se realizó para cada parámetro del modelo de Fermi, a y tc , analizando los factores de conservación que resultaron significativos (p < 0,05) y eliminando aquellos que no lo fueron (p > 0,05), asimismo para poder evaluar el ajuste al modelo se realizó la prueba de pérdida de ajuste (Draper & Smith, Citation1981), la cual consiste en que la varianza residual es particionada en una varianza atribuida a la pérdida de ajuste y al error puro de la misma, indicando un ajuste cuando el valor es no significativo (p > 0,05), generando un polinomio asociado al mismo (Ecuación 2) utilizando el programa Design-Expert (versión 6.0.6, Stat Ease Inc., Minneapolis, MN, USA).
Resultados y discusión
Modelización primaria
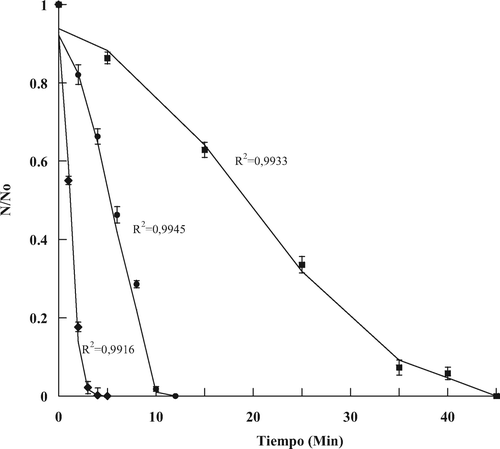
Al aplicar temperaturas de 60 °C se obtuvieron cinéticas de muerte cuasi-lineales () para S. aureus; sin embargo, cuando se utilizaron temperaturas menores a 60 °C las cinéticas de muerte no presentaron dicha tendencia. Esto fue probablemente provocado por la intervención de los otros factores (amplitud de onda ultrasónica y concentración de vainillina), que afectaron la forma de la curva (velocidad de muerte), esto concuerda con lo postulado por Lee, Zhou, Liang, Feng y Martin (2009) quienes afirman que cuando más de un agente letal está involucrado en un proceso de inactivación se observan diferentes curvas de tipo no lineal, siendo indicativo de la existencia de población microbiana con diferente resistencia a los dos agentes letales. El ajuste de las curvas de muerte de S. aureus con el modelo de Fermi, propuesto para ser utilizado en alimentos por Peleg (Citation1997), fue adecuado con un coeficiente de determinación (R2) promedio de 0,97 ± 0,03. Dicho modelo describe curvas de muerte tanto lineales como del tipo sigmoidea. Otra ventaja del modelo de Fermi es que sus parámetros son interpretados fácilmente en función de la forma de las curvas de muerte. Sin embargo, lo que lo hace aún más atractivo es su capacidad de describir decaimientos muy agudos. Al aplicar el modelo de Fermi (Ecuación 1) a los datos experimentales se obtuvieron sus dos parámetros tc y a (Tabla 1). Cabe mencionar que Peleg (Citation1997) reporta que alrededor del 90% de la muerte microbiana ocurre en el intervalo tc ± 3a. En la Tabla 1 se puede ver claramente el efecto multifactorial (temperatura, amplitud de onda ultrasónica y concentración de vainillina) sobre los parámetros del modelo de Fermi.
Figura 1. Curvas de muerte termosónica de Staphylococcus aureus, en un sistema modelo formulado con a w 0,96 y pH 3,5, ajustadas (líneas) con el modelo de Fermi para distintos tratamientos: (♦) 500 mg/kg de vainillina, 60 °C y 75 µm; (•) 350 mg/kg de vainillina, 50 °C y 75 µm; (▪) 350 mg/kg de vainillina, 40 °C y 90 µm de amplitud de onda ultrasónica.
Figure 1. Staphylococcus aureus thermosonic death curves in a model system formulated with aw 0.96 and pH 3.5, fitted (lines) with Fermi model for selected treatments: (♦) 500 mg/kg vanillin, 60 °C, and 75 µm; (•) 350 mg/kg vanillin, 50 °C, and 75 µm; (▪) 350 mg/kg vanillin, 40 °C, and 90 µm ultrasound wave amplitude.
Modelización secundaria
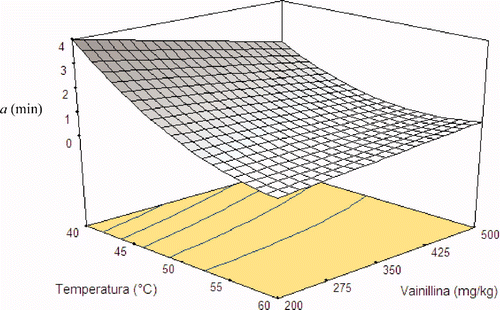
Para el parámetro a, el ajuste mediante el análisis tipo superficie de respuesta fue realizado mediante la transformación de su raíz cuadrada. Los valores fueron significativos (p < 0,05) para los factores de conservación temperatura (A), concentración de vainillina (C), temperatura al cuadrado y la interacción entre temperatura y vainillina (Ecuación 3). La prueba de pérdida de ajuste del polinomio generado no fue significativa (p = 0,24).
Figura 2. Gráfica de superficie de respuesta para el parámetro a (pendiente de la curva en tc , tiempo para disminuir el 50% de la población) del modelo de Fermi para las curvas de muerte termosónica de Staphylococcus aureus en un sistema modelo formulado con a w 0,96 y pH 3,5.
Figure 2. Response surface graph for Fermi model parameter a (slope of the curve at tc , time to reduce 50% of the population) for Staphylococcus aureus thermosonic death curves in a model system formulated with a w 0.96 and pH 3.5.
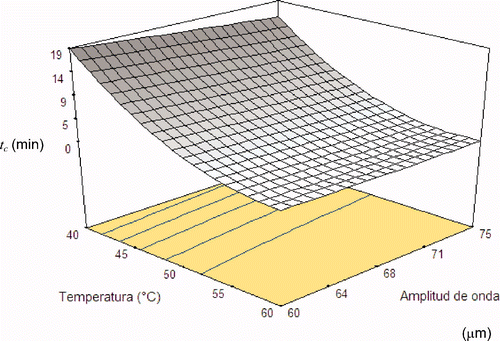
Por lo que respecta al parámetro tc , como se observa en la Ecuación 4 sólo los factores de temperatura (A), amplitud de onda ultrasónica (B), temperatura al cuadrado e interacción temperatura–amplitud de onda ultrasónica fueron significativos (p < 0,05). La prueba de falta de ajuste del polinomio generado no fue significativa (p = 0,12). Para ambas modelizaciones (a y tc ) se encontraron valores de significancia estadística, así como su no significancia en la prueba de pérdida de ajuste lo que indica que los dos modelos tienen un buen ajuste. Además, los valores de R2 para ambos modelos fueron >0,90.
Figura 3. Gráfica de superficie de respuesta para el parámetro tc (tiempo para disminuir el 50% de la población) del modelo de Fermi para las curvas de muerte termosónica de Staphylococcus aureus en un sistema modelo formulado con a w 0,96 y pH 3,5.
Figure 3. Response surface graph for Fermi model parameter tc (time to reduce 50% of the population) for Staphylococcus aureus thermosonic death curves in a model system formulated with a w 0.96 and pH 3.5.
Conclusiones
Las curvas de muerte de S. aureus se ajustaron adecuadamente con el modelo de Fermi. A valores cercanos a 60 °C, la temperatura es el factor dominante en la velocidad de muerte; sin embargo cuando los valores de temperatura son cercanos a 40 °C, existe un efecto sinérgico de los diferentes factores estudiados en la inactivación de S. aureus, utilizándose menores concentraciones de vainillina que las reportadas cuando este antimicrobiano se utiliza sin tratamientos termosónicos. La combinación de factores como a w, pH, amplitud de onda ultrasónica, temperatura, y antimicrobianos demuestra tener potencial para la industria de alimentos. Sin embargo es necesario realizar más estudios para generar las bases de una pasteurización efectiva utilizando un enfoque multifactorial.
Agradecimientos
Agradecemos al Consejo Nacional de Ciencia y Tecnología (CONACyT) de México por el financiamiento de los proyectos 44088 “Enfoque multifactorial en la inocuidad y estabilidad de alimentos vegetales: productos de frutas” y 84859 “Combinación de factores físicos y químicos para la inhibición de microorganismos relacionados con alimentos” de los cuales es parte este trabajo. Los autores Avila-Sosa y Gastélum agradecen al CONACyT y a la Universidad de las Américas Puebla por las becas recibidas para sus estudios doctorales.
Referencias
- Alzamora , S. M. and López-Malo , A. 2002 . “ Microbial behavior modeling as a tool in the design and control of minimally processed foods ” . In Engineering and food for the 21st century , Edited by: Welti-Chanes , En J. , Barbosa-Cánovas , G. V. and Aguilera , J. M. 631 – 650 . Boca Raton, FL : CRC Press .
- Alzamora , S. M. , Tapia , M. S. and López-Malo , A. 2000 . “ Overview ” . In Minimally processed fruits and vegetables. Fundamental aspects and applications , Edited by: Alzamora , En S.M. , Tapia , M. S. and López-Malo , A. 1 – 9 . Gaithersburg, MD : Aspen Publishers, Inc .
- Alzamora , S. M. , Cerrutti , P. , Guerrero , S. and López-Malo , A. 1995 . “ Minimally processed fruits by combined methods ” . In Food preservation by moisture control. Fundamentals and applications , Edited by: Barbosa-Cánovas , En G.V. and Welti-Chanes , J. 463 – 492 . Lancaster, PA : Technomic Publishing Co. Inc .
- Betts , G. and Everis , L. 2005 . “ Modeling systems and impact on food microbiology ” . In Novel food processing technologies , Edited by: Barbosa-Cánovas , En G.V. , Tapia , M. S. and Cano , P. M. 555 – 578 . Boca Raton, FL : CRC Press .
- Broda , D. M. 2007 . The effect of peroxyacetic acid-based sanitizer, heat and ultrasonic waves on the survival of Clostridium estertheticum spores in vitro . Letters in Applied Microbiology , 45 : 336 – 341 .
- Buchanan , R. L. and Whiting , R. C. 1997 . “ Predictive modeling ” . In Food microbiology fundamentals and frontiers , Edited by: Doyle , En M.P. , Beuchat , L. R. and Montville , T. J. 728 – 739 . Washington, DC : ASM Press .
- Burt , S. 2004 . Essential oils: Their antibacterial properties and potential applications in foods – a review . International Journal of Food Microbiology , 94 : 223 – 253 .
- Cerrutti , P. and Alzamora , S. M. 1996 . Inhibitory effects of vanillin on some spoilage yeasts in laboratory media and fruit purees . International Journal of Food Microbiology , 29 : 379 – 386 .
- Cerrutti , P. and Alzamora , S. M. 1997 . Vanillin as an antimicrobial for producing shelf-stable strawberry puree . Journal of Food Science , 62 : 608 – 612 .
- Condón , S. , Raso , J. and Pagán , R. 2005 . “ Microbial inactivation by ultrasound ” . In Novel food processing technologies , Edited by: Barbosa-Cánovas , En G.V. , Tapia , M. S. and Cano , P. M. 423 – 442 . Boca Raton, FL : CRC Press .
- Delaquis , P. , Stanich , K. and Toivonen , P. 2005 . Effect of pH on the inhibition of Listeria spp. by vanillin and vanillic acid . Journal of Food Protection , 68 : 1472 – 1476 .
- Draper , N. R. and Smith , H. 1981 . Applied regression analysis , New York : John Wiley & Sons .
- Fitzgerald , D. J. , Stratford , M. , Gasson , M. J. , Uekert , J. , Bos , A. and Narbad , A. 2004 . Mode of antimicrobial action of vanillin against Escherichia coli, Lactobacillus plantarum and Listeria innocua . Journal of Applied Microbiology , 97 : 104 – 113 .
- Fitzgerald , D. J. , Stratford , M. , Gasson , M. J. and Narbad , A. 2005 . Structure-function analysis of the vanillin molecule and its antifungal properties . Journal of Agricultural Food Chemistry , 53 : 1769 – 1775 .
- Gould , G. W. 1988 . “ Interference with homeostasis-food ” . In Homeostatic mechanisms in microorganisms , Edited by: Whittenbury , En R. , Gould , G. W. , Banks , J. G. and Board , R. G. 220 – 228 . Bath, , UK : Bath University Press .
- Gould , G. W. 1995 . New methods of food preservation , Glasgow, , UK : Blackie Academic & Professional .
- Guerrero , S. , López-Malo , A. and Alzamora , S. M. 2001 . Effect of ultrasound on the survival of Saccharomyces cerevisiae: Influence of temperature, pH and amplitude . Innovative Food Science & Emerging Technologies , 2 : 31 – 39 .
- Kuldiloke , J. , Eshtioghi , M. , Zenker , M. and Knorr , D. 2007 . Inactivation of lemon pectinesterase by thermosonication . International Journal of Food Engineering , 3 : 1 – 8 .
- Lebert , I. and Lebert , A. 2006 . Quantitative prediction of microbial behaviour during food processing using an integrated modelling approach: A review . International Journal of Refrigeration , 29 : 968 – 984 .
- Lee , H. , Zhou , B. , Liang , W. , Feng , H. and Martin , S. E. 2009 . Inactivation of Escherichia coli cells with sonication, manosonication, thermosonication, and manothermosonication: Microbial responses and kinetics modeling . Journal of Food Engineering , 93 : 354 – 364 .
- López-Malo , A. , Alzamora , S. M. and Argaiz , A. 1995 . Effect of natural vanillin on germination time and radial growth of moulds in fruit-based agar systems . Food Microbiology , 12 : 213 – 219 .
- López-Malo , A. , Guerrero , S. and Alzamora , S. M. 1999 . Saccharomyces cerevisiae thermal inactivation kinetics combined with ultrasound . Journal of Food Protection , 62 : 1215 – 1217 .
- López-Malo , A. , Palou , E. , Jiménez-Fernández , M. , Alzamora , S. M. and Guerrero , S. 2005 . Multifactorial fungal inactivation combining thermosonication and antimicrobials . Journal of Food Engineering , 67 : 87 – 93 .
- Mañas , P. and Pagán , R. 2005 . Microbial inactivation by new technologies of food preservation . Journal of Applied Microbiology , 98 : 1387 – 1399 .
- Mañas , P. , Pagán , R. and Raso , J. 2000 . Predicting lethal effect of ultrasonic waves under pressure treatments on Listeria monocytogenes ATCC 15313 by power measurements . Journal of Food Science , 65 : 663 – 667 .
- Montgomery , D. C. 1998 . Diseño y análisis de experimentos , México, DF : Grupo Editorial Iberoamérica .
- Mourtzinos , I. , Konteles , S. , Kalogeropoulos , N. and Karathanos , V. T. 2009 . Thermal oxidation of vanillin affects its antioxidant and antimicrobial properties . Food Chemistry , 114 : 791 – 797 .
- Ngarmsak , M. , Delaquis , P. , Toivonen , P. , Ngarmsak , T. , Ooraikul , B. and Mazza , G. 2006 . Antimicrobial activity of vanillin against spoilage microorganisms in stored fresh-cut mangoes . Journal of Food Protection , 69 : 1724 – 1727 .
- Peleg , M. 1997 . Modeling microbial populations with the original and modified versions of the continuous and discrete logistic equations . Critical Reviews in Food Science and Nutrition , 37 : 471 – 490 .
- Peleg , M. and Cole , M. B. 1998 . Reinterpretation of microbial survival curves . Critical Reviews in Food Science and Nutrition , 38 : 353 – 380 .
- Piyasena , P. , Moharelo , E. and McKellar , R. C. 2003 . Inactivation of microbes using ultrasound: a review . International Journal of Food Microbiology , 87 : 207 – 216 .
- Raso , J. and Barbosa-Cánovas , G. V. 2003 . Nonthermal preservation of foods using combined processing techniques . Critical Reviews in Food Science and Nutrition , 43 : 265 – 285 .
- Rupasinghe , H. P. , Boulter-Bitzer , J. , Ahn , T. and Odumeru , J. A. 2006 . Vanillin inhibits pathogenic and spoilage microorganisms in vitro and aerobic microbial growth in fresh cut apples . Food Research International , 39 : 575 – 580 .
- Señorans , F. J. , Ibáñez , E. and Cifuentes , A. 2003 . New trends in food processing . Critical Reviews in Food Science and Nutrition , 43 : 507 – 526 .
- Ugarte-Romero , E. , Feng , H. , Martin , S. E. , Cadwallader , K. R. and Robinson , S. J. 2006 . Inactivation of Escherichia coli with power ultrasound in apple cider . Journal of Food Science , 71 : E102 – E108 .
- Walkling-Ribeiro , M. , Noci , F. , Reiner , J. , Cronin , D. A. , Lyng , J. G. and Morgan , D. J. 2009 . The impact of thermosonication and pulsed electric fields on Staphylococcus aureus inactivation and selected quality parameters in orange juice . Food and Bioprocess Technology , 2 : 422 – 430 .