Abstract
Starch was extracted from the seeds of parota tree (Enterolobium cyclocarpum), partially characterized and compared with native corn starch. The starch yield obtained from decorticated seed was 750 g/kg, a medium purity (852 g/kg), a high content of proteins (35 g/kg), and amylopectin predominance (734 g/kg). The parota starch granules showed a round-oval form with an average size of 25 μm, less solubility and swelling factor than corn starch. The pasting properties of the starch suggest that the corn starch showed better characteristics in viscosity than the parota starch. The thermal parameters suggest the presence of crystalline zones in parota starch. The parota starch could be used to increase the solid content and viscosity in food systems, which is being cooked at high temperature.
El almidón de semillas de arboles de parota (Enterolobium cyclocarpum) fue extraído, caracterizado parcialmente y comparado con almidón nativo de maíz. Se obtuvo un rendimiento de almidón de las semillas de parota sin testa de 750 g/kg, una pureza media (852 g/kg), un alto contenido de proteínas (35 g/kg) y una predominancia de amilopectina (734 g/kg). Los gránulos del almidón de parota mostraron una forma redonda-oval y un tamaño promedio de 25 μm y, mostraron menor grado de hinchamiento y solubilidad que el almidón de maíz. Las propiedades de formación de pasta sugieren que el almidón de maíz posee mejores propiedades como agente espesante que el almidón de parota. Los parámetros térmicos del almidón de parota sugieren una mayor cantidad de dobles hélices. Se concluye que el almidón de parota puede ser utilizado para incrementar el contenido de sólidos y la viscosidad en sistemas alimentarios procesados mediante tratamiento térmico.
Introducción
La parota (Enterolobium cyclocarpum (Jacq.) Griseb. (Fabaceae)) es un árbol con una distribución natural desde México, América Central y las Antillas hasta el norte de Sudamérica, alcanza hasta 30 m de altura y desarrolla una copa muy extendida (en algunos casos, más de 20 m de ancho). Puede encontrarse en diversos tipos de vegetación, como el bosque tropical húmedo, el bosque tropical seco y el bosque muy húmedo premontano (Holdridge et al., Citation1997; Camacho, Citation1981; Vásquez-Yanes y Pérez-García, 1977). En México, se encuentra a lo largo de la vertiente del Golfo de México desde el sur de Tamaulipas hasta la Península de Yucatán y en la costa del Pacífico desde Sinaloa hasta Chiapas (Pennington y Sarukhan, 1993; Rzedowski, Citation1986). El fruto de este árbol es una vaina ancha, aplanada, curva e indehiscente. Las semillas maduras tienen una testa dura e impermeable, de modo que pocas veces son atacadas por insectos. Dichas características se deben a capas de esclereidas lignificadas (Duarte, Citation1978). Se ha reportado una producción anual de fruto de parota de 725 kg/árbol (Álvarez-Morales et al., Citation2003), por lo que representa un recurso atractivo para de utilizarse. Las semillas son un alimento típico en los estados de Morelos, Guadalajara, Guerrero y Michoacán, donde las consumen tostadas, molidas o mezcladas con otros alimentos (González, Citation1984; Gómez, Citation1985). El valor nutricional de las semillas enteras radica en su contenido de proteínas (200–400 g/kg) (Vásquez-Yanes y Pérez-García, 1977) y carbohidratos (631 g/kg Extracto libre de nitrógeno, b.s.), encontrándose el almidón en mayor concentración (Olvera-Novoa et al., Citation1993; Serratos-Arévalo et al., Citation2008).
El almidón es el principal polisacárido de almacenamiento en cereales, leguminosas, semillas, tubérculos y frutos verdes, en donde se encuentra organizado en entidades pequeñas llamadas gránulos. Los gránulos de almidón son extraídos por medios físicos para su utilización en diversas industrias, incluyendo la alimentaria. El almidón de maíz ha sido considerado comúnmente como la fuente de almidón comercial, siendo utilizado ampliamente en la elaboración de alimentos debido sus características estructurales y fisicoquímicas (BeMiller, Citation1993). Sin embargo, gradualmente se ha puesto atención en fuentes alternativas de almidón, lo cual puede proveer nuevos almidones con propiedades especiales para usos específicos en la industria de alimentos y química (Guízar-Miranda et al., Citation2008; Henríquez et al., Citation2008; Espinosa-Solis et al., Citation2009).
Existen trabajos sobre las propiedades nutricionales y toxicológicas de la vaina y semilla de parota en ganado (Álvarez-Morales et al., Citation2003; Cecconello et al., Citation2003; Serratos-Arévalo et al., Citation2008). Sin embargo, es escasa la información referente al aprovechamiento de las semillas como fuente potencial de almidón y de sus características y propiedades. Por ello, el objetivo de este estudio fue extraer almidón a partir de las semillas del árbol de parota y realizar su caracterización química, morfológica, así como sus propiedades de formación de pasta, funcionales y térmicas.
Materiales y métodos
Las semillas del árbol de parota (Enterolobium cyclocarpum) () fueron colectadas en la localidad de Tuxpan (Iguala de la Independencia, Guerrero, México). Almidón nativo de maíz grado reactivo (Sigma-Aldrich, México, Toluca, Estado de México) fue utilizado como testigo.
Análisis de las características físicas y rendimiento comestible de las semillas
Las características físicas determinadas fueron morfología, tamaño y peso. La morfología fue evaluada describiendo la apariencia externa y color aparente. El tamaño (longitud y ancho) fue determinado utilizando un vernier (Mitutoyo, Japón).
Para la determinación del rendimiento de la porción comestible, la testa y el endospermo de las semillas fueron separados y pesados en una balanza granataria (OHAUS, México, DF). El rendimiento fue calculado dividiendo el peso del endospermo entre el peso de la semilla entera multiplicado por 1 kilogramo.
Extracción del almidón de semillas de parota
La testa fue rota al hacer pasar las semillas de parota por un molino para granos (Corona, Medellín, Colombia) y retirada de forma manual. Posteriormente la semillas libres de testa fueron pasadas nuevamente por el molino hasta obtener una harina, la cual fue utilizada para la extracción de almidón empleando la técnica descrita por Jiménez-Hernández et al. (Citation2007). Esta técnica consistió en mezclar un volumen de harina de endospermo con dos volúmenes de agua destilada y licuar (licuadora Black & Decker, mod. BLM10600P, China) por 1 min a la máxima velocidad. La suspensión obtenida fue transferida a un vaso de precipitado y mantenida en reposo por 20 min. Después, la suspensión fue decantada y el sobrenadante fue licuado nuevamente con agua destilada y dejado en reposo 40 min. El sedimento con los almidones fue licuado por 1 min a la máxima velocidad y dejado en reposo por 30 min. Posteriormente fue filtrado a través de un tamiz (Montinox, Estado de México, México) de 250 μm de apertura de malla. Los sólidos remanentes en el tamiz (impurezas) fueron eliminados, mientras que el filtrado (almidón) fue lavado hasta que el agua de lavado fue translúcida, lo cual indicó que el almidón había sido extraído. Posteriormente, el producto fue secado en una estufa (Boekel, mod. 132000, Pensilvania, Estados Unidos) a 40 °C por 24 h y finalmente fue molido usando un molino analítico (IKA, Deutschland, Alemania) y tamizado a 250 μm. La muestra fue almacenada en contenedores de plástico con tapa hermética a temperatura ambiente (24–29 °C) para su posterior análisis. Se calculó el rendimiento de la extracción de almidón de acuerdo al método de Pérez et al. (Citation1997), el cual considera la eficiencia de extracción del almidón puro a partir el contenido total del mismo en el vegetal.
Composición química
La composición química proximal del almidón extraído se determinó por triplicado de acuerdo a los métodos de la AOAC (Citation1997) para humedad (925,10), cenizas (923,03), proteínas (920,87) y grasas (920,39). El contenido de fibra cruda se determinó por digestión ácida-alcalina (Tejeda, Citation1992) y el de carbohidratos totales se calculó por diferencia. La pureza del almidón extraído se determinó utilizando el método enzimático de Rose et al. (Citation1991), el cual consistió en tratar 100 mg de muestra de almidón con 5 mL de mezcla de metanol-cloroformo-agua (12:5:3 v/v/v) para eliminar azúcares y compuestos de interferencia, seguido de un tratamiento con etanol caliente para gelatinizar el almidón y posteriormente con 1 mL de una mezcla de digestión. Esta mezcla contenía 400 U/mL de α-amilasa de Aspergillus oryzae y 2 U/mL de amiloglucosidasa de Aspergillus niger (Sigma-Aldrich Química, México, Toluca, Estado de México) a una concentración de 2 U/mL en solución amortiguadora de Acetato de Sodio 0,05 M a pH 5,1. La glucosa obtenida fue cuantificada colorimétricamente utilizando O-toluidina como agente desarrollador de color a 635 nm. La concentración de azúcares reductores se calculó a partir de la ecuación de la recta de una curva patrón de glucosa comprendida entre 150–900 g/mL.
Contenido de amilosa
El contenido de amilosa se cuantificó utilizando el método de McGrance et al. (Citation1998), el cual consistió en solubilizar el almidón en dimetilsulfóxido y posteriormente teñirlo con solución de yodo. La suma de amilosa y amilopectina corresponde al 100% de almidón, por lo que a partir del contenido de amilosa se calculó la relación de amilosa/amilopectina.
Determinación de pH
Se preparó una dispersión al 1% (p/v) de almidón a temperatura ambiente (27 °C), a la cual se determinó pH utilizando un potenciómetro portátil (Hanna Instruments, mod. H198108, Milano, Italia).
Morfología de los gránulos de almidón
La morfología de gránulos de almidón de semilla de parota y maíz fue estudiada utilizando un microscopio electrónico de barrido (SEM JSM-35C Jeol, Japón). Los gránulos de almidón de las muestras fueron adheridos a cintas adhesivas de doble cara, las cuales se fijaron a un soporte, y posteriormente introducidas en el equipo de sombreado Desk-II (Denton Vacuum, E.U.A.) para recubrir los gránulos con una capa de oro de 250 °A. Finalmente fueron examinados en el microscopio electrónico de barrido a un voltaje de 15 KV.
Propiedades de formación de pasta
Las propiedades de formación de pasta de los almidones fueron medidas en un Rapid Visco Analyzer (RVA-4 Newport Scientific Pty. Ltd., Warriewood, Australia). Las muestras de almidón fueron procesadas de acuerdo al método de Ragaee et al. (Citation2006). Los parámetros determinados fueron: temperatura de pasta (temperatura en donde se presenta el primer incremento de viscosidad de al menos de 25 mPa.s en un periodo de 20 s), tiempo de pico (tiempo al cual el pico de viscosidad aparece), pico de viscosidad (la máxima viscosidad), propiedad de fuerza o viscosidad de caída (la mínima viscosidad de pasta caliente), viscosidad final (la viscosidad al final de la prueba durante el enfriamiento a 50 °C), rompimiento (pico de viscosidad – propiedad de fuerza) y retraso (viscosidad final - propiedad de fuerza). Todos esos parámetros fueron calculados a partir de la curva de pasteo usando el software Thermocline version 2.2 Newport Scientific Pty. Ltd. (Warriewood, Australia).
Solubilidad y Factor de hinchamiento (FH)
Se preparó una dispersión de almidón (1 g/100 mL p/p) en tubos de centrífuga y se mantuvo en baño de agua a 50, 60, 70, 80 y 90 °C durante 30 min con agitación cada 5 min. Posteriormente, la dispersión fue centrifugada a 5100 rpm durante 15 min y el volumen del sobrenadante medido, secado a 65 °C y posteriormente pesado. El precipitado fue secado a 65 °C y pesado (Crosbie, Citation1991). La solubilidad (g/kg) fue calculada como el cociente del peso de los sólidos solubles (g) entre el peso de la muestra (g) multiplicado por 1000. El factor de hinchamiento fue estimado como el peso del gel (g) entre la diferencia de el peso de la muestra (g) y el peso de sólidos solubles (g). Las determinaciones fueron realizadas para cada temperatura en base seca del almidón.
Propiedades térmicas
Las determinaciones fueron realizadas con un calorímetro diferencial de barrido (TA Instruments, modelo DSC 2010, New Castle). El equipo fue calibrado con indio (I) y, 3 mg de muestra seca (8% humedad) y 9 μL de agua desionizada fue colocados en una charola de aluminio. Cada charola fue sellada y puesta a reposo por 1 h a temperatura ambiente (21–24 °C) y posteriormente analizada entre 0 °C y 200 °C, con un rampa de calentamiento de 10 °C/min. Una charola vacía fue utilizada como referencia durante las determinaciones. Los parámetros térmicos obtenidos del termograma fueron: temperatura de inicio (To), pico de temperatura (Tp), temperatura de conclusión (Tc) y entalpía de gelatinización (Hgel). Los parámetros fueron determinados usando el software Thermal Analyst Controller Differences 9900. La temperatura de gelatinización (R) fue calculada como To - Tc.
Análisis estadístico
Los resultados obtenidos fueron un promedio de tres mediciones. Se realizó una prueba de ANOVA y una prueba a posteriori (Tukey y Duncan) para determinar diferencias estadísticas significativas (p < 0,05) en las muestras usando el paquete estadístico SPSS versión 12,0 (SPSS Inc, Estados Unidos).
Resultados y discusión
Características físicas y rendimiento comestible de las semillas
Las vainas del árbol de parota presentaron un peso promedio unitario de 18,6 g y contenían de 8–11 semillas, una forma de abanico y color café. Por otro lado, las semillas mostraron un peso promedio de 0,7 g (), un color de café claro a café oscuro, con una forma ovalada (), una testa lisa y dura. El rendimiento comestible de las vainas de parota fue de 205 g/kg y de las semillas del 420 g/kg (). Estos datos indican una alta cantidad de material lignocelulósico en la vaina y las semillas de parota, el cual puede ser aprovechado en alguna aplicación como la elaboración de compostas.
Rendimiento de extracción del almidón de parota y composición química
La semilla de parota sin testa presentó un rendimiento de almidón de 750 g/kg, el cual está en el intervalo reportado para otras semillas con las de la leguminosa Vigna radiate de 644 g/kg (semilla completa) y 755,5 g/kg (semilla sin testa) (Abdel-Rahman et al., Citation2008). Aguilar y Eckhoff (2007) reportaron valores de rendimiento de extracción (675,8 g/kg) inferiores para maíz amarillo dentado y, Serratos-Arévalo et al. (Citation2008) reportaron de igual modo valores inferiores, 631 g/kg de extracto libre de nitrógeno (ELN) para semillas enteras de parota y 546 g/kg en las almendras de la semilla. El ELN está compuesto primordialmente de carbohidratos, siendo el principal componente el almidón (Olvera-Novoa et al., Citation1993).
El análisis químico proximal del almidón de semillas de parota se muestra en la . El contenido de humedad fue de 69 g/kg, el cual se encuentra en el intervalo de humedad generalmente aceptado para productos secos en polvo (<150 g/kg) y es menor al valor sugerido (<200 g/kg) para otros almidones de fuentes convencionales como la papa (Wolfgang et al., Citation1999). Las proteínas y lípidos son componentes que en general están presentes en cantidades mínimas en el almidón. Las proteínas pueden ser proteínas de reserva de la semilla o proteínas que están asociadas al gránulo de almidón, como son las enzimas de su biosintesis (Baldwin, Citation2001). En el caso de lípidos, éstos pueden ser lípidos internos del gránulo, los cuales forman complejos con la amilosa (Morrison, Citation1995). El almidón de parota presentó contenidos de proteína y lípidos (35 g/kg y 12 g/kg base seca, respectivamente) significativamente mayores a los del almidón de maíz. La fuente botánica de donde se extrae el almidón es importante en la cantidad de estos componentes minoritarios que se encuentran en el polisacárido, lo cual puede ser importante en su aplicación.
Las cenizas fueron los componentes que se encontraron en menor proporción, siendo significativamente menor en el almidón de parota (1,5 g/kg). De acuerdo Beynum y Roels (1985), las cenizas en los almidones están compuestas principalmente por fósforo, sodio, potasio, magnesio y calcio. El calcio se encuentra en forma de grupos fosfato, los cuales se unen a la amilopectina y le confieren el carácter de polielectrólito.
Por otro lado, el almidón de parota mostró una pureza media (850 g almidón puro/kg almidón total). Jiménez-Hernández et al. (Citation2007) reportaron una pureza de 984 g/kg para almidón de tubérculos de chayote extraído con la misma técnica. Esto indica que la pureza y composición del almidón de parota extraído en este trabajo depende principalmente de la fuente botánica. Agama-Acevedo, et al. (Citation2005), reportaron un intervalo de pureza menor (662 a 792 g/kg) para el almidón aislado de variedades de maíces pigmentados (Zea mays L.).
En la se observa que el contenido de amilosa fue significativamente menor en almidón de parota y el contenido de amilopectina mayor en almidón de maíz; sin embargo, ambos almidones contienen valores similares a los reportados para cereales (Beynum y Roels, 1985). La relación de estos dos componentes del almidón es importante en las propiedades funcionales que imparten, ya que la amilosa es la responsable de la formación y estabilidad de los geles y la amilopectina de impartir viscosidad (Biliaderis, Citation1991).
Diferentes autores (Vanna et al., Citation2002; Abdel-Rahman et al., Citation2008; Antonio-Estrada et al., Citation2009) reportan valores similares para almidones provenientes de semillas de cereales, leguminosas, tubérculos y frutos. Asimismo, el valor de la relación amilosa/amilopectina del almidón de parota fue similar al del almidón de maíz, la cual fue <1, indicando una predominancia de amilopectina. Los almidones con un alto contenido de amilopectina pueden formar geles con una baja tendencia a la retrogradación (BeMiller, Citation1993).
Dispersiones del almidón de parota mostraron un valor de pH neutro (6,9), mientras que en el almidón de maíz fue ácido (5,06). Pérez et al. (Citation1997) reportan que pH altos favorecen el grado de ionización en las cadenas de amilosa y amilopectina, por lo cual se infiere que ambos almidones presentan un bajo grado de ionización. El grado de ionización afecta el comportamiento de hidratación de los almidones, ya que permite la interacción entre moléculas de agua y las cadenas de amilosa y amilopectina.
Morfología de los gránulos de almidón
Las micrografías de los gránulos de almidón de parota y maíz se muestran en la . La forma que presentan los gránulos del almidón de parota es redonda y oval, mientras que los del almidón de maíz tienen forma poligonal. Ambos almidones muestran gránulos con poros en su superficie. El tamaño promedio de los gránulos del almidón de parota fue mayor (25 μm) que en almidón de maíz (15 μm). El tamaño y forma del gránulo de almidón son herramientas taxonómicas importantes para identificar la fuente botánica de procedencia. Asimismo, el tamaño del gránulo también se utiliza para indicar posibles aplicaciones, por ejemplo aquellos con tamaños pequeños (<60 μm) pueden ser utilizados en la industria cosmética debido a su alta capacidad de absorción de agua o en sistemas alimentarios en donde se requiera incrementar el contenido de sólidos. Así también pueden ser utilizados como agentes encapsulantes para sabores, colorantes y esencias (Paredes-López et al., Citation1989). Por lo tanto, debido a su tamaño de gránulo (20–90 μm), el almidón de parota puede ser considerado como un biopolímero útil para dichas aplicaciones.
Propiedades de formación de pasta
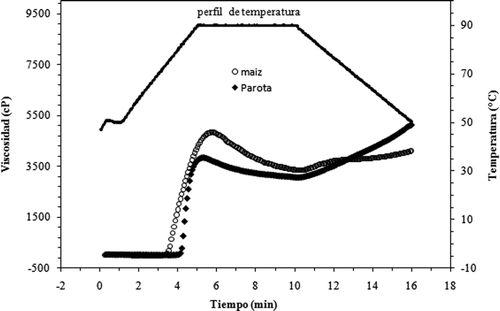
Las curvas de pasta de los almidones estudiados () fueron similares, destacándose el almidón de maíz por un mayor pico de viscosidad (). Los valores de temperatura de pasta (Tp) y el tiempo de pico (TP) fueron estadísticamente similares en ambas muestras de almidón (parota y maíz), lo que indica que ambos almidones requieren de temperatura y tiempos similares para alcanzar la máxima viscosidad. Sin embargo, el almidón de maíz desarrolló un pico de viscosidad (PV) significativamente mayor que el almidón de parota. Este comportamiento es debido a que los gránulos del almidón de maíz se hinchan en mayor proporción y más rápido que los del almidón de parota, lo cual está relacionado a una mayor cantidad de amilosa lixiviada a partir del gránulo, quedando mayor espacio para la entrada del agua y por lo tanto mayor hinchamiento. En el mismo sentido, la estructura de la amilopectina es importante ya que dependiendo de la longitud de sus cadenas puede interaccionar con mayor cantidad de agua y por lo tanto producir mayor hinchamiento y consecuentemente mayor viscosidad de pico. Otros factores importantes en las propiedades de pasta son la distribución de tamaño del gránulo y el contenido de proteínas. En almidón de parota, los gránulos mostraron un tamaño que oscila entre 10 a 30 μm, mientras que en almidón de maíz está entre 5 a 25 μm. Además, el almidón de parota presentó un mayor contenido de proteínas. Está reportado que diferencias en el contenido de proteínas pueden afectar las propiedades de formación de pasta (Ragaee et al., Citation2006). Estas características explican parcialmente por qué el almidón de maíz se hincha primero y desarrolla un pico de viscosidad mayor y más rápido que el almidón de parota.
La viscosidad final (VF) y la viscosidad retrasada (VRs) fueron mayores en el almidón de parota. Esta respuesta es debida a que durante el enfriamiento las moléculas de almidón se reasocian, especialmente las cadenas de amilosa, lo cual resulta en la formación de un gel y por lo tanto, un incremento en la viscosidad final. Esta fase es descrita como viscosidad retrasada (VRs), se relaciona con la retrogradación, sinéresis (Niba et al., Citation2001; Ragaee et al., Citation2006; Varavinit et al., Citation2003) y lixiviación de la amilosa (Jayakody et al., Citation2005). De acuerdo con algunos estudios (Ragaee et al., Citation2006; Jiménez-Hernández et al., Citation2007), existe relación entre los valores de viscosidad de rompimiento y viscosidad de pico, los cuales se relacionan también con el grado de hinchamiento de los gránulos durante el calentamiento del almidón. Los resultados encontrados para el almidón de maíz, con una mayor viscosidad de pico (4,84 Pa.s) y viscosidad de rompimiento (1,55 Pa.s) que el almidón de parota refuerzan esta tesis. Estos resultados sugieren que el almidón de maíz posee mejores propiedades como agente espesante que el almidón de parota.
Solubilidad y Factor de hinchamiento (FH)
La solubilidad y FH son dos propiedades que indican la cantidad de almidón seco disuelto en agua y el grado de hinchamiento de los gránulos individuales de almidón, respectivamente, en un proceso hidrotérmico; es decir, cuando los productos que contienen almidón son cocinados (BeMiller, Citation1993; Abdel-Rahman et al., Citation2008). En la se presenta el efecto de la temperatura sobre la solubilidad y el FH de los almidones estudiados. El almidón de parota presentó menores valores de solubilidad. En cuanto al factor de hinchamiento, ambas muestras de almidones mostraron valores similares hasta 60 °C, posteriormente el almidón de maíz alcanzó el máximo del FH a los 70 °C, mientras que el almidón de parota fue hasta 80 °C. Este comportamiento hidrotérmico está relacionado con algunos factores como la estabilidad el gránulo de almidón a la temperatura, distribución de tamaño, contenido de lípidos, contenido y longitud de cadena de amilosa y amilopectina (Beynum y Roels 1985; Crosbie, Citation1991). El almidón de maíz presentó menor contenido de lípidos y amilopectina y, menor tamaño de gránulo. Estas características permiten la interacción de los gránulos con las moléculas de agua con mayor libertad, en relación con los gránulos de almidón de parota y explican parcialmente por qué los gránulos de almidón de maíz se hinchan más rápido.
Propiedades térmicas
Los parámetros térmicos de los almidones estudiados son mostrados en la . El almidón de parota presentó un pico endotérmico (To a Tc), un intervalo de gelatinización (R) y una entalpía de gelatinización (Hgel) significativamente mayor que el del almidón de maíz. Estas diferencias se atribuyen parcialmente a la distribución de las cadenas de la amilopectina (Yuan et al., Citation1993). De acuerdo con Espinosa-Solis et al., (Citation2009), altas temperaturas y entalpías de gelatinización son debidas a la presencia de cadenas largas en la molécula de amilopectina, indicando un mayor arreglo de las dobles hélices. Por lo cual se infiere que el almidón de parota presenta cadenas de amilopectina de mayor tamaño que el almidón de maíz.
Los resultados de retrogradación se muestran en la . La retrogradación incrementó con el tiempo de almacenamiento, mostrando la misma tendencia ambos almidones a los dos tiempos evaluados, ya que los valores de entalpía fueron similares. Un valor similar de entalpía (5.4 J/g) se determinó en almidón de mango almacenado durante siete días (Espinosa-Solis et al., Citation2009). Sin embargo, el almidón de cebada nativo almacenado por siete días presentó una menor tendencia a la retrogradación (2.5 J/g) (Chavez-Murillo et al., Citation2008). Los valores de temperatura y entalpía de retrogradación de los almidónes de parota y maíz permiten inferir que los cristales formados durante el almacenamiento tienen estabilidad térmica, y que probablemente los formados en el almidón de parota al inicio del estudio fueron más pequeños o imperfectos ya que el intervalo de temperatura para desorganizarlos fue mayor que en el almidón de maíz (Gómez-Aldapa et al., Citation2009; Paredes-López et al., Citation1994).
Conclusiones
Las semillas de parota representan una fuente novedosa de almidón y atractiva al tener un rendimiento de extracción (750 g/kg) similar al reportado para semillas de leguminosas. El almidón extraído presentó una pureza media (850 g/kg), alto contenido de amilopectina (734 g/kg), un bajo grado de ionización (pH = 6,9) y gránulos con forma redonda a oval y un tamaño promedio (25 μm). Además, las propiedades de formación de pasta, la solubilidad y capacidad de hinchamiento del almidón de parota fueron inferiores a las del almidón de maíz. Estas características sugieren que puede ser utilizado en la formación de geles con baja tendencia a la retrogradación, o bien, como ingrediente de productos cosméticos debido a su tamaño de gránulo. Las propiedades térmicas mostradas por el almidón de parota permiten inferir que posee cadenas más largas de la molécula de amilopectina y un mayor arreglo de las dobles hélices que almidón de maíz, lo cual indica un mayor grado de estructuración de sus moléculas y por tanto requiere de mayor energía para iniciar la fusión. Dicha estructuración disminuyó en 40–50% después de siete días de almacenamiento en refrigeración para ambos almidones, lo cual refleja un incremento de zonas amorfas y una disminución de zonas cristalinas. Con base en estos resultados, almidón de parota puede ser utilizado para incrementar el contenido de sólidos y la viscosidad en sistemas alimentarios procesados mediante tratamientos térmicos. Sin embargo, hacen falta mayores estudios que demuestren la viabilidad de sus aplicaciones.
tcyt_a_474884_sup_19327661.pdf
Download PDF (371.5 KB)Agradecimientos
Los autores agradecen el apoyo técnico de Glenda Pacheco (CEPROBI-IPN), así como de Martínez-Alonso, U. y Moreno-Gatica, M.A. de la UACAA-UAGro,
Referencias
- Abdel-Rahman , E. A. , El-Fishawy , F. A. , El-Geddawy , M. A. , Kurz , T. and El-Rify , M. N. 2008 . Isolation and physico–chemical characterization of Mung bean starches . International Journal of Food Engineering , 4 ( 1 ) : 1 – 12 .
- Agama-Acevedo , E. , Ottenhof , M. A. , Farhat , I. A. , Paredes-López , O. , Ortíz-Cereceres , J. and Bello-Pérez , L. A. 2005 . Aislamiento y caracterización de almidón de maíces pigmentados . Agrociencia , 39 ( 4 ) : 419 – 429 .
- Aguilar , Z. E. and Eckhoff , S. R. 2007 . Proceso de molienda húmeda a nivel laboratorio de 100 g de maíz amarillo dentado . Revista de Ciencia y Tecnología , 13 : 80 – 81 .
- Álvarez-Morales , G. , Melgarejo-Velásquez , L. and Castañeda-Nieto , Y. 2003 . Ganancia de peso, conversión y eficiencia alimentaria en ovinos alimentados con fruto (semilla con vaina) de parota (Enterolobium cyclocarpum) y gallinaza . Veterinaria México , 34 ( 1 ) : 39 – 46 .
- Antonio-Estrada , C. , Bello-Pérez , L. A. , Martínez-Sánchez , C. E. , Montañez-Soto , J. L. , Jiménez-Hernández , J. and Vivar-Vera , M. A. 2009 . Producción enzimática de maltodextrinas a partir de almidón de malanga (Colocasia esculenta) . CyTA – Journal of Food , 7 ( 3 ) : 233 – 241 .
- AOAC. 1997 . Official methods of analysis , 15th ed , USA : Association of Official Analytical Chemists .
- Baldwin , P. M. 2001 . Starch granule-associated proteins and polypeptides: A review . Starch/Starke , 53 : 475 – 503 .
- BeMiller , J. N. 1993 . “ Starch-based gums ” . In Industrial gums , Edited by: Whistler , R. L. and BeMiller , J. N. 579 – 600 . USA : Academic Press .
- Beynum , G. M.A. and Roels , J. A. 1985 . Starch conversion technology. Ed , New York, , USA : Marcel-Dekker .
- Biliaderis , C. G. 1991 . The structure and interactions of starch with food constituents . Canadian Journal of Physiology and Pharmacology , 69 : 60 – 78 .
- Camacho , M. P. 1981 . Ensayos de adaptabilidad y rendimiento de especies forestales en Costa Rica , Costa Rica : Cartago, ITCR/MAG .
- Cecconello , C. G. , Benezra , S. M. and Obispo , E. N. 2003 . Composición química y degradabilidad ruminal de los frutos de algunas especies forrajeras leñosas de un bosque seco tropical . Zootecnia Tropical , 21 ( 2 ) : 149 – 165 .
- Chavez-Murillo , C. , Wang , Y. J. and Bello-Perez , L. A. 2008 . Morphological, physicochemical and structural characteristics of oxidized barley and corn starches . Starch/Starke , 60 : 634 – 645 .
- Crosbie , G. B. 1991 . The relationship between starch swelling properties, paste viscosity and boiled noodle quality in wheat flours . Journal of Cereal Science , 13 : 145 – 150 .
- Duarte , A. P. 1978 . Contribuição ao conhecimento da germinação de algumas essências florestais . Rodriguésia , 30 ( 45 ) : 439 – 446 .
- Espinosa-Solis , V. , Jane , J. L. and Bello-Perez , L. A. 2009 . Physicochemical characteristics of starches from unripe fruits of mango and banana . Starch/Starke , 61 : 291 – 299 .
- Gómez-Aldapa , C. A. , Hernández-Hernández , E. , Avila-Orta , C. A. , Hsiao , B. S. , Castro Rosas , J. , Gordillo-Martínez , A. J. and González-Ramírez , C. A. 2009 . Influencia de la L-α-lisofosfatidil colina sobre las propiedades térmicas y estructurales del almidón de maíz . CyTA – Journal of Food , 7 ( 1 ) : 37 – 43 .
- Gómez , P. A. 1985 . Los recursos bióticos de México , México : INIREB-Alhambra .
- González , C. 1984 . Especies vegetales de importancia económica en México , México : Porrúa .
- Guízar-Miranda , A. , Montañez-Soto , J. L. and García-Ruíz , I. 2008 . Parcial caracterización de nuevos almidones obtenidos del tubérculo de camote del cerro (Dioscorea spp) . Rev. Iberoamericana de Tecnología. Postcosecha , 9 ( 1 ) : 81 – 88 .
- Henríquez , C. , Escobar , B. , Figuerola , F. , Chiffelle , I. , Speisky , H. and Estévez , A. M. 2008 . Characterization of piñon seed (Araucaria araucana (Mol) K. Koch) and the isolated starch from the seed . Food Chemistry , 107 ( 2 ) : 592 – 601 .
- Holdridge , L. R. , Poveda , L. J. and Jiménez , Q. 1997 . Árboles de costa rica , Costa Rica : Centro Científico Tropical .
- Jayakody , L. , Hoover , R. , Liu , Q. and Weber , E. 2005 . Studies on tuber and root starches. I. Structure and physicochemical properties of innala (Solestemon rotundifolius) starches grown in Sri Lanka . Food Research International , 38 : 615 – 629 .
- Jiménez-Hernández , J. , Salazar-Montoya , J. A. and Ramos-Ramírez , E. G. 2007 . Physical, chemical and microscopic characterization of a new starch from chayote (Sechium edule) tuber and its comparison with potato and maize starches . Carbohydrate Polymers , 68 ( 4 ) : 679 – 686 .
- McGrance , S. J. , Cornell , H. J. and Rix , C. J. 1998 . A simple and rapid colorimetric method for the determination of amylose in starch products . Starch , 50 ( 4 ) : 158 – 163 .
- Morrison , W. R. 1995 . Starch lipids and how they related to starch granule structure and functionality . Cereal Foods World , 40 : 437 – 446 .
- Niba , L. , Bokanga , M. M. , Jackson , F. L. , Schlimme , D. S. and Li , B. W. 2001 . Physicochemical properties and starch granular characteristics of flour from various Manihot esculenta (Cassava) genotypes . Journal of Food Science , 67 ( 5 ) : 1701 – 1705 .
- Olvera-Novoa , M. A. , Martínez-Palacios , C. A. and Real-de Leon , E. 1993 . Manual de técnicas para laboratorio de nutrición de peces y crustáceos , México : FAO .
- Paredes-López , O. , Bello-Pérez , L. A. and López , M. G. 1994 . Amylopectin: Structural gelatinization and retrogradation studies . Food Chemistry , 50 : 411 – 418 .
- Paredes-López , O. , Shevenin , M. L. , Hernández-López , D. and Carabez-Trejo , A. 1989 . Amaranth starch-isolation and partial characterization . Starch , 41 : 205 – 207 .
- Pennington , T. and Sarukhan , K. 1993 . Árboles tropicales de México: Manual para la identificación de campo de las principales especies , México : UNAM/FCE .
- Pérez , E. , Lares , M. and González , Z. 1997 . Some characteristics of Sagu (Canna edulis Kerr) and Zulu (Maranta sp.) rhizomes . Journal of Agriculture Food Chemistry , 45 ( 7 ) : 2546 – 2549 .
- Ragaee , S. , El-Sayed , M. and Abdel-Aal . 2006 . Pasting properties of starch and protein in selected cereals and quality of their food products . Food Chemistry , 95 : 9 – 18 .
- Rose , R. , Rose , C. L. , Omi , S. K. , Forry , K. R. , Durall , D. M. and Bigg , W. L. 1991 . Starch determination by perchloric acid vs enzymes: Evaluating the accuracy and precision of six colorimetric methods . Journal of Agriculture Food Chemistry , 39 : 2 – 11 .
- Rzedowski , D. 1986 . La vegetación de México , México : Limusa .
- Serratos-Arévalo , J. C. , Carreón-Amaya , J. , Castañeda-Vázquez , H. , Garzón-De la Mora , P. and García-Estrada , J. 2008 . Composición químico nutricional y de factores antinutricionales en semillas de parota . Interciencia , 33 ( 11 ) : 850 – 854 .
- Tejeda , L. 1992 . The thermal decomposition of carbohydrates. II. The descomposition of fiber . Chemistry Biochemistry , 47 : 279 – 393 .
- Vanna , T. , Kanitha , T. , Prapa , S. and Nongnuj , J. 2002 . Some physicochemical properties of jackfruit (Artocarpus heterophyllus Lam) seed flour and starch . Science Asia , 28 : 37 – 41 .
- Varavinit , S. , Shobsngob , S. , Varanyanond , W. , Chinachoti , P. and Naivikul , O. 2003 . Effect of amylose content on gelatinization, retrogradation and pasting properties of flours from different cultivars of Thai rice . Starch , 55 : 410 – 415 .
- Vásquez-Yanes , C. and Pérez-García , B. 1977 . Notas sobre la morfología, la anatomía de la testa y la fisiología de las semillas de Enterolobium cyclocarpum . Turrialba , 27 ( 4 ) : 427 – 430 .
- Wolfgang , B. , Detmold , W. and Hans-Peter , G. 1999 . Potato starch technology . Starch , 51 : 235 – 242 .
- Yuan , R. C. , Thompson , D. B. and Boyer , C. D. 1993 . The fine structure of amylopectin in relation to gelatinization and retro- gradation behavior of maize starches from three wax-contaning genotypes in two inbred lines . Cereal Chemistry , 70 : 81 – 89 .
Material complementario
El material complementario para este artículo está disponible en linea en http://dx.doi.org/10.1080/19476331003743626.
Figura adicional 1. Vaina (A) y semillas (B) del árbol de parota (Enterolobium cyclocarpum).
Supplementar y Figure 1. Pods (A) and seeds (B) from parota (Enterolobium cyclocarpum) tree.

Figura adicional 2. Microfotografías electrónicas de barrido (MEB) de almidón de semillas de Parota (A) y maíz (B) (×1000).
Supplementary Figure 2. Scanning electronic micrographs of parota seed (A) and corn (B) starches (×1000).
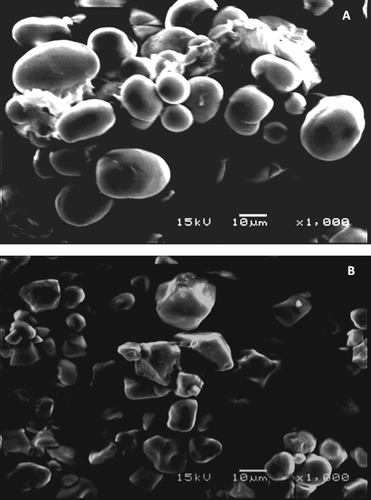
Figura adicional 3. Curvas de pasta del almidón de semilla de parota y maíz.
Supplementary Figure 3. Pasting curves of starch from parota seed starch.