Abstract
Stevia rebaudiana Bertoni is a plant used in the food industry as a sweetener but is also empirically used for the treatment of diabetes. The scientific literature has reported anticariogenic, antineoplastic, antihypertensive, anti-inflammatory and antihyperglycemic effects, among which the antihyperglycemic effect is the most reported. The aim of this study was to conduct a systematic review on those reported of the Stevia rebaudiana extract or components for potential diabetes treatments. Studies in vivo and in vitro indicate that the plant extract and a compound that is steviol-derived, stevioside, possess antihyperglycemic effect and their mechanisms of action is through suppression of gluconeogenesis (plant extract) and increased insulin secretion (plant extract and stevioside); rebaudioside A increases insulin secretion exclusively in vitro and with high concentrations of glucose.
La Stevia rebaudiana Bertoni es una planta utilizada en la industria alimentaria como edulcorante pero también empíricamente para el tratamiento de la diabetes. La literatura científica ha reportado que posee efecto anticariogénico, antineoplásico, antihipertensivo, antiinflamatorio y antihiperglucémico, entre los que destaca este último por los numerosos estudios al respecto. Este trabajo tiene como objetivo presentar una revisión sistemática del potencial de los extractos y componentes de Stevia rebaudiana para el tratamiento de la diabetes mellitus. Los estudios realizados in vitro e in vivo, señalan que el extracto de la planta y un compuesto derivado de esteviol, el esteviósido, poseen efecto antihiperglucemiante y que los mecanismos de acción son la supresión de la gluconeogénesis (extracto de la planta) y aumento en la secreción de insulina (extracto de la planta y esteviósido); el rebaudiósido A sólo incrementa la secreción de insulina exclusivamente in vitro con concentraciones elevadas de glucosa.
Palabras clave: Diabetes; Stevia rebaudiana; Esteviósido; Rebaudiósido A
1. Introducción
La diabetes mellitus es un conjunto de enfermedades metabólicas cuyo tratamiento a través de un equipo interdiscipliario de salud, tiene como objetivo central, lograr los niveles recomendados de control glucémico medido como hemoglobina glucosilada (Alc) < 7% a través de modificaciones en la dieta, aumento en el ejercicio y tratamiento farmacológico, entre los que se encuentran biguanidas, sulfonilureas, glinidas, inhibidores de α-glucosidasa, tiazolidinedionas, insulina y agonistas de péptido similar a glucagon (GLP-1) (ADA, Citation2010a). Sin embargo, el uso de plantas medicinales para el control de la enfermedad, es un fenómeno bastante difundido y sólo en México se han reportado más de 260 especies de plantas que se utilizan para este fin (Hernandez-Galicia et al., Citation2002). Entre las plantas que se utilizan para el control de esta enfermedad se encuentra la Stevia rebaudiana Bertoni, cuyos glucósidos derivados de esteviol son los responsables del sabor dulce de la planta y a los que se les atribuyen los efectos medicinales (Chaturvedula, Upreti, & Prakash, Citation2011). Dado el aumento en el uso de esta planta por la industria alimentaria y a la disponibilidad de suplementos alimentarios de la misma que aluden a estas propiedades medicinales, se realizó una revisión sistemática de los estudios realizados con extractos de la planta y dos de los principales glucósidos derivados de esteviol presentes en ella: esteviósido y rebaudiósido A, clasificando los estudios en in vitro, in vivo en modelos animales o clínicos en humanos.
2. Definición de diabetes
La diabetes es un grupo de enfermedades metabólicas caracterizadas por hiperglicemia, producto de defectos en la secreción de insulina, acción de la insulina, o ambos (ADA, Citation2010b). Según la Asociación Americana de la Diabetes (ADA), la diabetes clínicamente se divide en 4 tipos: Tipo 1 (que resulta de la destrucción de las células β y usualmente lleva a la deficiencia absoluta de insulina), Tipo 2 (resultado de un defecto progresivo en la secreción de insulina acompañado de resistencia a la insulina), diabetes mellitus gestacional que es la que se diagnostica durante el embarazo y otros tipos específicos de diabetes ocasionados por causas diversas por ejemplo: defecto genético de las células β o de la acción de la insulina, enfermedad del páncreas exócrino (por ejemplo fibrosis cística) y diabetes producida por fármacos, como los empleados para el tratamiento del SIDA o después del transplante de un órgano (ADA, Citation2010a).
2.1. Diagnóstico de la diabetes
Según la Asociación Americana de Diabetes, el diagnóstico de la diabetes puede hacerse con cuatro diferentes criterios de medición de glucosa (Tabla ).
Tabla 1. Criterios para el diagnóstico de la diabetes según la ADA (Citation2010b).
Criteria for diagnosis of diabetes according to the ADA (Citation2010b).
2.2. Prevención y tratamiento de la diabetes
Las recomendaciones que establece la Asociación Americana de la Diabetes (2010) para prevenir o retardar la aparición de esta enfermedad son: en pacientes con intolerancia a la glucosa, intolerancia a la glucosa en ayuno o hemoglobina glucosilada de 5.7–6.4% deberán ser referidos a un programa dirigido a perder 5–10% de peso y realizar actividad física moderada al menos 150 min/semana, adicionalmente a los cambios en estilo de vida, se podrá considerar el uso de la metformina en aquellos pacientes considerados en alto riesgo de desarrollar diabetes, es decir si además de la intolerancia a la glucosa tienen hemoglobina glucosilada ≥ 6%, hipertensión, colesterol de alta densidad (HDL) disminuido, hipertrigliceridemia, historia familiar de primer grado de diabetes, así como a quienes son obesos y menores de 60 años (ADA, Citation2010b).
Las personas con diabetes deberán recibir tratamiento médico en coordinación con un equipo interdisciplinario de salud. Este equipo deberá incluir, pero no está limitado a un médico, enfermero, nutricionista, experto en salud mental y cualquier profesional del área de la salud con experiencia en el manejo de la diabetes.
La terapia para el tratamiento de la diabetes recomendada por la ADA fue publicada en 1972 y con una actualización en 2009 (Nathan et al., Citation2009). Estos organismos indican que la intervención deberá incluir metformina al momento del diagnóstico de la enfermedad, en combinación con cambios de estilo de vida (dieta y ejercicio) y aumentar (a lo largo del tiempo) otros agentes adicionales (incluyendo tratamiento temprano con insulina), como medios para lograr los niveles recomendados de control glucémico (A1c < 7%). El objetivo general es lograr y mantener el control glicémico y se deberá cambiar la intervención cuando los objetivos terapéuticos no se estén logrando. No se establecen drogas precisas y la secuencia de su uso ya que no se considera tan importante como lo es lograr y mantener el control glucémico.
Los fármacos disponibles para el control glucémico de la diabetes son: biguanidas, sulfonilureas, glinidas, inhibidores de α-glucosidasa, tiazolidinedionas, insulina y agonistas de péptido similar a glucagon (GLP-1) (Bolen et al., Citation2007; Nathan et al., Citation2006; Phillips & Twigg, Citation2010).
Sin embargo, adicional al tratamiento farmacológico muchas personas utilizan la medicina tradicional, entre las que destacan más de 1000 plantas que se afirma tienen un efecto benéfico sobre la diabetes (Day, Citation2005). La revision efectuada por Hernandez-Galicia et al. (Citation2002) acerca de la actividad hipoglucémica de plantas medicinales Mexicanas, demostró que son más de 260 especies de plantas las que se utilizan de manera empírica para el control de esta enfermedad, entre las cuales destacan las familias Asteraceae y Fabaceae.
3. Stevia rebaudiana Bertoni
Un género de planta perteneciente a la familia de las Asteráceas es Stevia, la cual es nativa de regiones subtropicales y tropicales de Sudamérica y Centroamérica. Dentro de las 407 especies, la Stevia rebaudiana Bertoni (Figura ), nombrada así por Moisés de Santiago Bertoni y conocida en guaraní como ka’a he’ẽ (‘hierba dulce’), tiene poder edulcorante (Goyal, Samsher, & Goyal, Citation2009).
Es esta capacidad edulcorante la que ha captado la atención de la industria alimentaria, dado que en Citation2008 la Food and Drug Administration (FDA) en Estados Unidos otorgó el estatus de ‘generalmente reconocido como seguro’ (GRAS, por sus siglas en inglés) al rebaudiósido A para usarse como edulcorante (FDA, Citation2008) y en ese mismo año el Comité de Expertos en Alimentación FAO/OMS en aditivos alimentarios (JECFA) y Estándares de alimentación de Australia y Nueva Zelanda (FSANZ) establecieron el consumo diario aceptable (ADI por sus siglas en inglés) de 0–4 mg/kg de peso corporal/día (FDA, Citation2008).
3.1. Estructura química de los glucósidos de esteviol
Los compuestos responsables de la propiedad edulcorante de la planta, son los glucósidos diterpenos esteviósido, rebaudiósido A, C y D, así como dulcósido. Estos compuestos son glucósidos derivados del diterpeno esteviol, los cuales se forman reemplazando el átomo de hidrógeno carboxilo con combinaciones de glucosa, xilosa y ramnosa para formar un éter (Chaturvedula et al., Citation2011). El esteviol tiene dos grupos hidroxilo, uno unido al carbono 19 (C-19) y otro unido al carbono 13 (C-13), los cuales pueden ser glucosilados (Figura ).
Figura 2. Chemical Structure of the aglycone of stevioside.
Estructura química de la aglicona de esteviósidos.
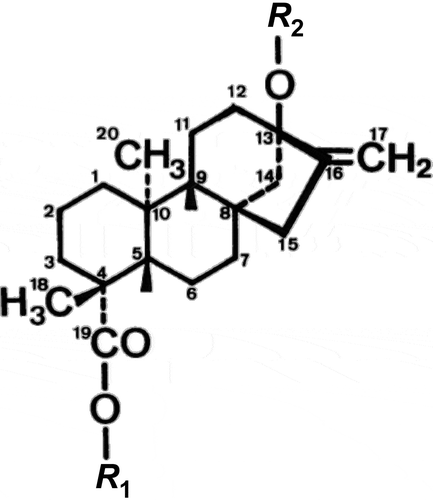
El Comité Mixto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA), ha identificado y caracterizado nueve compuestos derivados de esteviol (JECFA, Citation2010) y son los que se presentan en la Tabla .
Tabla 2. Fórmula, peso molecular y número CAS de glucósidos diterpenos derivados de esteviol.
Formula, molecular weight and number of CAS steviol glycosides derivatives diterpenes.
3.2. Distribución de glucósidos de esteviol presentes en la planta
En las variedades generalmente cultivadas los principales compuestos glucósidos de esteviol son cuatro: esteviósido, rebaudiósido A, dulcósido y rebaudiósido C, entre los cuales destacan en cantidad los primeros dos. El esteviósido (4–13% en peso seco) es 250–300 veces más dulce que el azúcar aunque con un sabor ligeramente amargo, mientras que el Rebaudiósido A (2–4% en peso seco) tiene mayor capacidad edulcorante (350–450 veces más que el azúcar) y sin resabio amargo (Goyal et al., Citation2009; WHO, Citation2006). En menor cantidad, se pueden encontrar el rebaudiósido C (1–2%) y dulcósido A (0.4–0.7%), junto con estevolbiósido, rubusósido, rebaudiósido B, D, E y F (<0,4% cada uno de ellos) (Goyal et al., Citation2009; Jackson et al., Citation2009; Woelwer-Rieck, Lankes, Wawrzun, & Wüst, Citation2010). Todos estos compuestos glucósidos de esteviol tienen en mayor o menor medida, sabor dulce y se ha concluido que esta capacidad edulcorante depende si en el Carbono 13 ó 19 hay una unidad de azúcar o grupo carboxilo (Brandle & Telmer, Citation2007).
Sin embargo, la proporción de dulcósidos son susceptibles de modificarse por ciertos factores, como son la variedad de Stevia así como las condiciones climáticas y de siembra. Existen variedades de Stevia cuya composición de esteviósidos es distinta a las variedades generalmente cultivadas, como es el caso de una variedad que no contiene Rebaudiósido A ni Rebaudiósido C, otra donde el principal componente es Rebaudiósido C (Brandle, Citation1999) y otra que fue mejorada para tener 2,5 veces más Rebaudiósido A que esteviósido (Morita & Bu, Citation2000). Además, una misma variedad puede tener mayor cantidad de glucósidos si son expuestos a mayor radiación solar o con una densidad de 12,5 a 25 plantas por cada metro cuadrado (Jarma-Orozco, Araméndiz-Tatis, & Cleves-Leguízamo, Citation2011).
3.3. Otros usos de la planta Stevia rebaudiana Bertoni
Además de su uso como edulcorante, la planta o sus derivados se utilizan en varios países incluyendo Japón, China, Rusia, Korea, Paraguay, Ecuador, Argentina, Indonesia, Malasia, Australia, Nueva Zelanda y México como tratamiento para la hipertensión, obesidad o alteraciones en la piel (Brahmachari, Mandal, Roy, Mondal, & Brahmachari, Citation2011). Al respecto, se han reportado propiedades biológicas importantes de la planta Stevia rebaudiana, entre las que destacan su capacidad anticariogénica (Das et al., Citation1992), antineoplásica (Mizushina et al., Citation2005), antihiperglucémica (Curi et al., Citation1986; Gregersen, Jeppesen, Holst, & Hermansen, Citation2004; Jeppesen, Gregersen, Alstrup, & Hermansen, Citation2002; Lailerd, Saengsirisuwan, Sloniger, Toskulkao, & Henriksen, Citation2004; Raskovic, Gavrilovic, Jakovljevic, & Sabo, Citation2004; Raskovic, Jakovljevic, Mikov, & Gavrilovic, Citation2004), antihipertensiva (Chan et al., Citation1998, Citation2000; Hsu et al., Citation2002; Lee et al., Citation2001; Maki et al., Citation2008) y antiinflamatoria (Mizushina et al., Citation2005; Yasukawa, Kitanaka, & Seo, Citation2002).
3.4. Farmacocinética de los compuestos de Stevia rebaudiana Bertoni
3.4.1. Absorción
En ratas, cerdos y en el ser humano, las enzimas digestivas no pueden degradar el esteviósido o rebaudiósido A en esteviol (Hutapea, Toskulkao, Buddhasukh, Wilairat, & Glinsukon, Citation1997; Wingard et al., Citation1980) sin embargo, la flora bacteriana (particularmente la familia bacteoidaceae) presente en el ciego sí puede hacerlo, removiendo unidades de glucosa sucesivamente, por lo que la hidrólisis de rebaudiosido A en esteviol es más lenta que la del esteviósido (Koyama et al., Citation2003).
3.4.2. Distribución
Mediante la técnica de esteviósido marcado radioactivamente, se pudo determinar la farmacocinética del esteviósido después de la administración de 125 mg/kg en ratas Wistar machos (Nakayama, Kasahara, & Yamamoto, Citation1986). En este experimento se encontró que el nivel máximo de radioactividad se alcanzó a las 8 horas posteriores a la administración intravenosa de [3H]-esteviósido y que el periodo de vida media de eliminación fue de 24 horas. En otro estudio, igual con esteviósido radioactivo, se encontró que los órganos donde se halló radioactividad fueron intestino, riñones e hígado, donde destaca este último ya que 120 minutos después de la inyección se encontró 52% de la dosis inyectada en la bilis (Cardoso, Barbosa, Muramoto, Mesquita, & Almeida, Citation1996). El análisis de orina no reveló la presencia de esteviósido.
3.4.3. Metabolismo
Después de la ingestión oral del esteviósido, el esteviol es el principal metabolito que se ha encontrado en la circulación sanguínea por lo que se ha puesto especial atención a su metabolismo en el hígado. Estudios con preparaciones microsomales de hígado indican que el esteviol tiene un metabolismo de fase I vía citocromo P450 (WHO, Citation2006). Sin embargo, en un estudio cruzado, del tipo aleatorio doble ciego, en 8 individuos varones que recibieron rebaudiósido A (5 mg/Kg de peso corporal) o esteviósido (4,2 mg/Kg de peso corporal) vía oral se encontró que el máximo de concentración en plasma se alcanzó tras 8 ó 12 horas de administración y la mayor parte del esteviol fue encontrado en forma de conjugados glucurónidos (62% de la dosis), por lo que parece que además de la fase I del metabolismo, el esteviol se somete a la fase II, en la cual la mayor parte del esteviol es conjugado como glucorónido antes de ser eliminado mediante la orina (Wheeler et al., Citation2008).
3.4.4. Excreción
Las principales rutas de excreción del esteviol glucurónido parecen ser los tractos biliar y urinario, aunque con diferencias si se trata de humanos o ratas. En ratas, la principal ruta de excreción es por vía biliar en heces (Nakayama et al., Citation1986; Roberts & Renwick, Citation2008; Wingard et al., Citation1980), mientras que en humanos parece ser que la principal vía de eliminación es a través de la orina vía la conjugación con glucuronido y/o sulfato (Geuns, Buyse, Vankeirsbilck, & Temme, Citation2007).
3.5. Seguridad: toxicidad, carcinogénesis y teratogénesis
Varios estudios han evaluado la toxicidad de derivados de estevia, particularmente esteviósido, rebaudiósido A y esteviol, tras lo cual se ha reportado que ni vivo in ni in vitro tienen efecto genotóxico (FDA, Citation2008), así como ningún efecto adverso sobre la fertilidad en ratas en dosis de hasta 2,400 mg/kg de peso/día (FDA, Citation2008).
3.5.1. Toxicidad
En modelos animales murinos, con un consumo de esteviósido de hasta 15 g/kg de peso no reportó toxicidad aguda (Toskulkao, Chaturat, Temcharoen, & Glinsukon, Citation1997), aunque se ha calculado la dosis letal media (DL50) de 5–20 g/kg, dependiendo de la especie animal donde los hámsters son más susceptibles que las ratas o ratones y cuya causa de muerte es un fallo renal agudo medido por nitrógeno en urea y creatinina (Toskulkao et al., Citation1997).
3.5.2. Carcinogénesis
El potencial carcinogénico ha sido evaluado in vitro e in vivo. En el primer caso, se han realizado análisis bacterianos y estudios con linfocitos humanos; varios estudios genéticos bacterianos demuestran que el esteviósido en su forma nativa no es mutagénico (Matsui et al., Citation1996; Pezzuto, Compadre, Swanson, Nanayakkara, & Kinghorn, Citation1985; Pezzuto et al., Citation1986), mientras que en linfocitos no se encontraron alteraciones cromosómicas después de la exposición a esteviósido o esteviol (Suttajit, Vinitketkaumnuen, Meevatee, & Buddhasukh, Citation1993).
Las pruebas in vivo que se han llevado al cabo en ratas (Hagiwara, Fukushima, & Kitaori, Citation1984; Toyoda et al., 1997) y ratones (Matsui et al., Citation1996) no han demostrado evidencias de carcinogénesis.
3.5.3. Fertilidad y evaluación teratogénica.
Un estudio publicó disminución en el ritmo de nacimiento de ratas tratadas con esteviósido (Planas & Kucacute, Citation1968) lo que aumentó la preocupación sobre los posibles efectos sobre la fertilidad y teratogénesis; sin embargo estos resultados no pudieron ser reproducidos (Shiotsu, Citation1996), y por el contrario varios estudios en animales han demostrado que el esteviósido vía oral no tiene efecto sobre la fertilidad en roedores (Akashi & Yokoyama, Citation1975; Wasuntarawat et al., Citation1998; Yodyingyuad & Bunyawong, Citation1991).
Por otra parte, la administración de extracto de Stevia a dosis elevadas (2,6 g/día) durante 2 meses las ratas tienen un descenso en la fertilidad, aunque pudiera deberse a otros componentes tóxicos – diferentes a esteviósido- presentes en el extracto (Melis, Citation1999).
Lo anterior sugiere que el esteviósido es seguro y no carcinogénico o teratogénico.
3.6. Efecto antihiperglucemiante e hipoglucemiante
El estudio de los efectos del extracto total de S. rebaudiana o sus glucósidos principales sobre la glucosa sanguínea se han efectuado desde dos perspectivas principales: evaluar el efecto hipoglucemiante (si actúan descendiendo los niveles de glucosa) y antihiperglucemiante (si impiden el ascenso de los niveles de glucosa inducido por algún agente, como por ejemplo: adrenalina, glucagon, aloxano o carga de glucosa). Considerando lo anterior, algunos estudios han reportado que el extracto de S. rebaudiana y el esteviósido tienen efecto antihiperglucemiante, tanto en modelos animales (Jeppesen et al., Citation2002; Kujur et al., Citation2010; Lailerd et al., Citation2004; Misra et al., Citation2011; Raskovic, Gavrilovic et al., Citation2004; Raskovic, Jakovljevic, et al., Citation2004) como en humanos (Curi et al., Citation1986; Gregersen et al., Citation2004), así como también efecto hipoglucemiante en ratas (Raskovic et al., Citation2008); por otra parte, el Rebaudiósido A, tanto en modelos animales como en humanos ha demostrado no tener efecto sobre la glucosa sanguínea.
(1) Extractos de Stevia rebaudiana
A la fecha se han reportado 4 estudios en modelos animales con extractos de S. rebaudiana que contienen una mezcla de glucósidos, se demostró el efecto antihiperglucémico e hipoglucémico en diferentes modelos animales (ratón sano o ratas con diabetes inducida), tipos de extractos, dosis (50–400 mg/kg), vías de administración (oral o intraperitoneal) y duración del experimento (4 a 28 días) (Tabla ).
En humanos, el primer y único reporte que hay sobre el efecto del extracto de S. rebaudiana fue reportado por Curi et al. (Citation1986), donde personas sanas ingirieron una infusión elaborada con 5 hojas de la planta, durante 3 días y con intervalos de 6 horas. Posterior a esto, se realizó una prueba de tolerancia oral a la glucosa y aquellos que ingirieron previamente la infusión tuvieron menor incremento de glucosa en la prueba (Curi et al., Citation1986).
Tabla 3. Estudios efectuados sobre el efecto antihiperglucemiante e hipoglucemiante de extractos de Stevia rebaudiana.
Studies on the antihyperglycemic and hypoglycemic effect of Stevia rebaudiana extracts.
(2) Esteviósido
Respecto a este derivado de esteviol, es sobre el cual existe más literatura sobre sus efectos en la glucosa sanguínea en modelos animales. De los 6 estudios encontrados, 3 pertenecen al mismo grupo de investigación (Jeppesen et al., Citation2002), donde emplearon ratas no obesas pero con diabetes tipo 2, Goto-Kakizaki (GK) a las cuales administraron esteviósido por diferentes periodos de tiempo y posteriormente realizaron una prueba de tolerancia intra-arterial a la glucosa (2 g/kg) y encontraron los mismos resultados: efecto antihiperglucémico, dado por incremento en la producción de insulina y disminución de glucagon (Jeppesen et al., Citation2002, Citation2003; Jeppesen et al., Citation2006) (Tabla ). Los otros 3 estudios donde también evaluaron el efecto del esteviósido, también reportaron efecto antihiperglucemiante cuando se administró vía oral y, sólo se encontró efecto hipoglucemiante si la vía de administración fue subcutánea (Raskovic et al., Citation2008). Cabe destacar que el efecto antihiperglucemiante del esteviósido se presenta desde dosis de 5 mg/kg hasta 200 mg/kg e independientemente de la vía de administración (oral e intravenosa), más aún los resultados indican que el mecanismo de acción es aumentar la producción de insulina (Jeppesen et al., Citation2002, Citation2003; Jeppesen et al., Citation2006; Raskovic et al., Citation2008), disminuir la de glucagon (Jeppesen et al., Citation2002, Citation2003; Jeppesen et al., Citation2006) y disminuir la resistencia a la insulina (Chang, Wu, Liu, & Cheng, Citation2005) (Tabla ).
Tabla 4. Estudios efectuados sobre el efecto antihiperglucemiante e hipoglucemiante de esteviósido.
Studies on the antihyperglycemic and hypoglycemic effect of stevioside.
En humanos, sólo se ha realizado un estudio clínico, pareado y cruzado con 12 personas con diabetes tipo 2 (6 ± 1 año duración) a los cuales se les proporcionó un desayuno estándar con o sin 1 g de esteviósido encapsulado y posteriormente se midió la glucosa posprandial y se encontró que la administración de esteviósido redujo la glucosa posprandial de manera significativa y en un 18% (Gregersen et al., Citation2004).
(3) Rebaudiósido A
En el caso del rebaudiósido A, sólo se ha realizado un estudio en un modelo animal por el mismo departamento de Endocrinología y Metabolismo al que pertenecen Jeppesen et al. (Citation2002) y un estudio clínico en humanos. En ambos casos, y aún utilizando las mismas dosis que se ha reportado efecto para el esteviósido, no hubo efecto alguno del rebaudiósido A sobre la glucosa sanguínea.
El estudio de Dyrskog, Jeppesen, Chen, Christensen, and Hermansen (Citation2005), realizado en el departamento de Endocrinología y Metabolismo del Hospital de la Universidad Aarhus, Dinamarca fue realizado en el mismo modelo animal (Ratas Goto-Kakizaki) y dosis que ellos emplearon para estudiar el esteviósido; en este trabajo a los animales se les administró 25 mg/kg de rebaudiósido A durante 8 semanas y posteriormente se realizó una prueba de tolerancia intra-arterial a la glucosa donde el rebaudiósido A mostró no tener efecto antihiperglucémico, así como efecto nulo sobre el glucagon o la insulina producida (Dyrskog et al., Citation2005).
Por otra parte, el estudio clínico fue realizado con personas con diabetes tipo 2 (≥1 año duración), índice de masa corporal (IMC) 25–45 mg/m2 a las cuales se les proporcionó 1 g de rebaudiósido A durante 16 semanas y posteriormente se evaluaron glucosa en ayuno, insulina, péptido C y hemoglobina glucosilada (A1c) aunque sin diferencias significativas en ninguna de las variables estudiadas (Maki et al., Citation2008).
Los estudios anteriores sugieren que tanto el extracto de Stevia rebaudiana que contiene la mezcla de todos los glucósidos, como el esteviósido – pero no el rebaudiósido A- poseen principalmente efecto antihiperglucemiante que hipoglucemiante.
A pesar de que existen otros glucósidos de esteviol e incluso están presentes en otra proporción en ciertas variedades de Stevia (Brandle, Citation1999), no existen estudios sobre si éstos poseen –al igual que el esteviósido- efecto antihiperglucemiante o hipoglucemiante.
3.7. Modos de acción antidiabéticos identificados
Respecto a los modos de acción que expliquen la capacidad del extracto de Stevia o los glucósidos de esteviol de disminuir la glucosa sanguínea, se han identificado cuando menos dos: insulinotrópico e inhibición de la gluconeogénesis.
Previo a los estudios in vivo de Jeppesen et al. (Citation2002), este grupo de investigación, había evaluado el efecto in vitro del esteviósido y esteviol sobre la producción de insulina, utilizando para ello células β murinas e islotes pancreáticos INS-1. Los resultados obtenidos manifestaron que tanto el esteviósido como el esteviol incrementaron la producción de insulina de manera dosis dependiente (1nmol/L a 1mmol/L) cuando la concentración de glucosa en el medio era ≥ 8,3 mmol/L; que dicho efecto permanecía aún en ausencia de calcio extracelular y que el mecanismo no estaba mediado por canales de potasio dependientes de ATP (Jeppesen, Gregersen, Poulsen, & Hermansen, Citation2000).
Posteriormente, el mismo grupo de investigación evaluó el efecto in vitro pero ahora de rebaudiósido A, de igual manera con células β de ratones del ‘Naval Medical Research Institute’ (NMRI) cultivadas con glucosa y en presencia de varias dosis de rebaudiósido A (10–16 a 10–6 mol/L). En este estudio se reportó que el rebaudiósido A incrementa la producción de insulina de manera dosis dependiente, a partir de la concentración de 10–14 mol/L y alcanzando un pico máximo a la concentración de 10–10 mol/L, sin embargo para que se logre este efecto la concentración in vitro de glucosa debe ser el doble (16,7 mmol/L), que la reportada para el esteviósido y esteviol y que dicho efecto, al igual que estos últimos metabolitos, no está mediado por los canales de K+ dependientes de ATP pero sí depende de la concentración de Ca2+ extracelular (Abudula, Jeppesen, Rolfsen, Xiao, & Hermansen, Citation2004).
Un grupo de investigadores demostró que el esteviósido no aumenta la producción basal de insulina, pero si las células β se incuban previamente con esteviósido (10–7 a 10–5 M) durante 24 horas y luego se estimulan con glucosa (16,7 mM), el esteviósido aumenta la producción de insulina de manera dosis-dependiente. Los autores sugieren que esta capacidad es ventajosa frente a otros fármacos para el tratamiento de la diabetes como es la Glibenclamida que sí estimula la insulina basal pero también desensibiliza las células β in vitro (Chen et al., Citation2006).
Dicho grupo de investigadores, en un estudio posterior, demostraron no solamente que el cultivo in vitro durante 24 horas de células β con glibenclamida (10–7 mol/L) causa la desensibilización a la glucosa (16,7 mmol/L) para producir insulina, sino que este efecto puede revertirse si la incubación se realiza simultáneamente con esteviósido (10–7 mol/L). También se encontró que el esteviósido aumenta la expresión del gen de transportador de glucosa GLUT-2 presente en las células β que permite la entrada de la glucosa al interior de las células β y estimula la producción de insulina, lo que podría explicar la capacidad sensibilizadora del esteviósido sobre las células β (Chen, Jeppesen, Nordentoft, & Hermansen, Citation2006).
Por otra parte, un protocolo con ratas a las cuales se les proporcionó un extracto de Stevia rebaudiana (20 mg/kg/día) o esteviósido (5,5 mg/kg/día) durante 15 días y posteriormente fueron sacrificadas para hacer una perfusion hepatica y aislar los hepatocitos, se encontró que sólo el extracto de S. rebaudiana, y no el esteviósido, disminuyó la gluconeogénesis a partir de alanina, glutamina y lactato en comparación con el grupo control negativo (Ferreira et al., Citation2006). El estudio de (Chen et al., Citation2005) donde se administró 0,5 mg/kg de esteviósido a ratas con diabetes inducida con streptozotocina durante 15 días, se observó disminución del RNA mensajero y la concentración de la proteína fosfoenol piruvato carboquinasa (PEPCK), una enzima gluconeogénica, correlacionado con el efecto antihiperglucémico encontrado en este estudio.
Estos estudios in vitro explican que el efecto antidiabético del esteviósido es por aumento en la sensibilidad de la célula β, mayor producción de insulina y disminución de la gluconeogenesis, que el efecto de rebaudiósido A sobre la producción de insulina sólo es posible si la concentración de la glucosa del medio es alta y que algún componente presente en el extracto de Stevia rebaudiana (que no es esteviósido) también disminuye la gluconeogénesis. Algunos estudios en modelos animales, se han enfocado en determinar el efecto del esteviósido y del esteviol (producto de la hidrólisis enzimática del esteviósido) sobre la absorción intestinal a nivel yeyuno de la glucosa. Como es el caso de Toskulkao, Sutheerawattananon, and Piyachaturawat (Citation1995), quienes emplearon la técnica de saco evertido para evaluar el efcto de la absorción de glucosa en yeyuno de hamsters, encontrando que el esteviósido suministrado a dos dosis 1 y 5 mM, no presentó ningún efecto inhibidor sobre la absorción de glucosa. Por el contrario, la absorción de glucosa fue inhibida en un 29% con 1 mM de steviol. En dicho estudio se observaron reducciones en el contenido de ATP en la mucosa intestinal y alteraciones de la morfología de las células que efectúan la absorción intestinal, atribuyendo a dichos fenómenos el posible mecanismo de acción inhibidora del esteviol. En un estudio mas reciente Jeppesen et al. (Citation2003), emplearon el modelo de ratas Goto Kakizaki (modelo diabetes tipo 2) para determinar los efectos antihiperglucémicos en sangre del esteviósido, en dicho estudio se suministro esteviósido (25 mg/kg/día) via intra-arterial durante 6 semanas. El efecto antihiperglucémico del esteviósido fue causado por un aumento en la secreción de insulina; en este mismo trabajo se evaluó el mecanismo de acción del esteviósido mediante el cultivo de células de páncreas INS-1 en presencia o ausencia de 1 mol/L de esteviósido o esteviol y 11 mmol/L de glucosa durante 24 horas, para evaluar la expresión de genes del metabolismo de la glucosa y ácidos grasos. Se encontró que el esteviósido y el esteviol, incrementaron el contenido de mRNA de proinsulina e insulina en las células INS-1, lo que correlacionó con el incremento en el contenido de insulina en las células; por otra parte, el esteviósido y el esteviol incrementaron la expresión de los genes de piruvato quinasa, acetil-CoA carboxilasa y disminuyeron la expresión de carnitina palmitoil transferasa 1 (CPT-1), lo que en conjunto puede aumentar el contenido citosólico de acil-CoA de cadena larga, que estimularía la exositosis de insulina (Wollheim & Maechler, Citation2002). Además, se sabe que la tasa de secreción de insulina se adapta a los cambios en la concentración de glucosa en la sangre, gracias a su metabolismo en las células ß a través de la glucólisis y el ciclo de los ácidos tricarboxílicos ya que el aumento del radio ATP/ADP promueve el cierre de canales de potasio sensibles al ATP y la despolarización de la membrana plasmática; como consecuencia, se incrementa el Ca2+ citosólico gracias a la pertura de canales de Ca2+ sensibles al voltaje y este incremento es el principal desencadenante de la exocitosis de insulina (Matschinsky, Citation1996). Lo anterior sugiere que el esteviósido y esteviol no sólo incrementan la producción de insulina en las células ß sino también se incrementan la expresión de genes que facilitan su secreción.
El aumento en la producción de insulina por el esteviósido ha sido reportado también por otros estudios (Cekic, Vasovic, Jakovljevic, Mikov, & Sabo, Citation2011; Chang et al., Citation2005). Considerando lo anterior, el efecto antihiperglucémico del esteviósido y del esteviol puede ser causado no solo por la inhibición de la absorción de glucosa a nivel intestinal, sino que puede implicar otros mecanismos tales como la inducción de genes implicados en el incremento de la producción y secreción de insulina. De esta forma el esteviósido y el esteviol podrían actuar como antidiabéticos; presentando ambos compuestos una potencial aplicación terapéutica en el tratamiento de la diabetes tipo 2 y del síndrome metabólico.
4. Conclusión
Si bien Stevia rebaudiana Bertoni es una planta con propiedades edulcorantes y sin contenido calórico, lo que la hace un buen candidato para ser utilizada en la industria alimentaria, también se ha demostrado que el extracto completo y al menos un glucósido de esteviol presente en Stevia rebaudiana, el esteviósido, tienen efecto antihiperglucemiante. Los mecanismos de acción implicados en el efecto que presentan tanto el extracto de S. rebaudiana como el esteviósido son la supresión de la gluconeogénesis y aumento en la producción de insulina. Es necesario realizar más estudios para tener una mejor comprensión de los mecanismos de acción, como por ejemplo la falta de actividad del rebaudiósido A, así como si otras moléculas presentes en la planta puedieran tener efectos similares al esteviósido.
Agradecimientos
Esta revisión está enmarcada dentro de los proyectos ‘Evaluación del efecto hipoglucemiante de las hojas de Stevia rebaudiana’ (PROMEP-SEP) y ‘Caracterización química de las hojas de Stevia rebaudiana y su incorporación a alimentos’ (FESE).
Referencias bibliográficas
- Abudula, R., Jeppesen, P. B., Rolfsen, S. E., Xiao, J., & Hermansen, K. (2004). Rebaudioside A potently stimulates insulin secretion from isolated mouse islets: Studies on the dose-, glucose-, and calcium-dependency. Metabolism, 53(10), 1378–1381. doi: 10.1016/j.metabol.2004.04.014
- ADA. (2010a). Standards of medical care in diabetes 2010. Diabetes Care, 33(Suppl 1), S11–61. doi: 10.2337/dc10-S011
- ADA. (2010b). Diagnosis and classification of diabetes mellitus. Diabetes Care, 33(Suppl 1), S62–69. doi: 10.2337/dc10-S062
- Akashi, H., & Yokoyama, Y. (1975). Security of dried-leaf extracts of stevia: Toxicological tests. Food Industry, 18, 34–43.
- Bolen, S., Feldman, L., Vassy, J., Wilson, L., Yeh, H. C., Marinopoulos, S., … Brancati, F. L. (2007). Systematic review: Comparative effectiveness and safety of oral medications for type 2 diabetes mellitus. Annals of internal medicine, 147(6), 386–399.
- Brahmachari, G., Mandal, L. C., Roy, R., Mondal, S., & Brahmachari, A. K. (2011) Stevioside and related compounds – molecules of pharmaceutical promise: A critical overview. Archiv Der Pharmazie (Weinheim, Germany), 344(1), 5–19. doi: 10.1002/ardp.201000181
- Brandle, J. E. (1999). Genetic control of rebaudioside A and C concentration in leaves of the sweet herb, Stevia rebaudiana. Canadian Journal of Plant Science, 79, 85–92.
- Brandle, J. E., & Telmer, P. G. (2007). Steviol glycoside biosynthesis. Phytochemistry, 68(14), 1855–1863. doi: 10.1016/j.phytochem.2007.02.010
- Cardoso, V. N., Barbosa, M. F., Muramoto, E., Mesquita, C. H., & Almeida, M. A. (1996). Pharmacokinetic studies of 131I-stevioside and its metabolites. Nuclear Medicine and Biology, 23(1), 97–100.
- Cekic, V., Vasovic, V., Jakovljevic, V., Mikov, M., & Sabo, A. (2011). Hypoglycaemic action of stevioside and small a, Cyrillic barley and brewer’s yeast based preparation in the experimental model on mice. Bosnian Journal of Basic Medical Science, 11(1), 11–16.
- Chan, P., Tomlinson, B., Chen, Y. J., Liu, J. C., Hsieh, M. H., & Cheng, J. T. (2000). A double-blind placebo-controlled study of the effectiveness and tolerability of oral stevioside in human hypertension. British Journal of Clinical Pharmacology, 50(3), 215–220. doi: 10.1046/j.1365-2125.2000.00260.x
- Chan, P., Xu, D. Y., Liu, J. C., Chen, Y. J., Tomlinson, B., Huang, W. P., & Cheng, J. T. (1998). The effect of stevioside on blood pressure and plasma catecholamines in spontaneously hypertensive rats. Life Sciences, 63(19), 1679–1684. doi: http://dx.doi.org/10.1016/S0024-3205(98)00439-1
- Chang, J. C., Wu, M. C., Liu, I. M., & Cheng, J. T. (2005). Increase of insulin sensitivity by stevioside in fructose-rich chow-fed rats. Hormone and Metabolic Research, 37(10), 610–616. doi: 10.1055/s-2005-870528
- Chaturvedula, V. S., Upreti, M., & Prakash, I. (2011). Diterpene glycosides from Stevia rebaudiana. Molecules, 16(5), 3552–3562. doi: 10.3390/molecules16053552
- Chen, T. H., Chen, S. C., Chan, P., Chu, T. L., Yang, H. Y., & Cheng, J. T. (2005). Mechanism of the hypoglycemic effect of stevioside, a glycoside of Stevia rebaudiana. Planta Medica, 71(2), 108–113.
- Chen, J., Jeppesen, P. B., Abudula, R., Dyrskog, S. E., Colombo, M., & Hermansen, K. (2006). Stevioside does not cause increased basal insulin secretion or beta-cell desensitization as does the sulphonylurea, glibenclamide: Studies in vitro. Life Sciences, 78(15), 1748–1753. doi: 10.1016/j.lfs.2005.08.012
- Chen, J., Jeppesen, P. B., Nordentoft, I., & Hermansen, K. (2006). Stevioside counteracts the glyburide-induced desensitization of the pancreatic beta-cell function in mice: Studies in vitro. Metabolism, 55(12), 1674–1680. doi: 10.1016/j.metabol.2006.08.009
- Curi, R., Alvarez, M., Bazotte, R. B., Botion, L. M., Godoy, J. L., & Bracht, A. (1986). Effect of Stevia rebaudiana on glucose tolerance in normal adult humans. Brazilian Journal of Medical and Biological Research, 19(6), 771–774.
- Das, S., Das, A. K., Murphy, R. A., Punwani, I. C., Nasution, M. P., & Kinghorn, A. D. (1992). Evaluation of the cariogenic potential of the intense natural sweeteners stevioside and rebaudioside A. Caries Research, 26(5), 363–366.
- Day, C. (2005). Are herbal remedies of use in diabetes? [Review]. Diabetic Medicine, 22(Suppl 1), 10–12. doi: 10.1111/j.1464-5491.2005.1531e.x
- Dyrskog, S. E., Jeppesen, P. B., Chen, J., Christensen, L. P., & Hermansen, K. (2005). The diterpene glycoside, rebaudioside A, does not improve glycemic control or affect blood pressure after eight weeks treatment in the Goto-Kakizaki rat. The Review of Diabetic Studies, 2(2), 84–91. doi: 10.1900/RDS.2005.2.84
- Ferreira, E. B., de Assis Rocha Neves, F., da Costa, M. A., do Prado, W. A., de Araujo Funari Ferri, L., & Bazotte, R. B. (2006). Comparative effects of Stevia rebaudiana leaves and stevioside on glycaemia and hepatic gluconeogenesis. Planta Medica, 72(8), 691–696. doi: 10.1055/s-2006-931586
- Fujita, Y., Wideman, R. D., Speck, M., Asadi, A., King, D. S., Webber, T. D., … Kieffer, T. J. (2009). Incretin release from gut is acutely enhanced by sugar but not by sweeteners in vivo. American Journal of Physiology – Endocrinology And Metabolism, 296(3), E473–479. doi: 10.1152/ajpendo.90636.2008
- Geuns, J. M., Buyse, J., Vankeirsbilck, A., & Temme, E. H. (2007). Metabolism of stevioside by healthy subjects. Experimental Biology and Medicine, 232(1), 164–173.
- Goyal, S. K., Samsher, & Goyal, R. K. (2009). Stevia (Stevia rebaudiana) a bio-sweetener: A review. International Journal of Food Science and Nutrition, 61(1), 1–10. doi: 10.3109/09637480903193049
- Gregersen, S., Jeppesen, P. B., Holst, J. J., & Hermansen, K. (2004). Antihyperglycemic effects of stevioside in type 2 diabetic subjects. Metabolism, 53(1), 73–76. doi: doi: 10.1016/j.metabol.2003.07.013
- Hagiwara, A., Fukushima, S., & Kitaori, M. (1984). Effects of the three sweeteners on rats urinary bladder carcinogenesis initiated by N-butyl-N-(4-hydroxybutyl)-nitrosamine. Japanesse Journal of Cancer Research: Gann, 75, 763–768.
- Hernandez-Galicia, E., Aguilar-Contreras, A., Aguilar-Santamaria, L., Roman-Ramos, R., Chavez-Miranda, A. A., Garcia-Vega, L. M., … Alarcon-Aguilar, F. J. (2002). Studies on hypoglycemic activity of Mexican medicinal plants. Proceedings of the West Pharmacology Society, 45, 118–124.
- Hsu, Y. H., Liu, J. C., Kao, P. F., Lee, C. N., Chen, Y. J., Hsieh, M. H., & Chan, P. (2002). Antihypertensive effect of stevioside in different strains of hypertensive rats. Chinesse Medical Journal, 65(1), 1–6.
- Hutapea, A. M., Toskulkao, C., Buddhasukh, D., Wilairat, P., & Glinsukon, T. (1997). Digestion of stevioside, a natural sweetener, by various digestive enzymes. Journal of Clinical Biochememistry and Nutrition, 23(3), 177–186.
- Jackson, A. U., Tata, A., Wu, C., Perry, R. H., Haas, G., West, L., & Cooks, R. G. (2009). Direct analysis of Stevia leaves for diterpene glycosides by desorption electrospray ionization mass spectrometry. Analyst, 134(5), 867–874. doi: 10.1039/b823511b
- Jarma-Orozco, A., Araméndiz-Tatis, H., & Cleves-Leguízamo (2011). Phenotypic stability and plant densities of stevia (Stevia rebaudiana Bert.) genotypes in the Caribbean Region of Colombia. Acta Agronómica, 60(2), 165–175.
- JECFA. (2010). Steviol glycosides. In FAO (Ed.), FAO JECFA Monographs Rome, Italy. (pp. 17–21) Rome: FAO.
- Jeppesen, P. B., Dyrskog, S. E., Agger, A., Gregersen, S., Colombo, M., Xiao, J., & Hermansen, J. (2006). Can stevioside in combination with a soy-based dietary supplement be a new useful treatment of type 2 diabetes? An in vivo study in the diabetic goto-kakizaki rat. The Review of Diabetic Studies, 3(4), 189–199. doi: 10.1900/RDS.2006.3.189
- Jeppesen, P. B., Gregersen, S., Alstrup, K. K., & Hermansen, K. (2002). Stevioside induces antihyperglycaemic, insulinotropic and glucagonostatic effects in vivo: Studies in the diabetic Goto-Kakizaki (GK) rats. Phytomedicine, 9(1), 9–14.
- Jeppesen, P. B., Gregersen, S., Poulsen, C. R., & Hermansen, K. (2000). Stevioside acts directly on pancreatic beta cells to secrete insulin: Actions independent of cyclic adenosine monophosphate and adenosine triphosphate-sensitive K + −channel activity. Metabolism, 49(2), 208–214.
- Jeppesen, P. B., Gregersen, S., Rolfsen, S. E., Jepsen, M., Colombo, M., Agger, A., … Hermansen, K. (2003). Antihyperglycemic and blood pressure-reducing effects of stevioside in the diabetic Goto-Kakizaki rat. Metabolism, 52(3), 372–378. doi: 10.1053/meta.2003.50058
- Koyama, E., Sakai, N., Ohori, Y., Kitazawa, K., Izawa, O., Kakegawa, K., … Ui, M. (2003). Absorption and metabolism of glycosidic sweeteners of stevia mixture and their aglycone, steviol, in rats and humans. Food and chemical toxicology, 41(6), 875–883.
- Kujur, R. S., Singh, V., Ram, M., Yadava, H. N., Singh, K. K., Kumari, S., …Roy, B. K. (2010). Antidiabetic activity and phytochemical screening of crude extract of Stevia rebaudiana in alloxan-induced diabetic rats. Pharmacognosy Research, 2(4), 258–263. doi: 10.4103/0974-8490.69128
- Lailerd, N., Saengsirisuwan, V., Sloniger, J. A., Toskulkao, C., & Henriksen, E. J. (2004). Effects of stevioside on glucose transport activity in insulin-sensitive and insulin-resistant rat skeletal muscle. Metabolism, 53(1), 101–107. doi: 10.1016/j.metabol.2003.07.014
- Lee, C. N., Wong, K. L., Liu, J. C., Chen, Y. J., Cheng, J. T., & Chan, P. (2001). Inhibitory effect of stevioside on calcium influx to produce antihypertension. Planta Medica, 67(9), 796–799. doi: 10.1055/s-2001-18841
- Maki, K. C., Curry, L. L., Carakostas, M. C., Tarka, S. M., Reeves, M. S., Farmer, M. V., … Bisognano, J. D. (2008). The hemodynamic effects of rebaudioside A in healthy adults with normal and low-normal blood pressure. Food and Chemical Toxicology, 46(Suppl 7), S40–46. doi: 10.1016/j.fct.2008.04.040
- Maki, K. C., Curry, L. L., Reeves, M. S., Toth, P. D., McKenney, J. M., Farmer, M. V., … Tarka, S. M. (2008). Chronic consumption of rebaudioside A, a steviol glycoside, in men and women with type 2 diabetes mellitus. Food and Chemical Toxicology, 46(Suppl 7), S47–53. doi: 10.1016/j.fct.2008.05.007
- Matschinsky, F. M. (1996). A Lesson in metabolic regulation inspired by the glucokinase glucose sensor paradigm. Current Medical Literature – Diabetes, 45, 223–241.
- Matsui, M., Matsui, K., Kawasaki, Y., Oda, Y., Noguchi, T., Kitagawa, Y., … Sofuni, T. (1996). Evaluation of the genotoxicity of stevioside and steviol using six in vitro and one in vivo mutagenicity assays. Mutagenesis, 11(6), 573–579.
- Melis, M. S. (1999). Effects of chronic administration of Stevia rebaudiana on fertility in rats. Journal of ethnopharmacology, 167, 157–161.
- Misra, H., Soni, M., Silawat, N., Mehta, D., Mehta, B. K., & Jain, D. C. (2011). Antidiabetic activity of medium-polar extract from the leaves of Stevia rebaudiana Bert. (Bertoni) on alloxan-induced diabetic rats. Journal of Pharmacy and Bioallied Sciences, 3(2), 242–248. doi: 10.4103/0975-7406.80779
- Mizushina, Y., Akihisa, T., Ukiya, M., Hamasaki, Y., Murakami-Nakai, C., Kuriyama, I., …Yoshida, H. (2005). Structural analysis of isosteviol and related compounds as DNA polymerase and DNA topoisomerase inhibitors. Life Science, 77(17), 2127–2140. doi: 10.1016/j.lfs.2005.03.022
- Morita, T., & Bu, Y. (2000). Variety of Stevia rebaudiana Bertoni. U.S. Patent No. 6,031,157. Washington, DC: U.S. Patent and Trademark Office.
- Nakayama, K., Kasahara, D., & Yamamoto, F. (1986). Absorption, Distribution, metabolism and excretion of stevioside in rats. Journal of the Food Hygienic Society of Japan, 27, 1–8.
- Nathan, D. M., Buse, J. B., Davidson, M. B., Ferrannini, E., Holman, R. R., Sherwin, R., & Zinman, B. (2009). Medical management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy. A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care, 32(1), 193–203. doi: dc08-9025 10.2337/dc08-9025
- Nathan, D. M., Buse, J. B., Davidson, M. B., Heine, R. J., Holman, R. R., Sherwin, R., … Zinman, B. (2006). Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American diabetes association and the European association for the study of diabetes. Diabetes Care, 29(8), 1963–1972. doi: 29/8/1963 10.2337/dc06-9912
- Pezzuto, J. M., Compadre, C. M., Swanson, S. M., Nanayakkara, D., & Kinghorn, A. D. (1985). Metabolically activated steviol, the aglycone of stevioside, is mutagenic. Proceedings of the Nacional Academy Science, 82(8), 2478–2482.
- Pezzuto, J. M., Nanayakkara, N. P., Compadre, C. M., Swanson, S. M., Kinghorn, A. D., Guenthner, T. M., … Lam, L. K. (1986). Characterization of bacterial mutagenicity mediated by 13-hydroxy-ent-kaurenoic acid (steviol) and several structurally-related derivatives and evaluation of potential to induce glutathione S-transferase in mice. Mutation research, 169(3), 93–103.
- Phillips, P. J., & Twigg, S. M. (2010). Oral hypoglycaemics – a review of the evidence. Australian Family Physician, 39(9), 651–653.
- Planas, G. M., & Kucacute, J. (1968). Contraceptive properties of Stevia rebaudiana. Science, 162(3857), 1007.
- Raskovic, A., Gavrilovic, M., Jakovljevic, V., & Sabo, J. (2004). Glucose concentration in the blood of intact and alloxan-treated mice after pretreatment with commercial preparations of Stevia rebaudiana (Bertoni). European Journal of Drug Metabolism and Pharmacokinet, 29(2), 87–90.
- Raskovic, A., Jakovljevic, V., Mikov, M., & Gavrilovic, M. (2004). Joint effect of commercial preparations of Stevia rebaudiana Bertoni and sodium monoketocholate on glycemia in mice. European Journal of Drug Metabolism and Pharmacokinet, 29(2), 83–86.
- Raskovic, A., Mikov, M., Skrbic, R., Jakovljevic, V., Vasovic, V., Posa, M., … Siladji, D. (2008). Effect of stevioside and sodium salt of monoketocholic acid on glycemia in normoglycemic and diabetic rats. European Journal of Drug Metabolism and Pharmacokinet, 33(1), 17–22.
- Roberts, A., & Renwick, A. G. (2008). Comparative toxicokinetics and metabolism of rebaudioside A, stevioside, and steviol in rats. Food and Chemical Toxicology, 46(7 Suppl 1), S31–39. doi: 10.1016/j.fct.2008.05.006
- Shiotsu, S. (1996). Fertility study of Stevia decoction in rats. Techical Journal of Food Chemistry and Chemicals, 4, 108–113.
- Suttajit, M., Vinitketkaumnuen, U., Meevatee, U., & Buddhasukh, D. (1993). Mutagenicity and human chromosomal effect of stevioside, a sweetener from Stevia rebaudiana Bertoni. Enviromental Health Perspectives, 101(Suppl 3), 53–56.
- Toskulkao, C., Chaturat, L., Temcharoen, P., & Glinsukon, T. (1997). Acute toxicity of stevioside, a natural sweetener, and its metabolite, steviol, in several animal species. Drug and Chemical Toxicology, 20(1–2), 31–44.
- Toskulkao, C., Sutheerawattananon, M., & Piyachaturawat, P. (1995). Inhibitory effect of steviol, a metabolite of stevioside, on glucose absorption in everted hamster intestine in vitro. Toxicology letters, 80(1–3), 153–159.
- Toskulkao, C., Sutheerawatananon, M., Wanichanon, C., Saitongdee, P., & Suttajit, M. (1995). Effects of stevioside and steviol on intestinal glucose absorption in hamsters. Journal of Nutritional Science and Vitaminology, 41(1), 105–113.
- Toyoda, K., Matsui, H., Shoda, T., Uneyama, C., Takada, K., & Takahashi, S. (1997). Assessment of carciogenicity of stevioside in F344 rats. Food and Chemical Toxicology, 35(6), 597–603.
- U. S. Food and Drug Administration/Center for Food Safety and Applied Nutrition. (2008). Comprehensive GRAS assessment of rebaudioside A (97%). Washington, DC: FDA public health advisory.
- Wasuntarawat, C., Temcharoen, P., Toskulkao, C., Mungkornkarn, P., Suttajit, M., & Glinsukon, T. (1998). Developmental toxicity of steviol, a metabolite of stevioside, in the hamster. Drug and Chemical Toxicology, 21(2), 207–222.
- Wingard, R. E., Brown, J. P., Enderlin, F. E., Dale, J. A., Hale, R. L., & Seitz, C. T. (1980). Intestinal degradation and absorption of the glycosidic sweeteners stevioside and rebaudioside A. Experientia, 36(5), 519–520.
- Wheeler, A., Boileau, A. C., Winkler, P. C., Compton, S. C., Prakash, J., Jiang, X., & Mandarino, D. A. (2008). Pharmacokinetics of rebaudioside A and stevioside after single oral doses in healthy men. Food and Chemical Toxicology, 46, S54–S60. doi: 10.1016/j.fct.2008.04.041
- WHO. (2006). Stability testing of active substances and pharmaceutical products Geneva, Switzerland (pp. 1–33). Geneva: WHO.
- Woelwer-Rieck, U., Lankes, C., Wawrzun, A., & Wüst, M. (2010). Improved HPLC method for evaluation of the major steviol glycosides in leaves of Stevia rebaudiana. European Food Research and Technology, 231, 581–588.
- Wollheim, C., & Maechler, P. (2002). ß-Cell mitochondria and insulin secretion: Messenger role of nucleotides and metabolites. Current Medical Literature – Diabetes, 51(Suppl. 1), S37–S42.
- Yasukawa, K., Kitanaka, S., & Seo, S. (2002). Inhibitory effect of stevioside on tumor promotion by 12-O-tetradecanoylphorbol-13-acetate in two-stage carcinogenesis in mouse skin. Biological & Pharmaceutical Bulletin, 25(11), 1488–1490.
- Yodyingyuad, V., & Bunyawong, S. (1991). Effect of stevioside on growth and reproduction. Human Reproduction, 6(1), 158–165.

