Abstract
Se elaboraron y caracterizaron películas biodegradables a base de extractos pécticos de bagazo o pomaza de limón mexicano, incorporados con glicerol y aceite esencial de limón. Mediante un diseño central compuesto se obtuvieron 20 películas (para bagazo o pomaza) por el método de casting. Se realizaron pruebas mecánicas y de permeabilidad al vapor de agua, para seleccionar una formulación con mayor resistencia y menor permeabilidad. La película seleccionada a base de extracto péctico de bagazo de limón (1,0% pectina, 0,75% glicerol, 500 mg/kg aceite esencial de limón) presentó una fuerza a la punción de 1.48 N·mm−1 y permeabilidad al vapor de agua de 5.17 × 10−11 g·s−1·m−1 Pa−1. La película seleccionada se caracterizó en cuanto a humedad, color, espesor, FTIR-ATR, TGA y SEM. La incorporación del aceite esencial de limón no afectó las propiedades funcionales de la película.
Biodegradable edible films from bagasse and pomace Mexican lime pectic extracts were prepared, with the addition of glycerol and Lime essential oil. A central composite experimental design was used to obtain 20 different film formulations (from each, bagasse and pomace) using the casting method. Based on the measurement of the mechanical properties and water vapor permeability tests, a formulation was selected for its higher resistance and the lower permeability results. The selected formulation (1% pectin, 0.75% glycerol and 500 mg/kg of essential oil) presented a punction force of 1.48 N·mm−1 and water permeability of 5.17 × 10−11 g·s−1 m−1·Pa−1. The film was also characterized for moisture, color FTIR-ATR, TGA and SEM. Incorporation of the Lime essential oil did not affect the functional properties of the film.
1. Introducción
En la industria alimentaria se utiliza una amplia variedad de empaques. Los empaques como las películas plásticas son una estructura independiente que envuelve a un alimento con la finalidad de prevenir el deterioro, alargar la vida de anaquel y proteger al producto contra daños mecánicos, además de facilitar la distribución y la comercialización de los productos alimenticios (Espitia, Du, Avena-Bustillos, Soares, & McHugh, Citation2014; Sothornvit & Pitak, Citation2007; Zamudio-Flores, Romero-Bastida, Hernández-Uribe, Bello-Pérez, & Vargas-Torres, Citation2007). Los materiales más utilizados para elaborar películas de empaque son polímeros a base de petroquímicos por sus grandes ventajas, como disponibilidad, bajo costo y propiedades funcionales adecuadas para la preservación del alimento. Sin embargo, estos materiales no son biodegradables y ocasionan un serio problema ambiental por la acumulación de desechos sólidos (Alves, Mali, Beléia, & Grossmann, Citation2007). Debido a esto en las últimas décadas, se han realizado estudios en el campo de películas y recubrimientos biodegradables y comestibles.
Los biopolímeros usados para producir películas biodegradables son proteínas, lípidos y carbohidratos (gomas, almidón, derivados de la celulosa y pectinas) o la combinación entre estos (Chen & Lai, Citation2008; Han & Gennadios, Citation2005; Sothornvit & Pitak, Citation2007). Sin embargo, debido a que existe una continua actividad química y física en la interfase entre el empaque y el alimento, es necesario que las películas presenten ciertas propiedades que garanticen la preservación del alimento empacado. Entre las propiedades más importantes se encuentran las propiedades físicas, térmicas, de permeación y las mecánicas. Estas propiedades dependen ampliamente de los materiales utilizados, de su método formación y de su aplicación (Guilbert, Gontard, & Gorris, Citation1996) y pueden variar con las condiciones de almacenamiento debido a la inestabilidad intrínseca de sus materias primas, afectando su funcionalidad. La permeabilidad al vapor de agua (PVA) es la propiedad más estudiada, principalmente por el papel que juega el agua en las reacciones deteriorativas (Ayranci & Tunc, Citation2003). Sin embargo, una película biodegradable con buenas propiedades de permeación puede ser ineficiente si sus propiedades mecánicas no permiten mantener la integridad de la película durante el manejo, empaquetamiento o transporte, por lo que también deben determinarse sus propiedades mecánicas (Briassoulis, Citation2006).
Además de la matriz polimérica principal, es necesaria la incorporación de algunos aditivos como agentes de entrecruzamiento y plastificantes. Un plastificante es una sustancia no volátil de bajo peso molecular, que se adiciona a un material polimérico para modificar algunas propiedades físicas y mecánicas (Stevens, Citation1993). La incorporación de plastificantes mejoran la flexibilidad de los materiales, su manejabilidad y su habilidad de extensión (Mali, Grossmann, Garcı́a, Martino, & Zaritzky, Citation2005; Osés, Fernández, Mendoza, & Maté, Citation2009; Parra, Tadini, Ponce, & Lugão, Citation2004), pero a su vez pueden modificar otras propiedades del material. Otros aditivos empleados para mejorar las propiedades funcionales de las películas, incluyen agentes de entrecruzamiento, de textura, antioxidantes o antimicrobianos (Talja, Helén, Roos, & Jouppila, Citation2007). Estudios recientes han incorporado agentes antioxidantes y antimicrobianos para formar empaques activos (inteligentes), como los compuestos fenólicos y los aceites esenciales (Espitia et al., Citation2014).
Por otro lado, la caracterización de los materiales de empaque o formadores de películas y recubrimientos involucra dos procesos, uno es el análisis estructural y el otro el análisis de sus propiedades. El primero se lleva a cabo mediante técnicas espectrofotométricas y de microscopía (Bierhalz, da Silva, & Kieckbusch, Citation2012) y el análisis de propiedades es muy diverso y depende de la aplicación de la película o recubrimiento sobre un alimento en específico. Por ejemplo, las propiedades de barrera dependen ampliamente de las condiciones de humedad, actividad de agua, forma de almacenamiento, etc. del alimento (Chambi & Grosso, Citation2011).
Sothornvit and Pitak (Citation2007), encontraron que las películas de almidón y pectina tienen un alto módulo de elasticidad; sin embargo, fueron muy quebradizas, pero lograron evitar esto adicionando un plastificante. Du et al. (Citation2009) estudiaron el efecto del aceite esencial de canela y clavo en las propiedades de películas comestibles a base de puré de manzana y pectina y encontraron que la incorporación de dicho aceite redujo significativamente las fuerza de tención y el módulo de elasticidad de las películas.
A pesar de que algunos desechos de la industria alimentaria contienen biomoléculas que pueden usarse como base para la elaboración de películas biodegradables, aún quedan muchas investigaciones por realizar. Los frutos cítricos representan un gran potencial para esta tecnología debido a su alta producción y consumo a nivel mundial.
El limón agrío o limón Mexicano (Citrus aurantifolia Swingle) es nativo del sureste de Asia y crece en regiones tropicales de Brasil, Perú, India y México (Siap, Citation2012). El principal uso de estas frutas es en fresco y el resto es procesado para producir jugo. Durante el procesamiento del limón para la extracción de jugo se obtienen grandes cantidades de desechos (aproximadamente el 40–50% del peso fresco de la fruta) (Ahmad, Iqbal, Anjum, & Sultan, Citation2006; Ma, Chen, Liu, & Ye, Citation2009), y del total de bagazo es posible recuperar hasta un 30% de pectina (Masmoudi et al., Citation2008). Por ello, resulta factible la utilización de estos residuos para la extracción de compuestos bioactivos como aceite esencial, ácido cítrico, compuestos fenólicos y pectinas. El objetivo de este trabajo fue obtener películas comestibles a partir de extractos pécticos y aceite esencial limón Mexicano, seleccionar y caracterizar parcialmente aquella con mejores propiedades.
2. Materiales y métodos
2.1. Materiales
La materia prima base para la formulaciones de las películas fue extracto péctico de bagazo de limón Mexicano (Citrus aurantifolia Swingle) (BC) con un rendimiento de pectina de 13.3 ± 0.03% y de pomaza de limón Mexicano (PC) con un rendimiento de pectina de 15.1 ± 0.02%. La caracterización fisicoquímica de los extractos pécticos fue publicada anteriormente (Sánchez-Aldana, Aguilar, Nevarez-Moorillon, & Esquivel, Citation2013). El bagazo es el producto obtenido después de la extracción de jugo de limón incluyendo las semillas mientras que la pomaza es el bagazo de limón que ha sido sometido a diversos procesos de lavado y blanqueado con la finalidad de dejar disponible mayor cantidad de pectina para su extracción. Los extractos pécticos BC y PC limón mexicano se obtuvieron poniendo el material en contacto con una solución de ácido cítrico al 1% en relación 1:20 materia seca:solución, dicha mezcla se agitó y calentó a 90°C durante 1 h. Posteriormente la solución se filtró a través de tela muselina y el filtrado se empleó como extracto péctico como materia base para la formación de las películas. Además, se empleó aceite esencial de limón mexicano obtenido del bagazo fresco de limón por hidrodestilación durante 4 h (Hernández-Ochoa, Gonzales-Gonzales, Gutiérrez-Mendez, Muñoz-Castellanos, & Quintero-Ramos, Citation2011). Para ello, se lavaron limones con agua destilada y se extrajo su jugo manualmente. El bagazo resultante incluyendo pulpa y semillas se sometió a extracción usando un aparato modificado de Schilcher. Luego de la hidrodestilación, el destilado se recuperó y separó del agua usando un embudo de separación. El aceite esencial de limón se secó con sulfato de sodio anhidro y se almacenó en un frasco ámbar para proteger de la luz a 4°C hasta su uso.
2.2. Preparación de solución formadora de películas y formación de películas
A partir de los extractos pécticos de BC y PC de limón mexicano se formularon diferentes soluciones filmógenas (SF) con las que posteriormente se formaron las películas biodegradables. Se utilizó un diseño experimental central compuesto con tres variables (veinte formulaciones para cada extracto péctico) (). Para formular las películas se tomaron 60 ml del extracto y se ajustó su pH a 3,0 con Ca(OH)2 1 M. Enseguida se incorporó glicerol como agente plastificante y finalmente se agregó aceite esencial de limón mexicano de acuerdo a las concentraciones establecidas en la . Ésta mezcla se homogenizó durante 10 minutos a 150 rpm en una parrilla de agitación.
Tabla 1. Formulaciones de películas comestibles de BC y PC con base en un diseño experimental central compuesto.
Table 1. Formulations of edible films from BC and PC based on a central composite experimental design.
Las películas se formaron a partir de las SF previamente homogenizadas y por el método de vaciado (casting) sobre cajas Petri de plástico de 150 × 15 mm. Posteriormente, se colocaron las cajas en una estufa previamente nivelada. Las películas se secaron a 40ºC durante 24 horas. Finalmente las películas se desmoldaron manualmente de las cajas Petri y se almacenaron a temperatura ambiente (25ºC) dentro de cubiertas plásticas.
La selección de los niveles de las variables de concentración de glicerol se realizó de acuerdo a pruebas preliminares (datos no mostrados) en donde se encontró que por debajo del nivel más bajo de glicerol (0,5%) la películas resultante era quebradiza y por encima del nivel más alto de glicerol (1,5%) la película era muy adherente entre sí, muy elástica y difícil de manejar.
2.3. Acondicionamiento de las películas
Todas las películas se acondicionaron a una HR 75% y 25ºC en un desecador con una solución sobresaturada de NaCl por 48 horas antes de someterse a las diferentes pruebas.
2.4. Caracterización de las películas
Las películas preparadas de acuerdo a la se caracterizaron en función de sus propiedades mecánicas y su permeabilidad al vapor de agua. Luego de evaluar dichas propiedades se seleccionó la formulación con las mejores características. A dicha formulación se le determinó su color, humedad, espesor, densidad, propiedades mecánicas y permeabilidad al vapor de agua. Además se realizó un análisis termogravimétrico (TGA), espectroscopia FTIR-ATR y microscopia electrónica de barrido (SEM) como se describe a continuación.
2.4.1. Propiedades mecánicas
La fuerza a la tensión (FT) de las películas se determinó con un texturómetro TA.TX plus (Stable Micro Systems, Surrey, UK). Las películas se ajustaron a la boca de un pesafiltro con ayuda de un O-ring y se hizo una punción en el centro de la película con un punzón de acero de punta plana (100 mm de altura × 2,5 mm de diámetro) que descendió una distancia de 10 mm a velocidad de 2 mm·s−1. Por medio de la relación entre la fuerza de tensión (N) y la correspondiente extensión o deformación (m) al punto de falla (momento de ruptura de la película) se calculó la resistencia a la tensión de cada formulación por triplicado.
2.4.2. Permeabilidad al vapor de agua
La permeabilidad al vapor de agua (PVA) se determinó en las películas previamente acondicionadas a una humedad del 75% y 25°C. Para ello se colocó dentro de pesafiltros sin tapa (3,87 cm de diámetro × 4 cm de altura) 3 g de Sílica gel seca, (J.T. Baker, México Cat. 3401–500), se cubrió la boca de cada pesafiltro con una película y se ajustó con un O-ring. Inmediatamente después, los pesafiltros se pesaron (W0) y se colocaron dentro de un desecador con agua destilada para generar una humedad relativa del 100% a 25°C. Los pesos (Wt) de los pesafiltros se registraron a los tiempos de 1, 2, 4, 8, 16 y 24 horas. Mediante la Ecuación (1) se calculó la permeabilidad al vapor de agua.
En donde, PVA es la permeabilidad al vapor de agua (g·s−1·m−1·Pa−1), vtva es la velocidad de transferencia de vapor de agua (g·s−1) obtenido de la pendiente de la recta (tiempo vs ganancia de peso), e es el espesor promedio de la película (m), A es el área de trasferencia de vapor de agua (m2) y ∆Pv es la diferencia de presión de vapor de agua entre la atmósfera de la sílica y la del desecador (3167,2 Pa). La VTVA es la pendiente que se obtiene al graficar el peso final menos el peso inicial de la muestra (Wf−W0) vs el tiempo (t).
2.4.3. Selección de la mejor formulación
La selección de la mejor formulación se realizó en función de los resultados obtenidos del análisis de superficie de respuesta de las propiedades mecánicas y la permeabilidad al vapor de agua. La selección se hizo a partir de los efectos significativos de las variables concentración de pectina y concentración de glicerol en las que se obtuvo una mayor resistencia a la tensión y una menor permeabilidad al vapor de agua. A la formulación seleccionada se le realizó una caracterización como se describe a continuación.
2.4.5. Caracterización de la película seleccionada
Color, diferencia total de color (ΔE) e índice de amarillez (YI).
El color de las películas de midió con un colorímetro Chroma Meter CR-400/410 (Konica Minolta, Japón) por ambos lados en 5 puntos aleatorios utilizando como fondo una placa blanca de calibración (L* = 96,9, a* = − 0,04, b* = 1,84). Se clasificó como lado brillante al lado que se encontraba en contacto con la superficie y lado opaco al lado de la película expuesto hacia el ambiente durante el secado. A partir de los parámetros L*, a* y b*, se calculó la diferencia total de color (ΔE), mediante la Ecuación (2):
(2)
Los valores de referencia para la placa blanca fueron L* =96,9, a* = −0,04 y b* = 1,84.
Además se calculó el índice de amarillez (YI, por sus siglas en ingles) de acuerdo a la siguiente ecuación (Pérez-Mateos, Montero, & Gómez-Guillén, Citation2009):
(3)
Humedad, espesor y densidad.
La humedad de la película se determinó por quintuplicado según el método 934.06 (AOAC, Citation1995). El espesor de las películas se midió en 10 puntos aleatorios en 5 muestras de cada formulación utilizando un vernier digital (Mitutoyo Modelo CD-6” CS). Se reporta el espesor promedio y este se utilizó en los cálculos de permeabilidad al vapor de agua y en las propiedades mecánicas. La densidad se determinó por quintuplicado. Para ello se cortaron cuadros de 2 cm2 y por medio del espesor se determinó su volumen, además cada cuadro de película se pesó para calcular la densidad (ρ) de acuerdo a la ecuación de densidad (
.
Análisis termogravimétrico (TGA).
El análisis termogravimétrico se realizó en un TGA Hi-Res TGA 2950 TA Instruments (Delaware, EUA). La temperatura del análisis fue de 25°C a 620°C a una velocidad de 10°C·min−1 y un flujo de nitrógeno de 60% en la purga de balanza y 40% en la purga de muestra.
Espectroscopia de Infrarrojo por transformada de Fourier (FTIR-ATR).
Los espectros de FTIR se obtuvieron a temperatura ambiente en un espectrofotómetro Nicolet Nexus 670 FT-IR, equipado con un ATR Smart Miracle de diamante a una resolución de 4 cm−1. Los espectros se analizaron a través del software OMNIC (Version 7,3, Thermo Electron Corp., EUA).
Microscopia electrónica de barrido (SEM).
La homogeneidad y la apariencia de la película seleccionada se examinaron por observación visual y por SEM con un microscopio electrónico de barrido JEOL JSM-5800LV (Japón). Las muestras se secaron a 45°C por 1 semana. Para analizar la sección transversal la película se criofracturó por inmersión en nitrógeno líquido. Las piezas de película se montaron en un porta muestras de aluminio y se recubrieron con una capa de platino, permitiendo la visualización de la superficie y la sección transversal. Todas las muestras se analizaron con un voltaje de aceleración de 10kV. Los análisis se realizaron por triplicado y se tomaron 5 micrografías para cada muestra. Las micrografías de la superficie de las muestras se obtuvieron con una magnificación de 400x y para la sección transversal con una magnificación de 1000x.
2.5. Análisis estadístico
Las determinaciones se realizaron por quintuplicado. Los resultados se expresaron como medias de los tratamientos ± desviación estándar. El análisis estadístico se llevó a cabo usando un análisis de varianza (ANOVA) y la metodología de superficie de respuesta para la selección de la mejor formulación de película. Los datos se analizaron a través del software Minitab Statistical Versión 16 (Minitab Inc., State College, PA, EUA).
3. Resultados y discusión
A partir del diseño experimental central compuesto planteado con tres variables (concentración de pectina, concentración de glicerol y concentración de aceite esencial de limón) se obtuvieron 20 formulaciones de SF incluyendo 6 puntos centrales para cada extracto péctico, uno de bagazo y otro de pomaza de limón. Las películas obtenidas se evaluaron en función de la permeabilidad al vapor de agua y de la fuerza de tensión con la finalidad de establecer las mejores condiciones a las que se obtiene una mayor resistencia del material y una menor permeabilidad al vapor de agua.
3.1. Propiedades mecánicas
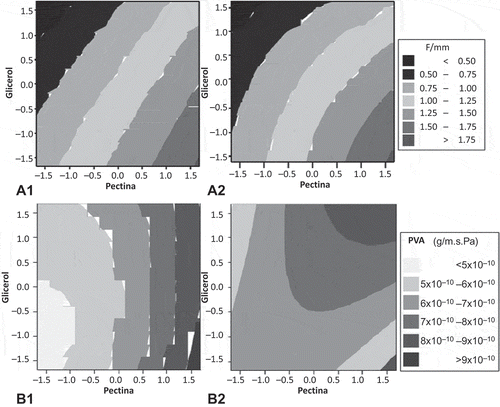
Las propiedades mecánicas reflejan la capacidad de las películas de empaque para mantener la integridad del producto empacado y la resistencia del material. La muestra un resumen del análisis estadístico de la FT y PVA de las películas formuladas. Se puede observar que los efectos significativos del modelo para FT fueron únicamente los efectos lineales de la concentración de pectina y la concentración de glicerol (p < 0,05) para ambos extractos pécticos. La incorporación de aceite esencial de limón no afectó (p > 0,05) la fuerza de tensión de las películas a base de extracto péctico de bagazo ni de pomaza. En la se presentan graficas de contorno de la fuerza de tensión resultante para las películas de extracto péctico de bagazo (A1) y pomaza (A2) a un nivel fijo de aceite esencial de limón (1000 mg/kg). A través de las gráficas de superficie de contorno se puede observar que la TS incrementa con el incremento en la concentración de Pectina. Esto concuerda con los resultados de Aloui, Khwaldia, Slama, and Hamdi (Citation2011), quienes aplicaron recubrimientos de quitosano, hidroxipropil metil celulosa, caseinato de sodio y alginato de sodio sobre papel y reportaron un aumento en la TS al incrementar la concentración del recubrimiento. En nuestro estudio se observa que a bajas concentraciones de glicerol la fuerza de tensión de las películas es mayor. Este comportamiento ya ha sido reportado por varios autores, el incremento en la concentración de plastificante reduce las fuerzas intermoleculares con lo que se aumenta la flexibilidad y se reduce la resistencia de los materiales (Chillo et al., Citation2008; Kaplan et al., Citation1993; López, García, & Zaritzky, Citation2008; Nussinovitch, 2013; Paschoalick, Garcia, Sobral, & Habitante, Citation2003). La mayor resistencia de la película a base extractos pécticos de limón se da a altas concentraciones de pectina y bajas concentraciones de glicerol.
Figura 1. Gráficas de contorno de (A1) FT de películas de extracto péctico BC, (A2) FT de películas de extracto péctico PC, (B1) PVA de películas de extracto péctico de BC y (B2) PVA de películas de extracto péctico de PC (valor fijo de aceite esencial de limón a 1000 mg/kg).
Figure 1. Contour graph (A1) TF of films from BC pectic extract, (A2) TF of films from PC pectic extract, (B1) WVP of films from BC pectic extract and (B2) WVP of films from PC pectic extract (lime essential oil fixed value of 1000 mg/kg).
3.2. Permeabilidad al vapor de agua
La permeabilidad al vapor de agua es una propiedad ampliamente estudiada debido al papel que juega el agua en las reacciones deteriorativas de los alimentos. La permeabilidad del agua está relacionada a la difusividad y a la solubilidad del material en el agua; si el material es altamente soluble en agua, la permeabilidad será menor (Ayranci & Tunc, Citation2003; Rojas-Graü, Tapia, Rodríguez, Carmona, & Martin-Belloso, Citation2007). En ocasiones, esta alta solubilidad en agua de los materiales es deseada, como es el caso en el que la película o el recubrimiento será consumida simultáneamente con el alimento, es decir, cuando el material es aplicado como una matriz comestible.
De igual manera que en la prueba de FT, el aceite esencial de limón no tuvo un efecto significativo en las propiedades de permeabilidad (). El análisis estadístico muestra que solo existen efectos lineales significativos de las variables concentración de pectina y glicerol (p < 0,05) para ambos grupos de películas (BC y PC). Sin embargo, en las películas de PC se observa un efecto cuadrático significativo de la concentración de pectina (p < 0,05) y un efecto significativo en la interacción de pectina*glicerol (p < 0,05).
Tabla 2. Resumen de ANOVA para FT y PVA de películas comestibles.
Table 2. ANOVA summary from edible films TF y WVP.
En la se presentan las gráficas de contorno para la permeabilidad al vapor de agua de las películas formuladas a partir de extracto péctico de bagazo (B1) y pomaza (B2) de limón a una concentración de 1000 mg/kg de aceite esencial de limón. En la se muestra un efecto inverso a la FT, la PVA de las películas de bagazo de limón incrementa con el aumento de la concentración de glicerol. La PVA de las películas incrementa con la concentración de plastificante tal y como lo reportó Khwaldia, Perez, Banon, Desobry, and Hardy (Citation2004) y Chillo et al. (Citation2008). Además, se observa que es posible obtener PVAs más bajas en las películas empleando el extracto péctico de bagazo de limón () que a el extracto péctico de pomaza de limón (). Esto podría deberse a la interacción que pudiera llevarse a cabo entre compuestos fenólicos presentes en el extracto péctico de limón. En un estudio previo (Sánchez-Aldana et al., Citation2013) se encontraron flavonoides en mayor concentración en el extracto péctico de bagazo que de pomaza de limón. Dichos compuestos fueron las flavanonas naringina y hesperidina, encontradas en proporciones de 8,01 mAU en BC y 6,77 mAU en PC. La hesperidina es una de las principales flavanonas que se ha reportado en los cítricos (Wang, Chuang, & Ku, Citation2007). Dicho compuesto puede formar un coloide estable con la pectina debido a su naturaleza glucosídica (Ben-Shalom & Pinto, Citation1999) y por tanto pudiera estar evitando la difusión del vapor de agua a través de la película.
Las PVA más bajas se obtuvieron en las películas formuladas a partir del extracto péctico de bagazo de limón a bajas concentraciones de glicerol y de pectina. La formulación de la película que se seleccionó fue a partir de extracto péctico de bagazo de limón con una concentración de pectina del 1,0% y 0,75% de glicerol, esto de acuerdo a los resultados obtenidos mediante el análisis de superficie de contorno. Además, debido a que no se encontró un efecto significativo en la concentración de aceite esencial de limón se seleccionó la concentración de 500 mg/kg debido a los efectos antibacterianos encontrados en otro estudio realizado por nuestro grupo de investigación (datos no publicados).
3.3. Caracterización de la película seleccionada
Conocer las propiedades del material de empaque es importante para decidir el tipo de matriz alimenticia sobre la cual se va a aplicar. Dichas propiedades ayudan a seleccionar las características del alimento como lo son la humedad, el peso, la vulnerabilidad a reacciones de oxidación, la compatibilidad sensorial, la temperatura a la que se debe almacenar, entre otros, esto con la finalidad de lograr el principal objetivo de una película o recubrimiento comestible, mantener la calidad y prolongar la vida de anaquel del producto alimenticio.
En la se muestra la caracterización de la película seleccionada. Se obtuvo una película con baja humedad. Si las películas se forman únicamente a partir de ingredientes poliméricos estos tienden a ser frágiles y quebradizos, especialmente bajo condiciones de baja humedad. Es por ello la importancia de la adición de plastificantes a la matriz polimérica. No solo los polioles de bajo peso molecular como el glicerol, sorbitol o xilitol (Han & Gennadios, Citation2005) sirven como plastificantes, también el agua residual actúa como tal para películas hidrofílicas (Coupland, Shaw, Monahan, Dolores O’Riordan, & O’Sullivan, Citation2000). Se recomienda que las películas contengan del 5 al 10% de humedad debido a que mayores humedades aumentan la permeabilidad al vapor de agua (Coupland et al., Citation2000).
Tabla 3. Propiedades de la película de BC (pectina 1,0%, aceite esencial de limón 0,05% y glicerol 0,7%).
Table 3. BC Edible film properties (1.0% pectin, 0.05% lime essential oil and 0.7% glycerol).
La densidad de la película a base de extracto péctico de bagazo de limón presentó una densidad menor a películas a base de biomateriales, por ejemplo de almidón de yuca (2.4 g·cm−3) y almidón de yuca y fibra (1,5 g·cm−3) (Müller, Laurindo, & Yamashita, Citation2009) y apenas un poco mayor a la densidad de polímeros sintéticos como el polietileno de alta (0,95 g·cm−3) y de baja densidad (0,91 g·cm−3) (Sperling, 2006). Por otro lado, es importante mencionar que muchas de las propiedades del material dependen del espesor de la película. El espesor de película de BC fue mayor a las películas sintéticas de polietileno de baja densidad que varía desde 15 a 50 μm (Sperling, 2006). Sin embargo, el espesor de la película seleccionada en esta investigación fue menor al espesor de otras películas biodegradables a base puré de mango (170 µm) (Sothornvit & Pitak, Citation2007), pectina (150–250 µm), salvado de arroz (190 µm) (Gnanasambandam, Hettiarachchy, & Coleman, Citation1997), almidón de mango (127 µm) y de plátano (113 µm) (Romero-Bastida et al., Citation2005).
El color de la película de BC se determinó tanto por el lado brillante (lado en contacto con la superficie de secado) y el lado opaco (lado en contacto con el ambiente durante el secado). Ni la ΔE ni la YI presentaron diferencias significativas entre los lados de la película, por lo que el lado de aplicación de la película no afecta las propiedades ópticas del material.
En cuanto a la PVA, se obtuvieron valores similares a otros biomateriales encontrados en la literatura (Garcı́a, Pinotti, Martino, & Zaritzky, Citation2004). Salgado, Molina Ortiz, Petruccelli, and Mauri (Citation2010) reportaron una permeabilidad of 1,4 × 10−10 g·s−1m−1·Pa−1 en una película a base de proteína de girasol, Garcia, Martino, and Zaritzky (Citation2000) prepararon películas de almidón de maíz y sorbitol y encontraron PVA de 1,75 4 × 10−10 g·s−1 m−1·Pa−1.
3.3.1. Análisis termogravimétrico (TGA)
El análisis termogravimétrico determina los cambios de peso de la película con el incremento de la temperatura. El TGA permite conocer la resistencia del material de empaque con la determinación de la variación de peso del material (pérdida o ganancia) en función de la temperatura y el tiempo mientras la muestra es sometida a un incremento controlado de la temperatura (Espitia et al., Citation2014). Esta determinación en las películas define las condiciones de temperatura a la cual el material comienza a descomponerse.
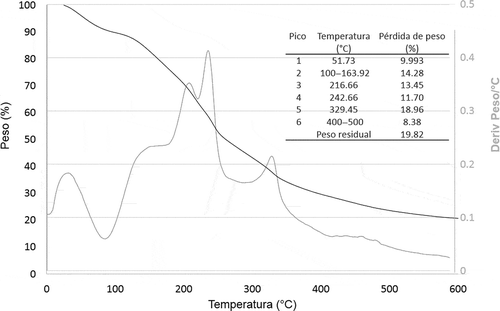
En la se muestran las curvas de pérdida de peso y la derivada de la pérdida de peso/°C en función del incremento de la temperatura. Dichas curvas muestran cinco zonas de pérdida de peso. La primera zona se encuentra por debajo de los 60°C, con una pérdida de peso de casi el 10%, esto posiblemente puede deberse a pérdida de humedad así como a la evaporación del aceite esencial incorporado a la película debido a la alta volatilidad de los compuestos presentes en los aceites esenciales. Hazra, Dollimore, and Alexander (Citation2002) reportan energías de activación de 33,2 y 37,87 kJ·mol −1 para el aceite esencial de limón y el limoneno (principal componente del aceite esencial de limón), lo cual indica que ambos son altamente volátiles desde temperatura ambiente. La pérdida de peso que se da desde los 100 a los 163,92°C es debido a la pérdida de humedad de la muestra, esto pudiendo incluir agua, glicerol u otros alcoholes presentes (por ejemplo, grupos hidroxilo provenientes de azúcares y polifenoles). La tercera zona y la cuarta zona podrían deberse a la degradación de pectinas de cadenas cortas y de cadena larga. El quinto pico puede estar asociado a cadenas ramificadas de polímeros. Finalmente se observan tres fases pérdidas de peso entre los 400 y 500°C que son poco perceptibles en la derivada de Peso/°C, esto puede relacionarse a la degradación de carbón remanente en la muestra. La suma de estas pérdidas representan el 8,38% del peso de la muestra total. Como peso residual de la muestra de película analizada se tuvo un 19,82%.
Figura 2. Curvas de TGA y la derivada de TGA de película de Bc seleccionada.
Figure 2. TGA curve and derived TGA from the selected BC film.
Las zonas de pérdida de peso encontradas anteriormente concuerdan con el análisis realizado por Zhou, Xu, Wang, and Tian (Citation2011), quienes evaluaron el comportamiento de pectina cítrica durante su pirolisis bajo condiciones simuladas del consumo de un cigarro. Encontraron cinco zonas de pérdida de peso, en la primera atribuyen la pérdida de peso entre los 50 y 160°C debido a la perdida de agua. Las dos siguientes zonas entre 200 y 463°C encuentran una pérdida del 58% de la muestra. Esto debido a la serie de reacciones ocurridas durante el proceso, se ha encontrado que la despolimerización de la cadena de polisacárido se lleva a cabo en primer lugar, a continuación, los anillos del ácido galacturónico comienzan a someterse a una amplia degradación térmica, con la evolución de diversos productos gaseosos y la formación de carbón sólido. En dicho intervalo de temperatura, en nuestro estudio se pierden alrededor del 53% del peso de la muestra. Finalmente presentan una degradación térmica desde los 463 °C hasta los 725°C debido a la descomposición del carbón. Las tres rampas de pérdida de peso encontradas en la última zona de nuestro estudio pudiera deberse a la descomposición reportada por Zhou et al. (Citation2011).
3.3.2. Espectroscopia de Infrarrojo por transformada de Fourier (FTIR-ATR)
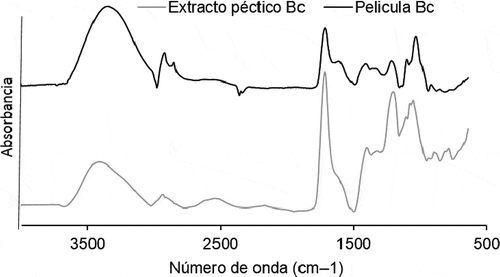
En la se muestra el espectro de FTIR del extracto péctico de bagazo de limón así como el espectro de la película seleccionada (BC 1,0% de pectina, 0,7% de glicerol, 0,05% de aceite esencial de limón). Se puede observar que los dos espectros de FTIR presentan patrones similares de absorbancia. La región encontrada entre los 900 y 1200 cm−1 se identifica como la región de los carbohidratos (Tripathi, Mehrotra, & Dutta, Citation2010). La region de 850 a 1200 cm−1 se identifica como la zona de la cadena principal de ácidos poligalaturónicos. En los espectros pueden observarse las señales tipicas de las pectinas, como la zona en 1750 cm−1 referida como una banda sola aguda correspondiente al grupo carboxilico esterificado (estiramiento C = O) (Černá et al., Citation2003). Este pico es un poco más alto que el encontrado en la región de 1600–1650 cm−1 por el estiramiento del carbonil en el grupo carboxilico (no esterificado). Cuando existe adición de glicerol (en la película) es posible observar bandas más definidas entre 1020 y 1100 cm−1, esto concuerda con Pérez-Mateos et al. (Citation2009), quienes reportaron este mismo efecto esto debido a los enlaces C-OH y C-O-C. Las bandas amplias y cortas 2945 cm−1 corresponten al estiramiento de OH en los grupos carboxilicos (Tripathi et al., Citation2010). Estas bandas se muestran más definidas en el espectro de la película que en el del extracto péctico. De igual manera, la banda encontrada entre 3300 y 3600 cm−1 es más intensa y definida en el espectro de la película, esto puede deberse a la incorporación de glicerol en la película (Thygesen, Løkke, Micklander, & Engelsen, Citation2003).
3.3.3. Microscopia electrónica de barrido (SEM)
La morfología de la superficie y de la sección transversal de la película seleccionada fue examinada mediante SEM (). Las micrografías obtenidas muestran que la superficie de la película es rugosa y heterogénea. Además, a través de las micrografías de la sección transversal se observa que el espesor de la película no es constante y existe variabilidad, además es posible observar poros posiblemente de aire, esto pudo deberse a técnica de preparación de la película, sin embargo, estos poros no atraviesan la película y pudieran estar relacionados con la baja permeabilidad al vapor de agua de la película.
4. Conclusiones
Se seleccionó una película a base de extracto péctico de bagazo de limón la cual fue caracterizada. Dicha caracterización presentó propiedades similares a otras películas reportadas a partir de biomateriales.
Altas concentraciones de pectina y bajas concentraciones de glicerol son deseables para obtener mejores propiedades de permeabilidad y resistencia del material. Se obtuvo una película de características morfológicas heterogénea.
Agradecimientos
El autor D. Sánchez Aldana agradece al Consejo Nacional de Ciencia y Tecnología de México (CONACyT) por el apoyo otorgado a través de la beca de Doctorado. El autor también agradece a la M.C. Shaida Martínez Ramírez por el apoyo en el desarrollo y evaluación de los experimentos y al Centro de Investigación de Materiales Avanzados de Chihuahua (CIMAV) por el análisis de las películas por SEM.
References
- Ahmad, M. M., Iqbal, Z., Anjum, F. M., & Sultan, J. I. (2006). Genetic variability to essential oil composition in four citrus fruit species. Pakistan Journal of Botany, 38(2), 319.
- Aloui, H., Khwaldia, K., Slama, M. B., & Hamdi, M. (2011). Effect of glycerol and coating weight on functional properties of biopolymer-coated paper. Carbohydrate Polymers, 86(2), 1063–1072. doi:10.1016/j.carbpol.2011.06.026
- Alves, V. D., Mali, S., Beléia, A., & Grossmann, M. V. E. (2007). Effect of glycerol and amylose enrichment on cassava starch film properties. Journal of Food Engineering, 78(3), 941–946. doi:10.1016/j.jfoodeng.2005.12.007
- AOAC. (1995). Official method of analysis of AOAC intl (16th ed.). Arlington, VA: Association of Official Analytical Communities.
- Ayranci, E., & Tunc, S. (2003). A method for the measurement of the oxygen permeability and the development of edible films to reduce the rate of oxidative reactions in fresh foods. Food Chemistry, 80(3), 423–431. doi:10.1016/S0308–8146(02)00485–5
- Ben-Shalom, N., & Pinto, R. (1999). Natural colloidal particles: The mechanism of the specific interaction between hesperidin and pectin. Carbohydrate Polymers, 38(2), 179–182. doi:10.1016/S0144–8617(98)00111–8
- Bierhalz, A. C. K., da Silva, M. A., & Kieckbusch, T. G. (2012). Natamycin release from alginate/pectin films for food packaging applications. Journal of Food Engineering, 110(1), 18–25. doi:10.1016/j.jfoodeng.2011.12.016
- Briassoulis, D. (2006). Mechanical behaviour of biodegradable agricultural films under real field conditions. Polymer Degradation and Stability, 91(6), 1256–1272. doi:10.1016/j.polymdegradstab.2005.09.016
- Černá, M., Barros, A. S., Nunes, A., Rocha, S. M., Delgadillo, I., Čopı́ková, J., & Coimbra, M. A. (2003). Use of FT-IR spectroscopy as a tool for the analysis of polysaccharide food additives. Carbohydrate Polymers, 51(4), 383–389. doi:10.1016/S0144–8617(02)00259-X
- Chambi, H. N. M., & Grosso, C. R. F. (2011). Mechanical and water vapor permeability properties of biodegradables films based on methylcellulose, glucomannan, pectin and gelatin. Ciência E Tecnologia De Alimentos, 31(3), 739–746. doi:10.1590/S0101–20612011000300029
- Chen, C. H., & Lai, L. S. (2008). Mechanical and water vapor barrier properties of tapioca starch/decolorized hsian-tsao leaf gum films in the presence of plasticizer. Food Hydrocolloids, 22(8), 1584–1595. doi:10.1016/j.foodhyd.2007.11.006
- Chillo, S., Flores, S., Mastromatteo, M., Conte, A., Gerschenson, L., & Del Nobile, M. A. (2008). Influence of glycerol and chitosan on tapioca starch-based edible film properties. Journal of Food Engineering, 88(2), 159–168. doi:10.1016/j.jfoodeng.2008.02.002
- Coupland, J. N., Shaw, N. B., Monahan, F. J., Dolores O’Riordan, E., & O’Sullivan, M. (2000). Modeling the effect of glycerol on the moisture sorption behavior of whey protein edible films. Journal of Food Engineering, 43(1), 25–30. doi:10.1016/S0260–8774(99)00129–6
- Du, W. X., Olsen, C. W., Avena‐Bustillos, R. J., McHugh, T. H., Levin, C. E., & Friedman, M. (2009). Effects of allspice, cinnamon, and clove bud essential oils in edible apple films on physical properties and antimicrobial activities. Journal of Food Science, 74(7), M372–M378. doi:10.1111/j.1750–3841.2009.01282.x
- Espitia, P. J. P., Du, W. X., Avena-Bustillos, R. D. J., Soares, N. D. F. F., & McHugh, T. (2014). Edible films from pectin: Physical-mechanical and antimicrobial properties-a review. Food Hydrocolloids, 35, 287–296. doi:10.1016/j.foodhyd.2013.06.005
- Garcia, M. A., Martino, M. N., & Zaritzky, N. E. (2000). Microstructural characterization of plasticized starch-based films. Starch – Stärke, 52(4), 118–124. doi:10.1002/1521–379X(200006)52:4<118::AID-STAR118>3.0.CO;2–0
- Garcı́a, M. A., Pinotti, A., Martino, M. N., & Zaritzky, N. E. (2004). Characterization of composite hydrocolloid films. Carbohydrate Polymers, 56(3), 339–345. doi:10.1016/j.carbpol.2004.03.003
- Gnanasambandam, R., Hettiarachchy, N. S., & Coleman, M. (1997). Mechanical and barrier properties of rice bran films. Journal of Food Science, 62(2), 395–398. doi:10.1111/j.1365–2621.1997.tb04009.x
- Guilbert, S., Gontard, N., & Gorris, L. G. (1996). Prolongation of the shelf-life of perishable food products using biodegradable films and coatings. Lwt-Food Science and Technology, 29(1–2), 10–17. doi:10.1006/fstl.1996.0002
- Han, J. H., & Gennadios, A. (2005). Edible films and coatings: A review. Innovations in Food Packaging, 239, 262.
- Hazra, A., Dollimore, D., & Alexander, K. (2002). Thermal analysis of the evaporation of compounds used in aromatherapy using thermogravimetry. Thermochimica Acta, 392–393, 221–229. doi:10.1016/S0040–6031(02)00104–1
- Hernández-Ochoa, L., Gonzales-Gonzales, A., Gutiérrez-Mendez, N., Muñoz-Castellanos, L. N., & Quintero-Ramos, A. (2011). Estudio de la actividad antibacteriana de películas elaboradas con quitosano a diferentes pesos moleculares incorporando aceites esenciales y extractos de especias como agentes antimicrobianos. Revista Mexicana De Ingeniería Química, 10(3), 455–463.
- Kaplan, D. L., Mayer, J. M., Ball, D., McCassie, J., Allen, A. L., & In, S. P. (1993). Biodegradable polymers and packaging. In E. Thomas (Ed.), (pp. 1–42). Lancaster, PA: Technomic Publishing Company.
- Khwaldia, K., Perez, C., Banon, S., Desobry, S., & Hardy, J. (2004). Milk proteins for edible films and coatings. Critical Reviews in Food Science and Nutrition, 44(4), 239–251. doi:10.1080/10408690490464906
- López, O. V., García, M. A., & Zaritzky, N. E. (2008). Film forming capacity of chemically modified corn starches. Carbohydrate Polymers, 73(4), 573–581. doi:10.1016/j.carbpol.2007.12.023
- Ma, Y. Q., Chen, J. C., Liu, D. H., & Ye, X. Q. (2009). Simultaneous extraction of phenolic compounds of citrus peel extracts: Effect of ultrasound. Ultrasonics Sonochemistry, 16(1), 57–62. doi:10.1016/j.ultsonch.2008.04.012
- Mali, S., Grossmann, M. V. E., Garcı́a, M. A., Martino, M. N., & Zaritzky, N. E. (2005). Mechanical and thermal properties of yam starch films. Food Hydrocolloids, 19(1), 157–164. doi:10.1016/j.foodhyd.2004.05.002
- Masmoudi, M., Besbes, S., Chaabouni, M., Robert, C., Paquot, M., Blecker, C., & Attia, H. (2008). Optimization of pectin extraction from lemon by-product with acidified date juice using response surface methodology. Journal of Food Engineering, 78, 693–700.
- Müller, C. M., Laurindo, J. B., & Yamashita, F. (2009). Effect of cellulose fibers addition on the mechanical properties and water vapor barrier of starch-based films. Food Hydrocolloids, 23(5), 1328–1333. doi:10.1016/j.foodhyd.2008.09.002
- Nussinovitch, A. (2012). 13 biopolymer films and composite coatings. In Handbook of biopolymers and biodegradable plastics: Properties, processing and applications, Ebnesajjad, S. (Ed.), MA, USA, (pp. 295–327).
- Osés, J., Fernández, I., Mendoza, M., & Maté, J. (2009). Stability of the mechanical properties of edible films based on whey protein isolate during storage at different relative humidity. Food Hydrocolloids, 23(1), 125–131. doi:10.1016/j.foodhyd.2007.12.003
- Parra, D. F., Tadini, C. C., Ponce, P., & Lugão, A. B. (2004). Mechanical properties and water vapor transmission in some blends of cassava starch edible films. Carbohydrate Polymers, 58(4), 475–481. doi:10.1016/j.carbpol.2004.08.021
- Paschoalick, T. M., Garcia, F. T., Sobral, P. D. A., & Habitante, A. M. Q. B. (2003). Characterization of some functional properties of edible films based on muscle proteins of nile tilapia. Food Hydrocolloids, 17(4), 419–427. doi:10.1016/S0268–005X(03)00031–6
- Pérez-Mateos, M., Montero, P., & Gómez-Guillén, M. C. (2009). Formulation and stability of biodegradable films made from cod gelatin and sunflower oil blends. Food Hydrocolloids, 23(1), 53–61. doi:10.1016/j.foodhyd.2007.11.011
- Rojas-Graü, M. A., Tapia, M. S., Rodríguez, F. J., Carmona, A. J., & Martin-Belloso, O. (2007). Alginate and gellan-based edible coatings as carriers of antibrowning agents applied on fresh-cut fuji apples. Food Hydrocolloids, 21(1), 118–127. doi:10.1016/j.foodhyd.2006.03.001
- Romero-Bastida, C. A., Bello-Pérez, L. A., García, M. A., Martino, M. N., Solorza-Feria, J., & Zaritzky, N. E. (2005). Physicochemical and microstructural characterization of films prepared by thermal and cold gelatinization from non-conventional sources of starches. Carbohydrate Polymers, 60(2), 235–244. doi:10.1016/j.carbpol.2005.01.004
- Salgado, P. R., Molina Ortiz, S. E., Petruccelli, S., & Mauri, A. N. (2010). Biodegradable sunflower protein films naturally activated with antioxidant compounds. Food Hydrocolloids, 24(5), 525–533. doi:10.1016/j.foodhyd.2009.12.002
- Sánchez-Aldana, S., Aguilar, C. N., Nevarez-Moorillon, G. V., & Esquivel, J. C. C. (2013). Comparative extraction of pectic and polyphenols from Mexican lime pomace and bagasse. American Journal of Agricultural and Biological Sciences, 8(4), 309–322. doi:10.3844/ajabssp.2013.309.322
- Siap (2012). Uno de cada cinco mangos mexicanos se consumen en el extranjero. Disemina Estadísticos del sector agroalimentario y pesquero. Publicado el 27 de mayo de 2012. Consultado el 13 de noviembre de 2013 Consultado en: http://www.siap.gob.mx/opt/123/77/76.html
- Sothornvit, R., & Pitak, N. (2007). Oxygen permeability and mechanical properties of banana films. Food Research International, 40(3), 365–370. doi:10.1016/j.foodres.2006.10.010
- Sperling, L. H. (2005). Introduction to physical polymer science. Hoboken, New Jersey: John Wiley & Sons, Inc.
- Stevens, M. P. (1993). Polymer additives: Part I. mechanical property modifiers. Journal of Chemical Education, 70(6), 444–447. doi:10.1021/ed070p444
- Talja, R. A., Helén, H., Roos, Y. H., & Jouppila, K. (2007). Effect of various polyols and polyol contents on physical and mechanical properties of potato starch-based films. Carbohydrate Polymers, 67(3), 288–295. doi:10.1016/j.carbpol.2006.05.019
- Thygesen, L. G., Løkke, M. M., Micklander, E., & Engelsen, S. B. (2003). Vibrational microspectroscopy of food. Raman vs. FT-IR. Trends in Food Science & Technology, 14(1–2), 50–57. doi:10.1016/S0924–2244(02)00243–1
- Tripathi, S., Mehrotra, G. K., & Dutta, P. K. (2010). Preparation and physicochemical evaluation of chitosan/poly (vinyl alcohol)/pectin ternary film for food-packaging applications. Carbohydrate Polymers, 79(3), 711–716. doi:10.1016/j.carbpol.2009.09.029
- Wang, Y. C., Chuang, Y. C., & Ku, Y. H. (2007). Quantitation of bioactive compounds in citrus fruits cultivated in Taiwan. Food Chemistry, 102(4), 1163–1171. doi:10.1016/j.foodchem.2006.06.057
- Zamudio-Flores, P. B., Romero-Bastida, C. A., Hernández-Uribe, J. P., Bello-Pérez, L. A., & Vargas-Torres, A. (2007). Caracterización parcial de películas preparadas con almidón oxidado de plátano. Agrociencia, 41(8), 837–844.
- Zhou, S., Xu, Y., Wang, C., & Tian, Z. (2011). Pyrolysis behavior of pectin under the conditions that simulate cigarette smoking. Journal of Analytical and Applied Pyrolysis, 91(1), 232–240. doi:10.1016/j.jaap.2011.02.015