Figures & data
Figure 1. Pre-pressing separation technology. Flesh pulp (a), apple juices obtained by traditional pressing method and pre-pressing separation technology, respectively (b), and apple peel pomace (c).
Figura 1. Tecnología de separación con previo prensado. Pulpa (a), zumos de manzana obtenidos con el método tradicional de prensado y la tecnología de separación con previo prensado, respectivamente (b) y orujo de piel de manzana (c).

Figure 2. The HPLC chromatograms of PMP derivatives of 9 standard monosaccharides (a) and component monosaccharides released from APP (b). Peaks: 1 mannose, 2 rhamnose, 3 glucuronic acid, 4 galacturonic acid, 5 glucose, 6 xylose, 7 galactose, 8 arabinose, 9 fucose (internal standard).
Figura 2. Cromatogramas HPLC de los derivados de PMP de 9 monosacáridos estándar (a) y componentes de monosacáridos liberados de APP (b). Picos: 1 manosa, 2 ramnosa, 3 ácido glucurónico, 4 ácido galacturónico, 5 glucosa, 6 xilosa, 7 galactosa, 8 arabinosa, 9 fucosa (estándar interno).
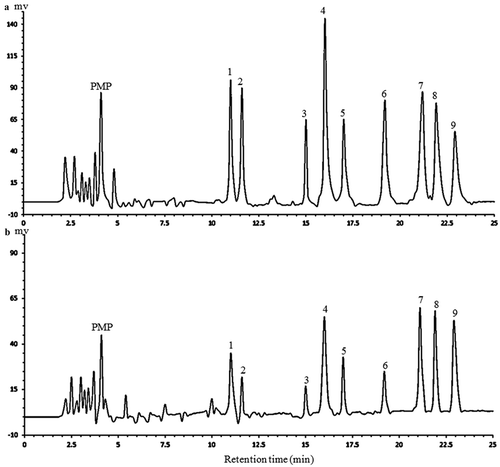
Figure 3. Typical chromatograms of monosaccharides in monosaccharide standards mix (a) and APP (b) analysed by GC–MS. Peaks are 1 rhamnose, 2 fucose, 3 arabinose, 4 xylose, 5 galacturonic acid, 6 glucuronic acid, 7 inositol (internal standard), 8 mannose, 9 glucose, 10 galactose.
Figura 3. Cromatogramas típicos de monosacáridos en mezcla estándar de monosacáridos (a) y APP (b) analizados mediante GC-MS. Los picos son 1 ramnosa, 2 fucosa, 3 arabinosa, 4 xilosa, 5 ácido galacturónico, 6 ácido glucurónico, 7 inositol (estándar interno), 8 manosa, 9 glucosa, 10 galactosa.
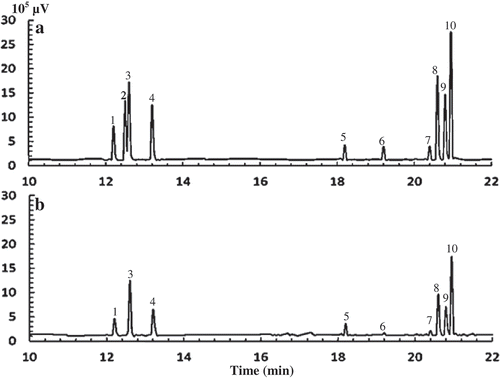
Figure 4. FT-IR spectrum of APP in the frequency range of 4000–500 cm−1.
Figura 4. Espectro FT-IR de APP en un rango de frecuencia de 4000–500 cm−1.
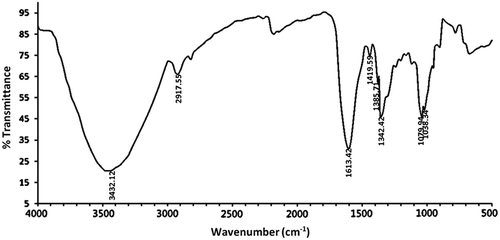
Figure 5. Gel permeation chromatograms and molecular distributions of three APP fractions. The gradient elution curve of purified APP on a Cellulose DEAE-52 column with 0–0.5 M NaCl solution (a); the elution curves of APP-1 (b), APP-2 (c) and APP-3 (d) on a Sephadex G-150 column with distilled water; the average molecular distributions of APP-1 (e), APP-2 (f) and APP-3 (g).
Figura 5. Cromatogramas de permeación en gel y distribuciones moleculares de tres fracciones de APP. La curva de elución en gradiente de APP en la columna Celulosa DEAE-52 con solución 0–0,5 M de NaCl (a); Las curvas de elución de APP-1 (b), APP-2 (c) y APP-3 (d) en la columna Sephadex G-150 con agua destilada; Las distribuciones moleculares medias de APP-1 (e), APP-2 (f) y APP-3 (g).
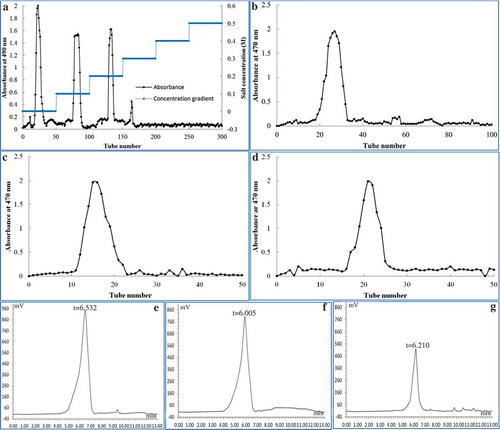
Table 1. Effects of APP on body weight, liver weight and hepatosomatic index (HI) of mice after treatment with CCl4.
Tabla 1. Efectos de APP en el peso corporal, peso del hígado e índice hepatosomático (HI) de ratones después del tratamiento con CCl4.
Figure 6. In vitro antioxidant activities of APP determined using ferric reducing powder assay (a), DPPH• scavenging assay (b), HO• scavenging assay (c) and O2•− scavenging assay (d). Vc was used as positive control.
Figura 6. Actividad antioxidante in vitro de APP determinada utilizando el ensayo de poder reductor férrico (a), el ensayo de barrido DPPH• (b), el ensayo de barrido HO• (c) y el ensayo de barrido O2•− (d). Vc se utilizó como control positivo.
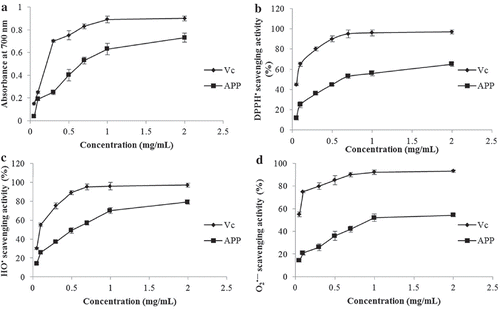
Figure 7. Effects of APP on the enzymic activities of ALT (a), AST (b) and LDH (c) in serum and on the level of hepatic MDA (d) after treatment with CCl4 in mice. All the values are expressed as mean ± SD (n = 10). Mice were treated intragastrically with APP (150, 300 and 450 mg/kg bw) and BP (450 mg/kg bw) once a day for 7 consecutive days before a single administration of 0.8% CCl4. ##p < 0.01, significantly different compared to the normal group. *p < 0.05, **p < 0.01, significantly different compared to the CCl4-intoxicated group.
Figura 7. Efecto de APP en la actividad enzimática de ALT (a), AST (b) y LDH (c) en suero y en el nivel de MDA hepático (d) después del tratamiento con CCl4 en ratones. Todos los valores se expresan como promedio ± SD (n = 10). Los ratones fueron tratados intragástricamente con APP (150, 300 y 450 mg/kg bw) y BP (450 mg/kg bw) una vez al día durante 7 días consecutivos antes de una única administración de 0,8% de CCl4. ##p < 0,01, significativamente diferente en comparación con el grupo normal. *p < 0,05 **p < 0,01, significativamente diferente en comparación con el grupo intoxicado con CCl4.
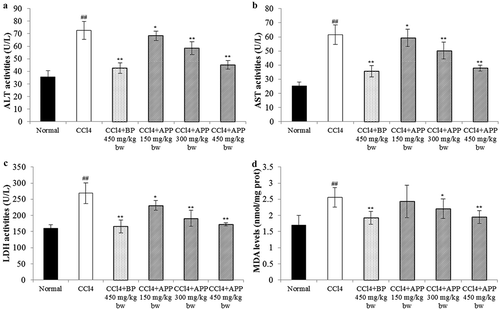
Figure 8. Effects of APP on the enzymic activities of GSH-Px (a) and SOD (b) in mice liver tissues after treatment with CCl4. All the values are expressed as mean ± SD (n = 10). Mice were treated intragastrically with APP (150, 300 and 450 mg/kg bw) and BP (450 mg/kg bw) once a day for 7 consecutive days before a single administration of 0.8% CCl4. ##p < 0.01, significantly different compared to the normal group. *p < 0.05, **p < 0.01, significantly different compared to the CCl4-intoxicated group.
Figura 8. Efectos de APP en la actividad enzimática de GSH-Px (a) y SOD (b) en los tejidos de hígado de ratón después del tratamiento con CCl4. Todos los valores se expresan como promedio ± SD (n = 10). Los ratones fueron tratados intragástricamente con APP (150, 300 y 450 mg/kg bw) y BP (450 mg/kg bw) una vez al día durante 7 días consecutivos antes de una única administración de 0,8% de CCl4. ##p < 0,01, significativamente diferente en comparación con el grupo normal. *p < 0,05 **p < 0,01 significativamente diferente en comparación con el grupo intoxicado con CCl4.
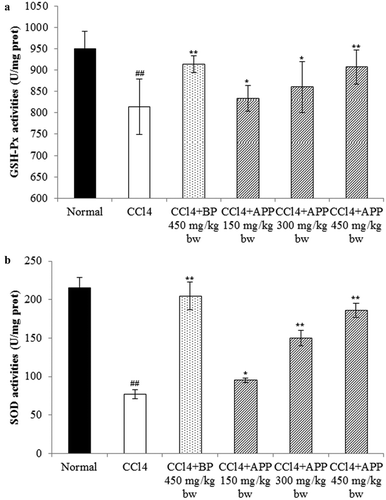
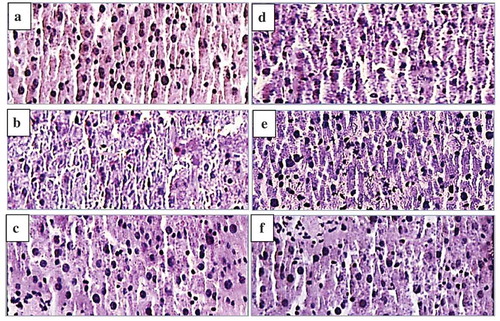
Figure 9. Effect of APP on liver histopathology of mice using H & E staining (original magnification of 400 times). Liver tissues of normal mice (a), Vehicle + CCl4 group (b), BP (450 mg/kg bw) + CCl4 group (c), APP (150 mg/kg bw) + CCl4 group (d), APP (300 mg/kg bw) + CCl4 group (e), APP (450 mg/kg bw) + CCl4 group (f).
Figura 9. Efecto de APP en la histopatología de hígado de ratón utilizando coloración H y E (ampliación original de 400 veces). Los tejidos del hígado de ratones normales (a), Vehículo + grupo CCl4 (b), BP (450 mg/kg bw) + grupo CCl4 (c), APP (150 mg/kg bw) + grupo CCl4 (d), APP (300 mg/kg bw) + grupo CCl4 (e), APP (450 mg/kg bw) + grupo CCl4 (f).