Figures & data
Table 1. Purification efficiency for nattokinase at different scale.
Tabla 1. Eficiencia de purificación para la nattoquinasa a diferentes escalas.
Figure 1. Elution profile of nattokinase by Q-HP chromatography at analytical scale; the fraction with specific activity was collected from 8 to 23 mL as unbound part (a), and elution profile of sephacryl-100 chromatography by the analytical level (b).
Figura 1. Perfil de elución de la nattoquinasa por cromatografía Q-HP a escala analítica; la fracción con actividad específica se recogió de 8–23 ml como parte no unida (a), y el perfil de elución de la cromatografía en Sefacril-100 según el nivel analítico (b).
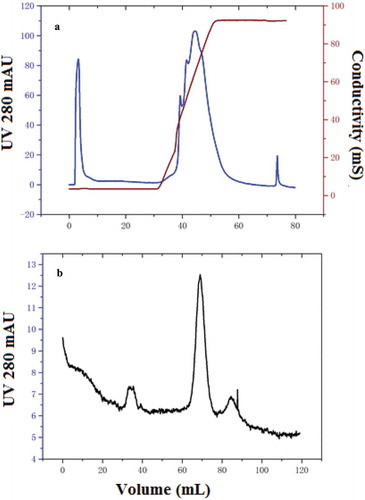
Figure 2. Elution profile of nattokinase by Q-HP chromatography at four and sixtyfold amplification; at fourfold, the fraction with specific activity was collected from 35 to 90 mL as unbound part (a), and elution profile of sephacryl-100 chromatography (b), at sixty fold, fraction with specific activity was collected from 550 to 1450 mL as unbound part (c), and elution profile of sephacryl-100 chromatography (d).
Figura 2. Perfil de elución de la nattoquinasa por cromatografía Q-HP en amplificación a 4 y 60 veces; a 4 veces se recogieron de 35–90 ml la fracción con actividad específica como parte no unida (a) y el perfil de elución de la cromatografía en Sefacril-100 (b); a 60 veces se recogieron de 550–1 450 ml la fracción con actividad específica como parte no unida (c) y el perfil de elución de la cromatografía en Sefacril-100 (d).
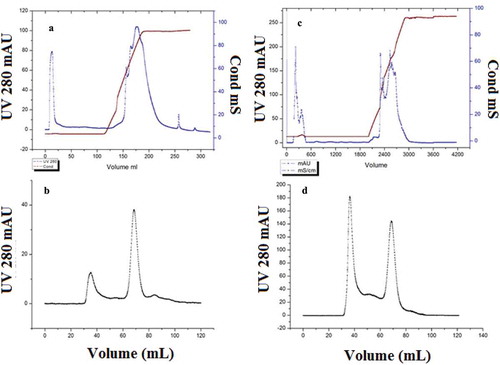
Figure 3. Purity test of ultra-filtration refined nattokinase which collected from Q-HP chromatography at sixty-fold amplification by sephacryl-100 chromatography (a) and purity test of ultra-filtration refined nattokinase by sodium dodecyl sulfate polyacrylamide gel electrophoresis SDS-PAGE (b).
Figura 3. Prueba de pureza de la nattoquinasa refinada con ultrafiltración, obtenida de la cromatografía Q-HP a una amplificación de 60 veces mediante cromatografía en Sefacril-100 (a) y prueba de pureza de la nattoquinasa refinada con ultrafiltración mediante electroforesis en gel de poliacrilamida con dodecil sulfato de sodio SDS-PAGE (b).
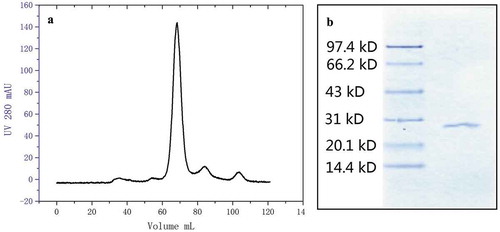
Table 2. Purification efficiency of fibrinolytic enzymes from Bacillus spp. at analytical level.
Tabla 2. Eficiencia de purificación de enzimas fibrinolíticas de Bacillusspp. a nivel analítico.
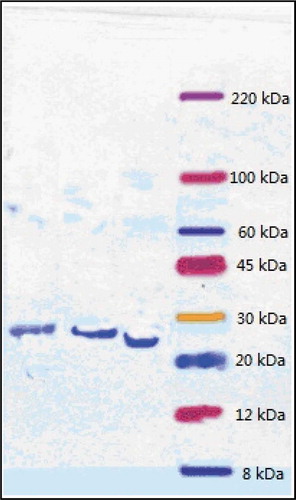
Figure 4. Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) results of fibrinolytic enzymes from different sources (From left to right: Fibrinolytic enzymes produced by Bacillus cereus, Bacillus amyloliquefaciens, and Bacillus tequilensis).
Figura 4. Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE); resultados de las enzimas fibrinolíticas de diferentes fuentes (de izquierda a derecha: enzimas fibrinolíticas producidas por Bacillus cereus, Bacillus amyloliquefaciens y Bacillus tequilensis).