Figures & data
Figure 1. Oats globulin DH changes during hydrolysis by alcalase at different E/S ratios.
Figura 1. Cambios de DH de globulina de avena durante la hidrólisis por subtilisina a diferentes ratios E/S
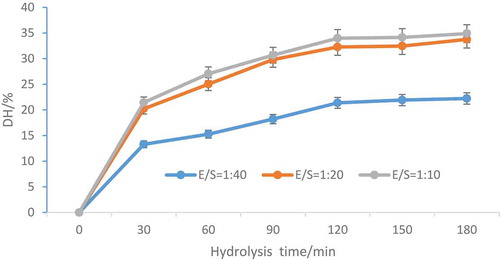
Figure 2. The peptide yield with different hydrolysis time.
Figura 2. Rendimiento del péptido con diferentes tiempos de hidrólisis
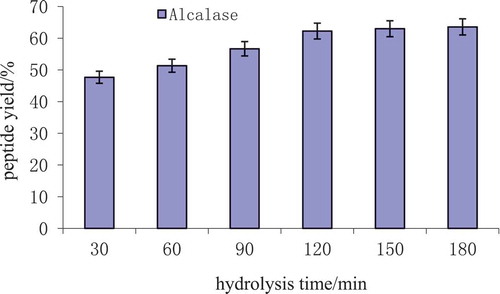
Figure 3. Free radical scavenging activity of oats globulin hydrolysates.
Figura 3. Actividad de eliminación de radicales libres de hidrolizados de globulina de avena
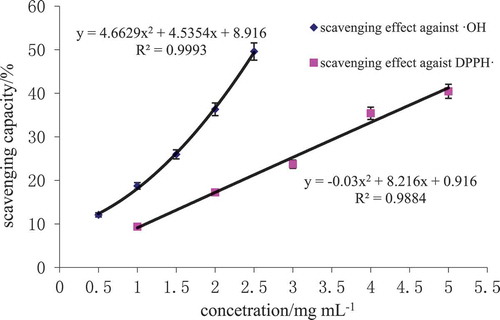
Figure 4. Antioxidant activity of ultrafiltration components.
Figura 4. Actividad antioxidante de los componentes de ultrafiltración
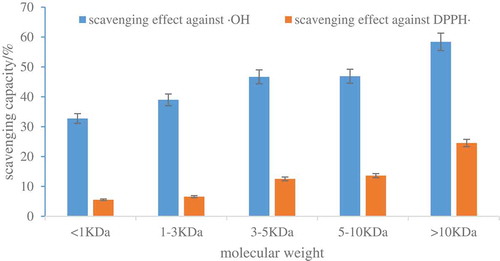
Table 1. IC50 of three fractions purified by ion-exchange chromatography in free radical scavenging assays.
Tabla 1. IC50 de tres fracciones purificadas por cromatografía de intercambio iónico en ensayos de eliminación de radicales libres
Figure 5. Purification of oats globulin hydrolysates through ion-exchange chromatography.
Figura 5. Purificación de hidrolizados de globulina de avena mediante cromatografía de intercambio iónico
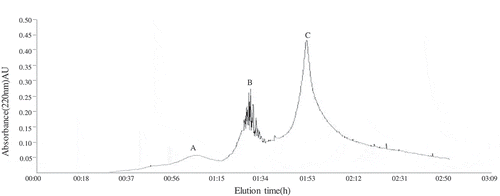
Figure 6. (a) Hydroxyl radical scavenging activity of three fractions after ion exchange purification. (b) DPPH radical scavenging activity of three fractions after ion exchange purification.
Figura 6. (a) Actividad de eliminación de radicales de hidroxilo de tres fracciones después de la purificación por intercambio iónico. (b) Actividad de eliminación de radicales DPPH de tres fracciones después de la purificación por intercambio iónico
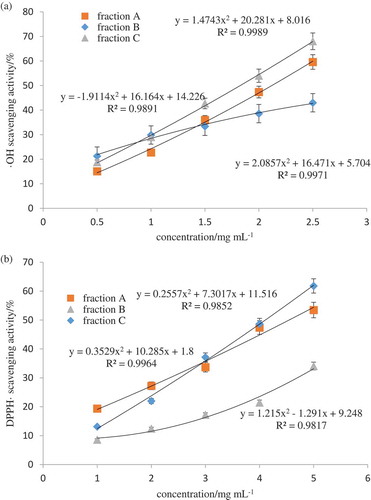
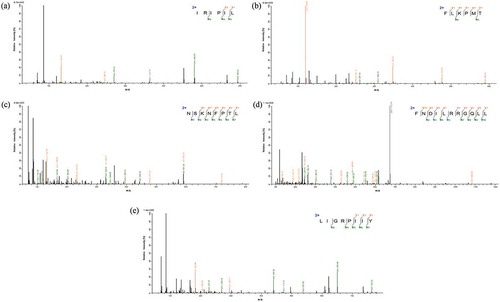
Figure 7. (a) MS/MS spectrum of the peptide IRIPIL. (b) MS/MS spectrum of the peptide FLKPMT. (c) MS/MS spectrum of the peptide NSKNFPTL. (d) MS/MS spectrum of the peptide LIGRPIIY. (e) MS/MS spectrum of the peptide FNDILRRGQLL.
Figura 7. (a) Espectro MS/MS del péptido IRIPIL. (b) Espectro MS/MS del péptido FLKPMT. (c) Espectro MS/MS del péptido NSKNFPTL. (d) Espectro MS/MS del péptido LIGRPIIY. (e) Espectro MS/MS del péptido FNDILRRGQLL