Abstract
Thermal and structural properties of native maize starch were measured from solution mixtures with L-α-lisophosphatydilcholine (LPC) (16.66%; 13.04%; 9.09%; 4.76%; and 0% w/w of starch), water concentration was of 80% (w/w). Differential Scanning Calorimetry (DSC) and Environment Scanning Electron Microscopy (ESEM) techniques were applied. By using DSC it was not possible to detect formation of the starch-LPC complex in starch without LPC exogenous (0% LPC). ΔH gelatinization varies with respect to LPC concentration; at low concentration levels it was observed to decrease, whereas at high concentration levels of LPC, it increased up to a level above the initial value (0% LPC). This is in agreement with the results obtained by ESEM, since a granular structure was still observed in the starch at 100 °C, which was more evident towards a LPC concentration increment.
Se midieron las propiedades térmicas y estructurales del almidón nativo de maíz en mezclas con L-α-lisofosfatidil colina (LPC) en solución (16,66%; 13,04%; 9,09%; 4,76% y 0% en función del peso de almidón), la concentración de agua fue del 80% (% p/p). Se usó calorimetría diferencial de barrido y microscopía electrónica de barrido ambiental (DSC y ESEM respectivamente, por sus siglas en inglés). El DSC no detectó la presencia del complejo almidón-LPC, en las muestras de almidón sin LPC exógena (0% LPC). El ΔH de gelatinización varía con la concentración de LPC: a bajas concentraciones se observó que disminuye, mientras que a altas concentraciones de LPC, aumenta hasta superar el valor inicial (0% LPC). Lo cual esta de acuerdo con los resultados obtenidos por ESEM, ya que se observó una estructura granular remanente en el almidón aún a 100 °C, la cual fue más evidente a medida que aumentó la concentración de LPC.
Palabras clave:
Introducción
En la ciencia e ingeniería de materiales, se ha demostrado que para estudiar los polímeros sintéticos, es de suma importancia conocer: el grado de polimerización (DPn), el peso molecular promedio en número, así como la presencia de grupos polares o anillos y de moléculas ajenas al polímero en estudio. Exactamente las mismas consideraciones se tienen que hacer para estudiar el caso de los biopolímeros y sus implicaciones en la ciencia de los alimentos, concretamente de los gránulos de almidón, debido a que éste está conformado de dos polímeros llamados amilosa y amilopectina. Ambas macromoléculas son las que contribuyen mayoritariamente en las propiedades fisicoquímicas del almidón (Biliaderis, Citation1991a; Biliaderis, Citation1992). Se ha considerado que la amilosa es responsable de las regiones amorfas del gránulo debido a los enlaces α-1-4, mientras que la amilopectina (α-1-4 y α-1-6) alberga la parte cristalina del mismo, debido a que da lugar a la formación de dobles hélices de cadenas ramificadas de bajo DPn.
Atwell, Hood, Lineback, Varriano-Marston y Zobel (Citation1988), propusieron definiciones más precisas de los términos usados comúnmente en el almidón que son: gelatinización, gelación (pasting) y retrogradación. Los autores definen al fenómeno de gelatinización como el proceso hidrotérmico en el cual los gránulos de almidón pierden su estructura granular; el segundo fenómeno es definido como el proceso de asociación en dobles hélices de las moléculas de amilosa, liberadas durante el proceso de gelatinización del gránulo, lo cual da lugar a la formación de una red tridimensional. Mientras que el fenómeno de retrogradación es el término empleado para describir la reorganización molecular principalmente de la amilopectina, asociada al proceso de envejecimiento en los productos hechos a base de almidón. Cabe mencionar que los fenómenos anteriores son procesos hidrotérmicos, es decir, en ausencia de agua y de temperatura no pueden llevarse acabo.
La interacción entre el almidón y los lípidos ha sido estudiada previamente por DSC (Biliaderis, Citation1992; Jovanovich, Zamponi, Lupano, & Añon Citation1992; Eliasson Citation1994). De acuerdo a estos estudios, la transición térmica de los complejos amilosa-lípido depende de la longitud de cadena del ácido graso; la cabeza polar del lípido; el contenido de humedad y el tipo de almidón. Atkin, Cheng, Abeyssekera y Robards (Citation1999), reportaron que en la estructura del almidón se pueden distinguir tres regiones de distinto orden: región cristalina (doble hélice); amorfa (puntos de ramificación y regiones de amilosa); y una tercera región que está constituida por el complejo de inclusión almidón-lípido. Con respecto a este último aspecto, el papel de los lípidos tanto exógenos como endógenos es de especial importancia en la industria de los alimentos, principalmente porque confieren estabilidad granular, también pueden influenciar propiedades tales como la temperatura de gelatinización, absorción de agua, viscosidad y lixiviación de carbohidratos solubles (Kaukovirta-Norja, Reinikainen, Olkku, & Laakso Citation1997; Kitahara, Tanaka, Suganuma, & Nagahama, Citation1997; Lin & Czuchajowska, Citation1998). Todas estas propiedades son de suma importancia en el proceso de elaboración de productos elaborados a base de almidón, tales como panes, tortillas, etc.
Cui y Oates (Citation1999) dieron evidencias de que entre los siguientes lípidos: lisofosfatidilcolina (LPC), monomiristina, monopalmitina y monoestearina, la LPC mostró la más alta habilidad de acomplejamiento y menor susceptibilidad al ataque enzimático de la α-amilasa pancreática porcina, mientras que la de los monoglicéridos decrece con el incremento de la longitud de cadena del ácido graso. Estos investigadores demostraron también que la biodisponibilidad del almidón de sagu nativo y gelatinizado, disminuye con la presencia de los lípidos; así como también, que la cantidad de material lixiviado se ve reducido con estos mismos compuestos. La LPC es el principal componente de los lípidos polares presentes en el almidón de cereales y particularmente en el almidón de maíz (Morrison, Citation1988; Morrison, Tester, Snape, Law, & Gidley, Citation1993).
En algunos casos es importante estudiar el efecto que tienen los lípidos al mezclarlos con la amilosa o bien la amilopectina en forma pura, para lo cual se tienen que separar dichos biopolímeros (Godet, Visto, & Buleon, Citation1995; Liu, Arntfiel, Holley, & Aime, Citation1997). En contraste con lo anterior, la interacción entre los lípidos y el almidón se da en el estado granular del mismo, de tal manera que para estudiar los efectos existentes entre ambos materiales se observa que dichos experimentos tienen que realizarse bajo condiciones reales, de modo que estos estudios tengan una aplicación en sistemas alimenticios de interés. Este enfoque se da considerando el gran uso que ha tenido el almidón en los diferentes sectores industriales, así como la necesidad de tener almidones modificados con nuevas propiedades fisicoquímicas y funcionales. El objetivo de este trabajo fue evaluar los cambios en las propiedades térmicas y estructurales del almidón en función de la concentración de LPC exógeno.
Materiales y métodos
Materiales
Se utilizó almidón de maíz normal nativo (No. de catálogo S-4126), así como también L-α-Lisofosfatidilcolina (LPC, No. de catálogo L0906), ambos marca Sigma. Se prepararon soluciones de agua desionizada con LPC a concentraciones de: 16,66%; 13,04%; 9,09%; 4,76% y 0% (% p/p) respecto al peso del almidón (base seca).
Métodos
Calorimetría diferencial de barrido (DSC)
Para la determinación de las transiciones de fase asociadas al fenómeno de gelatinización, formación y disociación del complejo almidón-lípido, así como para dar un pre-tratamiento térmico a las muestras que fueron observadas en ESEM, se utilizó un calorímetro diferencial de barrido DSC modelo 822E (marca Mettler Toledo). La calibración se realizó de acuerdo a los manuales de operación de dicho equipo, utilizando como estándares para temperatura: Indio (To = 156,6 °C) y Zinc (To = 421 °C). Para el flujo de calor se usó solamente Indio (ΔH = 28,4 J/g), dicha calibración se realizó sólo cuando el equipo presentaba una desviación mayor a 0,5 °C ó 0,4 J/g. Para verificar el estado del equipo se usó solamente Indio, utilizándose en ambos casos las siguientes condiciones: crisoles de aluminio estándar de 40 μL (Mettler Toledo; No. Catálogo ME-27331) sellados herméticamente (Mettler Toledo), uno con el estándar y el otro de referencia (vacío). Se utilizó un flujo de 20 mL/min de nitrógeno para homogenizar la conductividad térmica dentro de la celda del equipo.
Para la determinación de las transiciones de fase de gelatinización, disociación y formación del complejo almidón-LPC, las muestras se prepararon de la siguiente manera: se pesaron aproximadamente cuatro mg de almidón (Balanza AX205, marca Mettler Toledo) en los crisoles de acero inoxidable de media presión (Mettler Toledo, Catálogo No. ME-26929) previamente tarados. Se adicionó la solución de LPC (relación 1:4) correspondiente con ayuda de una micro-jeringa, posteriormente se sellaron los crisoles y se analizaron en el DSC, empleando el siguiente programa de calentamiento y enfriamiento: calentamiento de 30–130 °C; isotérmico por 2 min a 130 °C; enfriamiento de 130–30 °C; nuevamente un isotérmico por 2 min a 30 °C; finalmente un segundo calentamiento de 30–130 °C. La velocidad de calentamiento y de enfriamiento usada en todos los casos fue de 2 °C/min. Todos los análisis se corrieron por triplicado. El cálculo de las temperaturas características y las energías de transición se realizaron utilizando el software STARe Version 8.10 (Mettler Toledo, Columbus, OH, USA).
Microscopía electrónica de barrido ambiental (ESEM)
Los crisoles de aluminio de 40 μL se utilizaron para aplicar a los almidones en presencia de LPC un pre-tratamiento térmico a fin de observar los cambios morfológicos que sufre el almidón por efecto de la concentración de LPC empleada, usando el análisis de ESEM. Dicho pre-tratamiento se realizó desde temperatura ambiente hasta alcanzar la temperatura deseada (40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125 y 130 °C). Todos los pre-tratamientos se realizaron a una velocidad de calentamiento de 2 °C/min. Después de realizado el pre-tratamiento, las muestras se congelaron a −20 °C por 2 h para congelar el agua contenida en las muestras. Posteriormente se secaron en una liofilizadora a −48 °C y 90 mbar (marca Labconco, modelo Freezone 4.5) (Toro-Vazquez et al., Citation2003).
Todas las muestras pre-tratadas fueron analizadas en un microscopio electrónico de barrido ambiental (ESEM) marca Phillips, modelo XL30. Las condiciones bajo las cuales se observaron las muestras fueron: 1500X y 15KV a bajo vacío para evitar sobrecarga de electrones secundarios, se tomaron tres micrografías por muestra en distintas zonas. Las muestras se depositaron en una cinta de carbono de doble cara sin recubrimiento con Oro, para no inducir ningún cambio fisicoquímico superficial por efecto del proceso de recubrimiento.
Análisis estadístico
El análisis de varianza de una sola vía de los resultados obtenidos se realizó usando el software Statistica versión 6.0 (Statsoft Inc., Tulsa, OK, USA, 1997), trabajando con un 95% de confiabilidad. La comparación de medias se realizó usando la prueba de comparación de Duncan con un nivel de significancia del 5%.
Resultados y discusión
Calorimetría diferencial de barrido (DSC)
En las Figuras y se muestran algunos de los termogramas (0% y 16,66% de LPC) obtenidos en el DSC. Tanto en la y se muestran tres curvas correspondientes al primer calentamiento, enfriamiento y segundo calentamiento. Las temperaturas características de gelatinización (To, Tp y Tf) se muestran en la para todas las concentraciones usadas. Se observa que existe una tendencia a aumentar el valor de la temperatura inicial de gelatinización, conforme se aumenta la concentración de LPC. Este comportamiento puede ser debido al efecto protector del lípido mediante la formación de complejos en la superficie de los gránulos del almidón, lo cual hace que la temperatura de fusión se desplace a la derecha, de tal manera que el porcentaje de incremento de la temperatura de fusión es entre el 16,66% y 0% de LPC equivalente al 3,9%. En la literatura (Eliasson, Citation1994; Godet et al., Citation1995; Liu et al., Citation1997) se ha descrito que la formación del complejo almidón-lípido inicia justamente después de que se ha alcanzado la temperatura inicial de gelatinización (To), que es donde el hinchamiento de los gránulos es irreversible y que a partir de dicha temperatura se comienza a liberar amilosa, lo cual da lugar a la formación de los complejos enunciados (Jovanovich et al., Citation1992). Los resultados mostrados en las Figuras y dan evidencia de que lo anteriormente expuesto no sucede en el almidón de maíz, ya que de acuerdo con los datos obtenidos, se observa que la formación del complejo almidón-LPC comienza en etapas anteriores al inicio de la gelatinización del gránulo de almidón.
Figura 1. Termogramas del almidón de maíz en función de la concentración de LPC. (a) 0% de LPC y (b) 16.66% LPC.
Figure 1. Thermograms of corn starch in function of LPC concentration. (a) 0% of LPC, and (b) 16.66% of LPC.
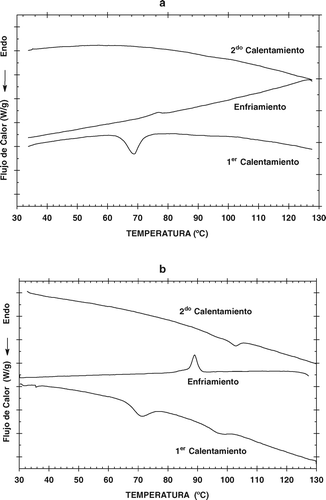
Figura 2. Temperaturas y entalpías de gelatinización del almidón de maíz obtenidas en función de la concentración de LPC. Temperatura de inicio (To), Temperatura máxima (Tp), Temperatura final (Tf) y Entalpia de transición (ΔH).
Figure 2. Temperatures and enthalpies of gelatinization of corn starch obtained in function of LPC concentration. Onset temperature (To), Peak Temperature (Tp), End temperature (Tf) and Transition enthalpy (ΔH).
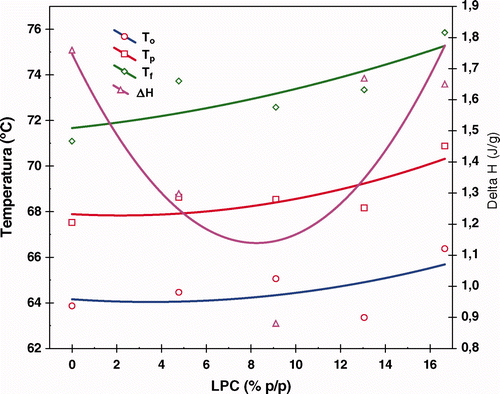
Si se hace la consideración que los complejos de inclusión se forman entre la amilosa y el lípido solamente, entonces dichos complejos se forman antes de que ocurra el fenómeno de gelatinización, lo cual ocasiona que la temperatura inicial de dicho fenómeno se desplace a valores más altos conforme se aumenta la concentración del lípido. Las temperaturas características de transición de fase de todos los eventos térmicos encontrados fueron modificadas en función de la concentración del fosfolípido usado (; Tablas , y ).
El análisis de resultados se centra justamente donde comienzan y terminan los fenómenos térmicos mostrados en los termogramas. En el termograma obtenido al 0% de LPC (), no se observa el segundo pico que aparece cuando se le adiciona el LPC al almidón a distintas concentraciones, atribuido a la disociación del complejo almidón-lípido. Sin embargo, durante el enfriamiento, se observa la presencia de un pequeño pico exotérmico, esto realmente indica la cristalización del complejo que se formó entre las moléculas de amilosa y amilopectina que componen al almidón y los lípidos endógenos, los cuales están asociados con el gránulo mismo (Morrison et al., Citation1993). Este fenómeno es más evidente a medida que la concentración de LPC se incrementa (). De hecho la exoterma de cristalización se va perfeccionando a medida que se aumenta la concentración del fosfolípido. En el segundo calentamiento, se observa un pico de fusión, de acuerdo a los valores de las temperaturas obtenidas, se puede asumir que este pico es el mismo que aparece en el primer calentamiento, entonces se puede afirmar que la segunda transición de disociación del complejo almidón-lípido, es una transición reversible. Esto contrasta con la fase de gelatinización, puesto que es considerado un proceso irreversible, aunque no lo es del todo, pues la retrogradación en realidad mide el grado de reversibilidad mediante la medición de la reorganización molecular en periodos largos. Por lo anterior, se ha denominado que la gelatinización es un proceso metaestable (Biliaderis, Citation1991b). Los resultados obtenidos de las entalpías de formación y disociación del complejo almidón-lípidos durante el análisis térmico están de acuerdo con los datos reportados por Toro-Vazquez et al. (Citation2003), los cuales presentan las mismas tendencias reportadas por estos investigadores en función de la concentración del fosfolípido añadido (Tablas , y ).
Tabla 1. Temperaturas y entalpías de disociación del complejo almidón-lípido obtenidas en función de la concentración de LPC, primer calentamiento.
Table 1. Temperatures and enthalpies of starch-LPC complex dissociation obtained in function of LPC concentration, first heating.
Tabla 2. Temperaturas y entalpías de formación del complejo almidón-lípido obtenidas en función de la concentración de LPC, enfriamiento.
Table 2. Temperatures and enthalpies of starch-LPC complex formation obtained in function of LPC concentration, cooling.
Tabla 3. Temperaturas y entalpías de disociación del complejo almidón-lípido obtenidas en función de la concentración de LPC, segundo calentamiento.
Table 3. Temperatures and enthalpies of starch-LPC complex dissociation obtained in function of LPC concentration, second heating.
Microscopía electrónica de barrido ambiental (ESEM)
Se partió de las características morfológicas que presenta el almidón de maíz nativo, la cual es poliédrica tendiente a ser esférica (), además presenta una granulometría amplia que oscila aproximadamente entre los 5 y 45 μm. Haciendo el análisis de los cambios morfológicos del almidón de maíz en presencia y ausencia del fosfolípido, se observan diferentes eventos que son de interés tecnológico. A temperaturas por debajo de los 45 °C, no se observan cambios en el tamaño de los gránulos, de hecho este proceso es normal, puesto que al aumentar la temperatura en presencia de agua, los gránulos comienzan a hincharse, pero regresan a su estado normal, pues se trata de un proceso reversible (Toro-Vazquez et al., Citation2003). Esto mismo sucede con y sin presencia del lípido, lo que indica que no hay efecto del lípido en la morfología a bajas temperaturas (Figuras y ). Sin embargo cuando la concentración de LPC es del 16,66%, se observa en la una capa que cubre a los gránulos, dicha capa corresponde a los lípidos adicionados (Toro-Vazquez et al., Citation2003), ya que durante el procedimiento de preparación de las muestras para realizar el análisis de ESEM, los gránulos de almidón no fueron recubiertos con ningún material conductor, para evitar la formación de artefactos superficiales por efecto del recubrimiento, lo cual puede ser tomado como un cambio positivo falso. Sin embargo, este efecto no se observa en las otras concentraciones, esto se contrapone con los resultados que obtuvieron los autores anteriores (Toro-Vazquez et al., Citation2003). La explicación a lo anterior puede deberse al recubrimiento conductor de oro que usaron estos mismos autores para tomar las micrografías.
Figura 3. Micrografías del almidón. (a) Almidón de Maíz Nativo. (b) Almidón calentado a 45 °C. (c) Almidón con LPC al 16.66%, calentado a 45 °C. (d) Almidón calentado a 65 °C. (e) Almidón con LPC al 9.09%, calentado a 65 °C. (f) Almidón con LPC al 16.66%, calentado a 65 °C. (g) Almidón calentado a 75 °C. (h) Almidón con LPC al 9.09%, calentado a 75 °C. (i) Almidón con LPC al 16.66%, calentado a 75 °C. (j) Almidón calentado a 100 °C. (k) Almidón con LPC al 16.66%, calentado a 100 °C.
Figure 3. Micrographs of starch. (a) Native corn starch. (b) Starch heated at 45 °C. (c) Starch with LPC (16.6%) heated at 45 °C. (d) Starch heated at 65 °C. (e) Starch with LPC (9.09%) heated at 65 °C. (f) Starch with LPC (16.6%) heated at 65 °C. (g) Starch at 75 °C. (h) Starch with LPC (9.09% wt/wt) heated at 75 °C. (i) Starch with LPC (16.6% wt/wt) heated at 75 °C. (j) Starch heated at 100 °C. (k) Starch with LPC (16.6% wt/wt) heated at 100 °C.

Por otro lado, al acercarse a la temperatura de gelatinización, donde los cambios en la estructura granular comienzan a ser irreversibles, claramente se observan los gránulos más grandes, los cuales empiezan a deformarse en mayor grado (Figuras , , ). En las tres micrografías tomadas a 65 °C hay gránulos que se deforman más que otros y algunos se ahuecan formando toroides. La no homogeneidad de la deformación granular es evidencia de una gran variedad del contenido de amilosa y de amilopectina en cada gránulo del almidón. Quizás esto mismo esté asociado a la existencia de distintas morfologías en el propio almidón en función del contenido del fosfolípido y como es natural, la diferencia en las propiedades fisicoquímicas de estos mismos.
Al seguir calentando hasta llegar a los 75 °C (Figuras , , ), los gránulos siguen deformándose, prácticamente el almidón nativo ha perdido su estructura granular (Figura ). Sin embargo, en los almidones que fueron analizados en presencia de LPC, los gránulos aún no se fusionan entre ellos, es decir aún no forman redes tridimensionales, siguen siendo individuales y esto fue aún más evidente cuando la concentración de LPC fue de 16,66%. Estos resultados son consistentes con los obtenidos en el DSC, puesto que se observan los cambios más pronunciados en las temperaturas características mostradas en la y en las Tablas a la . Por ejemplo, la temperatura final de gelatinización del almidón nativo es de 71,1 °C y es justamente a esa temperatura en donde se pierde la estructura granular. Respecto de los que tienen el fosfolípido, tal parece que los complejos formados superficialmente protegen al gránulo y no se observa gran cambio al final de su temperatura de gelatinización en todos los casos. La existencia de la fase acomplejada tiene que ser la responsable de esto y se corrobora al recurrir a la calorimetría, puesto que la disociación del complejo almidón-lípido comienza en 95 °C y termina en 104,4 °C. La muestra la conservación de una estructura granular remanente a los 100 °C en el almidón con LPC, sin embargo tal y como lo predice DSC, después de los 104,4 °C se pierde completamente.
La consistencia y conservación de la estructura granular evidentemente dependen de la concentración de LPC. Se ha demostrado en el presente trabajo que cuanto mayor es la concentración, mayor conservación de la estructura granular y viceversa. De hecho, el principal efecto del fosfolípido sobre la estructura granular observado por ESEM, es que este último confiere estabilidad a los gránulos incluso a temperaturas de 100 °C, mientras que en el almidón sin fosfolípidos, a 75 °C desaparecen los gránulos y se forma una pasta (Figuras , ). La propiedad que tiene la LPC es que da lugar a la formación de complejos de inclusión con el almidón principalmente sobre la superficie de los gránulos, los cuales actúan como redes o mallas que evitan que el gránulo colapse y por lo tanto pierda completamente su estructura granular a temperaturas posteriores a la temperatura de gelatinización pero previas a la temperatura de disociación del complejo almidón-fosfolípido, tal y como sucede con el almidón nativo.
Conclusiones
El uso de lípidos exógenos tales como la L-α-Lisofosfatidilcolina (LPC) influye notablemente sobre las propiedades fisicoquímicas y estructurales del almidón de maíz, se ha demostrado en el presente trabajo que los cambios observados en las temperaturas características del fenómeno de gelatinización y del proceso de disociación y formación del complejo almidón-lípidos dependen de la concentración del fosfolípido añadido. El resultado más notable es el observado por ESEM, el cual nos indica que la estructura granular del almidón se conserva a temperaturas superiores a la temperatura de gelatinización, esto gracias a la formación de complejos de inclusión en la superficie del gránulo entre el almidón y el fosfolípido. Los resultados obtenidos por ambas técnicas se complementan entre sí; así, se ha mostrado, que los cambios observados en una técnica se observan en la otra. Los resultados obtenidos sugieren que el proceso de formación del complejo de inclusión entre los componentes del almidón y el fosfolípido analizado (lípido exógeno) se lleva a cabo antes de que se alcance la temperatura de gelatinización del almidón y no después de que el almidón haya pasado esta misma como se indica comúnmente en la literatura (Eliasson, Citation1994; Godet et al., Citation1995; Liu et al., Citation1997). Las interacciones entre el almidón y los lípidos son importantes en el área de la ciencia de los alimentos, ya que estos aspectos, como se sabe, tienen injerencia en la regulación de los procesos de envejecimiento de alimentos elaborados a base de almidón, los resultados obtenidos pueden ser utilizados principalmente en la industria de fabricación de tortillas de maíz nixtamalizado.
Agradecimientos
El presente trabajo fue realizado con fondos del proyecto PROMEP. Agradecemos al Técnico Académico José Eleazar Urbina por su valioso apoyo en el análisis microscópico realizado en el laboratorio de propiedades estructurales del CINVESTAV, Unidad Querétaro.
Referencias
- Atkin , N. J. , Cheng , S. L. , Abeyssekera , R. M. and Robards , A. W. 1999 . Localization of amilosa and amylopectin in starch granules using-gold labeling . Starch , 5 : 163 – 172 .
- Atwell , W. A. , Hood , L. F. , Lineback , D. R. , Varriano-Marston , E. and Zobel , H. F. 1988 . The terminology and methodology associated with basic starch phenomena . Cereal Foods World , 33 : 306 – 311 .
- Biliaderis , C. G. 1991a . The structure and interactions of starch with food constituents . Canadian Journal of Physiology and Pharmacology , 69 : 60 – 78 .
- Biliaderis , C. G. 1991b . “ Non-equilibrium phase transitions of aqueous starch systems ” . In Water relationships in foods , Edited by: Levine , H. and Slade , L. 251 – 273 . New York : Plenum Press .
- Biliaderis , C. G. 1992 . Structure and phase transitions of starch in food systems . Food Technology , 46 : 98 – 109 .
- Cui , R. and Oates , C. G. 1999 . The effect of amylose-lipid complex formation on enzime susceptibility of sago starch . Food Chemistry , 65 : 417 – 425 .
- Eliasson , A. C. 1994 . Interactions between starch and lipids studied by DSC . Thermochimica Acta , 246 : 343 – 356 .
- Godet , M. C. , Visto , H. and Buleon , A. 1995 . Crystallization of amylose-fatty acid complexes preparated with different amylose chain lengths . Carbohydrate Polymers , 21 : 47 – 52 .
- Jovanovich , G. , Zamponi , R. A. , Lupano , C. E. and Añon , M. C. 1992 . Effect of water content on the formation and dissociation of the amylose-lipid complex in wheat flour . Journal of Agriculture Food Chemistry , 40 : 1789 – 1793 .
- Kaukovirta-Norja , A. , Reinikainen , P. , Olkku , J. and Laakso , S. 1997 . Starch lipids of barley and malt . Cereal Chemistry , 74 : 733 – 738 .
- Kitahara , K. , Tanaka , T. , Suganuma , T. and Nagahama , T. 1997 . Release of bound lipids in cereal starches upon hydrolysis by glucoamylase . Cereal Chemistry , 74 : 1 – 6 .
- Lin , P. Y. and Czuchajowska , Z. 1998 . Role of phosphorous in viscosity, gelatinization, and retrogradation of starch . Cereal Chemistry , 75 : 705 – 709 .
- Liu , H. , Arntfiel , S. D. , Holley , R. A. and Aime , D. B. 1997 . Amylose-lipid complex formation in acetylated pea starch-lipid systems . Cereal Chemistry , 74 : 159 – 162 .
- Morrison , W. R. 1988 . Lipids in cereal starches: A review . Journal of Cereal Science , 8 : 1 – 15 .
- Morrison , W. R. , Tester , R. F. , Snape , C. E. , Law , R. and Gidley , M. J. 1993 . Swelling and gelatinization of cereal starches IV. Some effects of lipid-complexed amylose and free amylose in waxy and normal barley starches . Cereal Chemistry , 70 : 385 – 391 .
- Statsoft Inc . 1997 . Statistica user´s guide. Statistica for Windows version 6.0 , Tulsa, OK : Author .
- Toro-Vazquez , J. F. , Gómez Aldapa , C. A. , Aragon-Piña , A. , Brito de la Fuente , E. , Dibildox-Alvarado , E. and Charó-Alonso , M. 2003 . Interaction of granular maize starch with lysophosphatidylcholine evaluated by calorimetry, mechanical and microscopy analysis . Journal of Cereal Science , 38 : 1 – 10 .