Abstract
Twelve yeast Debaryomyces hansenii strains were characterized for their ability to inhibit in vitro growth of Penicillium italicum, production of lytic enzymes (β-1.3-glucanase, chitinase and protease) and postharvest biological control of blue mold decay (caused by P. italicum) on Mexican lemon fruits. The D. hansenii strains inhibited in vitro the growth of P. italicum in different pHs (4.2, 4.6 y 5.0), effect related to killer toxins. The enzyme activity (of β-1.3-glucanase, chitinase and protease) was detected on Yeast Nitrogen Base (YNB) medium inoculated with cell wall fragments of P. italicum, the range enzymatic activity of all strains was between 9 and 13 days after inoculated culture medium. All D. hansenii strains significantly reduced blue mold on Mexican lemon during fifteen days of storage at 13 °C, but the LL1 strain was distinctly more effective under these conditions. These results showed that D. hansenii is an alternative for biological control of blue mold decay of Mexican lemon fruits.
Doce levaduras Debaryomyces hansenii se caracterizaron en base a su habilidad para inhibir in vitro el crecimiento de Penicillium italicum, producir enzimas hidrolíticas (β-1,3 glucanasa, quitinasa y proteasa) y su capacidad de controlar en poscosecha la podredumbre azul (causada por P. italicum) en frutos de limón mexicano. Las levaduras D. hansenii inhibieron in vitro a P. italicum a diferentes pHs (4,2, 4,6 y 5,0), efecto relacionado con las toxinas killer. La actividad enzimática (β-1,3-glucanasa, quitinasa y proteasa) fue determinada en el medio Levadura Nitrógeno Base (LNB) suplementado con fragmentos de pared celular de P. italicum, observando la mayor actividad enzimática para todas las levaduras entre los días 9 y 13 después de inoculado el medio de cultivo. Todas las levaduras D. hansenii redujeron significativamente la podredumbre azul sobre frutos de limón mexicano durante 15 días de almacenamiento a 13 °C, siendo la levadura LL1 la más efectiva bajo estas condiciones. Por los resultados encontrados, D. hansenii es una opción para el control biológico de la podredumbre azul del limón mexicano.
Introducción
La podredumbre azul causada por Penicillium italicum Wehmer es una de las principales enfermedades poscosecha que atacan a los cítricos en todo el mundo (Palou, Usall, Muñoz, Smilanick, & Viñas, Citation2002). En México, esta enfermedad es la responsable de pérdidas de fruta de entre un 10-40% de la producción total. Este hongo se controla principalmente con fungicidas químicos como el imazalil y tiabendazol (Holmes & Eckert, Citation1999), disminuyendo las pérdidas hasta un 5–10% de la producción total (Ismail & Zhang, Citation2004). Sin embargo, el uso de estos productos se ha restringido debido, principalmente, a la aparición de cepas resistentes a estos fungicidas y a un posible efecto negativo sobre el medio ambiente y la salud humana (Eckert, Sievert, & Ratnayake, Citation1994). Además, actualmente existe una demanda por parte de los consumidores de productos agrícolas que provengan de un sistema de manejo agronómico donde la aplicación de químicos (como fertilizantes, fungicidas, insecticidas, entre otros) sea poca o nula, por lo que la búsqueda de alternativas para el control de este tipo de enfermedades es relevante en todo el mundo. En años recientes el uso de microorganismos como control biológico ha sido una alternativa a la aplicación de fungicidas químicos (Zhang, Zheng, & Xi, Citation2005). Las levaduras han mostrado tener un gran potencial como antagonistas a hongos patógenos en poscosecha. Sus principales mecanismos de control biológico se basan en la competencia de espacio y nutrientes (Chang-Goyal & Spotts, Citation1996), producción de enzimas hidrolíticas (Bar-Shimon et al., Citation2004), toxinas killer (Santos & Marquina, Citation2004) e inducción de resistencia del hospedero (Droby et al., Citation2002). Diferentes especies de levaduras han sido utilizadas con éxito como agentes de control biológico, por ejemplo: Candida oleophila, C. sake, Debaryomyces hansenii, Pichia membranifaciens, P. anomala, P. guillermondii, Cryptococcus albidus, entre otros. En el caso particular de C. oleophila, existe un producto comercial elaborado a base de esta levadura denominado Aspire, utilizado para el control de hongos en poscosecha de cítricos (Long, Wu, & Deng, Citation2005). Sin embargo, uno de los mayores problemas que tiene este producto es su inconsistencia en la protección de la fruta (Droby et al., Citation1999). A pesar del desarrollo de varios productos comerciales, la búsqueda de microorganismos para el control biológico de patógenos poscosecha continúa (Fan, Tian, Xu, Wang, & Jiang, Citation2000). El hallazgo de nuevos antagonistas da la oportunidad de desarrollar productos locales de control biológico, los cuales incentivan la industria local y disminuyen la dependencia tecnológica con países desarrollados. El conocimiento de los mecanismos de acción ejercidos por las levaduras es crucial para la selección de nuevos agentes de control biológico. El presente trabajo tuvo por objetivo la caracterización de una colección de levaduras Debaryomyces hansenii, evaluando su capacidad de inhibir in vitro el crecimiento de Penicillium italicum y de producir enzimas hidrolíticas (β-1,3 glucanasa, quitinasa y proteasa) y determinando su protección poscosecha de frutos de limón mexicano hacia P. italicum.
Materiales y métodos
Patógeno
El hongo Penicillium italicum fue previamente aislado de frutos de limón mexicano (Citrus aurantifolia Christm. Swingle) con síntomas de podredumbre azul y caracterizado morfológica y molecularmente por Hernández-Montiel y Ochoa (2007). El hongo se mantuvo en medio Agar-Papa-Dextrosa (PDA, Difco) a 25 °C. Para la cuantificación del número de esporas mL−1 se utilizó un hematocitómetro.
Levaduras
Las levaduras Debaryomyces hansenii empleadas en este trabajo pertenecen a la colección del Centro de Investigaciones Biológicas del Noroeste (cepario registrado con el número CLT20), de las cuales nueve fueron de origen marino (catalogadas como: DhhBCS01, DhhBCS02, DhhBCS03, DhhBCS04, DhhBCS05, DhhBCS06, DhhBCS07, DhfBCS01 y DhfBCS02) y tres epífitas de frutos de limón mexicano (catalogadas como: LL1, LL2 y LL3). Las levaduras se mantuvieron en medio YPD (1% extracto de levadura, 2% glucosa, 2% peptona y 2% agar) a una temperatura de 25 °C. Para la cuantificación de las células mL−1 se utilizó un hematocitómetro.
Determinación de la capacidad de inhibición in vitro
Las levaduras D. hansenii fueron sembradas superficialmente por estría en placas con medio YMB (conteniendo: 0,3% extracto de levadura, 0,3% extracto de malta, 1% glucosa, 0,5% peptona y 2% agar) adicionado con una concentración de 104 esporas mL−1 de P. italicum. El medio de cultivo se ajustó a un pH de 4,2, 4,6, 5,0 y 5,4 utilizando un buffer de citrato-fosfato. Las placas se incubaron a 25 °C durante 48 h y se determinó la presencia de halos de inhibición sobre el crecimiento del hongo (Vero, Citation2006). Se realizaron tres replicados y el experimento se repitió dos veces.
Determinación de enzimas hidrolíticas
Extracción de pared celular de P. italicum
El hongo se creció en medio YES (2% extracto de levadura y 15% sucrosa) a 25 °C durante 12 días. La masa micelial se retiró y maceró en nitrógeno líquido. La pared celular del hongo se resuspendió en una solución de NaCl 5M y se sometió a ultrasonidos (Ultrasonic homogenizer, ColeParmer) durante 3 min. Posteriormente se centrifugó durante 20 min a 8000 rpm para descartar el sobrenadante. Las paredes fueron lavadas con agua destilada estéril y se pusieron a secar durante 3 h a 60 °C (Rey, Citation1998).
Cultivo con paredes de P. italicum
Las levaduras de D. hansenii fueron cultivadas en matraces Erlenmeyer con 30 mL de medio mínimo YNB (conteniendo: 0,67% Base Levadura-Nitrógeno), suplementado con 1 mg de pared del hongo/mL de medio. Se incubaron a 25 °C en agitación (100 rpm) durante 15 días. En este lapso de tiempo, se cuantificó del sobrenadante, el contenido de β-1,3 glucanasa, quitinasas y proteasas (Garmendia et al., Citation2005).
Actividad β-1,3 glucanasa
La actividad de esta enzima se determinó empleando laminarina (de Laminaria digitata, Sigma) como sustrato. Se mezclaron 62,5 μL del sobrenadante con la misma cantidad del sustrato al 1%, incubando la mezcla a 25 °C durante 4 h. Posteriormente a cada muestra se le agregaron 130 μL de 3,5-dinitrosalicílico (DNS), calentándose a baño María durante 5 min. Se midió la absorbancia en un espectrofotómetro (DU-640 UV-Vis Beckman Coulter, D.F., México) a 492 nm. Una unidad (U) de β-1,3 glucanasa se definió como los micromoles de azúcares reductores liberados por mg de proteína por min (Castoria et al., Citation2001). El contenido total de proteína fue cuantificado utilizando el método descrito por Lowry et al. (Citation1951). Se realizaron tres replicados y el experimento se repitió dos veces.
Actividad quitinasa
La actividad de esta enzima se determinó mezclando 10 μL de pnitrofenil-N-acetil β-D-glucosamina con 90 μL del sobrenadante, incubándose a 25 °C durante 24 h. Al finalizar el tiempo se midió la absorbancia de la muestra en un espectrofotómetro (DU-640 UV-Vis Beckman Coulter, D.F., México) a 540 nm. Se definió una unidad (U) de quitinasa como la capacidad de la enzima para liberar un micromol de p-nitrofenol por mg de proteína (Castoria et al., Citation2001; Gacto et al., Citation2000). Se realizaron tres replicados y el experimento se repitió dos veces.
Determinación de proteasas
Se mezclaron 100 μL del sobrenadante con la misma cantidad de azocaseína al 1% y buffer acetato pH 5, incubando la muestra a 40 °C durante 30 min. Posteriormente se agregaron 400 μL de ácido tricloroacético (al 10%), centrifugando las muestras a 12000 rpm durante 15 min. Del sobrenadante se tomaron 500 μL y se les agregó la misma cantidad de NaOH (525 Mm). Se midieron las muestras en un espectrofotómetro (DU-640 UV-Vis Beckman Coulter, D.F., México) a una absorbancia de 442 nm. Se definieron 10 unidades (U) de actividad proteasa como la cantidad que produce una absorbancia (0,1) en las condiciones de reacción (Benitez et al., 2001; Gacto et al., Citation2000). Se realizaron tres replicados y el experimento se repitió dos veces.
Protección in vivo de frutos de limón mexicano
Frutos de limón mexicano (Citrus aurantifolia Christm. Swingle) fueron lavados con agua corriente y desinfectados con hipoclorito de sodio (NaClO) al 1% durante 2 min (Yao et al., Citation2004), se dejaron secar durante 1 h y se sumergieron en una solución de levadura (106 células mL−1) durante 5 min. Posteriormente con un escarpelo estéril se les realizó una herida de 2 mm de ancho por 1 mm de profundidad (Long et al., Citation2005), depositando dentro de ésta 20 μL de una suspensión de P. italicum a una concentración de 1×104 esporas mL−1. Un grupo de frutos fueron tratados con una solución del fungicida imazalil (enilconazol) a una concentración de 500 mg/L durante 2 min, se les realizó la misma herida y se inoculó a la misma dosis de P. italicum. Los frutos fueron almacenados durante 15 días a 13 °C y 90% HR en una cámara ambiental (KBF 720, Binder). Las variables cuantificadas al final del experimento fueron: incidencia de la enfermedad, calculada en base al número de frutos con pudrición, con la fórmula: Incidencia (%) = Fi/Tf (100), donde Fi: número de frutos infectados y Tf: total de frutos inoculados, y el diámetro de lesión en cm. Se utilizaron diez repeticiones (unidad experimental = 1 fruto) y el experimento fue realizado por duplicado.
Micrografias de microscopio electrónico de barrido
Se tomaron muestras de las heridas de limón tratadas con levadura y P. italicum, fijándolas por inmersión utilizando una solución tamponada de fosfato 0,1M (pH 7) de glutaraldehído al 2,5% por 24 h. Posteriormente fueron procesadas de acuerdo a la metodología descrita por Usall et al. (Citation2001) y observadas al microscopio electrónico de barrido (S-3000N, Hitachi).
Análisis estadístico
Los datos fueron procesados mediante un análisis de varianza (ANOVA) de una vía, utilizando el paquete estadístico STADISTICA (StatSoft, Tulsa, OK). Se utilizó la prueba Fisher de diferencia mínima significativa (LSD) para la comparación de medias con un nivel de significancia del 5% (P < 0,05).
Resultados y discusión
Se observó antagonismo in vitro en las levaduras Debaryomyces hansenii a Penicillium italicum en los diferentes pHs probados (). El rango de pH donde las levaduras mostraron actividad antagónica fue variable. En el caso particular de la levadura DhhBCS01 su intervalo de actividad se observó entre pH 4,6–5,0, para DhhBCS06 sólo en pH 4,2 y para las levaduras LL2 y LL3 en pH 4,6. El resto perdieron su actividad en pH 5,4. Este antagonismo hacia P. italicum podría estar relacionado con la producción de toxinas killer, las cuales son péptidos con actividad antimicrobiana cuya acción y producción son sumamente dependientes del pH del medio. La mayoría de las toxinas killer descritas han demostrado actividad dentro de los pHs ajustados en nuestro experimento (Llorente, Marquina, Santos, Peinado, & Spencer-Martins, Citation1997), siendo el medio YMB, uno de los más comúnmente utilizados para la detección de la actividad killer en levaduras (Santos & Marquina, Citation2004). Los diferentes niveles de inhibición de las levaduras de D. hansenii sobre el crecimiento de P. italicum, pudieron estar influidos por el medio de cultivo utilizado, la temperatura del ensayo y por el potencial genético de cada levadura (). Este efecto antagónico puede estar relacionado también con el número de sitios activos (receptores) presentes en la pared celular del hongo (Buzzini & Martini, Citation2000). La toxina killer, denominada también factor killer, es un péptido que interactúa específicamente sobre la pared celular del hongo (Santos, Marquina, Barroso, & Peinado, Citation2002), identificándose a (1–6)-β-D-Glucano como el principal receptor de la toxina (Al-Aidroos & Bussey, Citation1978), la cual se fija sobre los receptores glucídicos de la pared celular interfiriendo en el gradiente electroquímico de la membrana citoplasmática, por lo que induce la muerte celular (Rodríguez, Abad, Gómez, Casanova, & Lema, Citation1998). Sin embargo, según Magliani, Conti, Gerloni, Bertolotti, & Polonelli (Citation1997) comentan que el uso de levaduras productoras de toxina killer, para el control de podredumbres y levaduras patógenas, se ha visto limitada debido a que estas proteínas pierden su actividad por arriba de pH 5,5. Este resultado es similar a lo observado con las levaduras D. hansenii ().
Figura 1. Inhibición del crecimiento de Penicillium italicum en presencia de levaduras Debaryomyces hansenii en medio YMB ajustado a pH 4,6. Donde: A) P. italicum, B) 1 = DhhBCS01, 2 = DhhBCS02, 3 = DhhBCS03, 4 = DhhBCS04, 5 = DhhBCS05, 6 = DhhBCS06, y C) 7 = DhhBCS07, 8 = DhfBCS01, 9 = DhfBCS02, 10 = LL1, 11 = LL2 y 12 = LL3.
Figure 1. Inhibition of the growth of Penicillium italicum in presence of yeast Debaryomyces hansenii strains on YMB medium buffered to pH 4.6. Where: A) P. italicum, B) 1 = DhhBCS01, 2 = DhhBCS02, 3 = DhhBCS03, 4 = DhhBCS04, 5 = DhhBCS05, 6 = DhhBCS06, and C) 7 = DhhBCS07, 8 = DhfBCS01, 9 = DhfBCS02, 10 = LL1, 11 = LL2 and 12 = LL3.
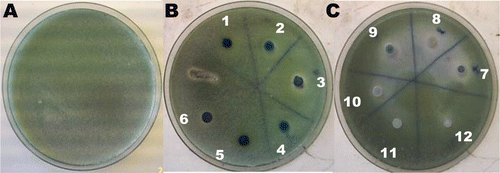
Tabla 1. Inhibición de Penicillium italicum por levaduras Debaryomyces hansenii bajo diferentes pHs del medio de cultivo.
Table 1. Inhibition of Penicillium italicum for yeast Debaryomyces hansenii under different pHs buffered on culture media.
Análisis de la actividad proteolítica de levaduras
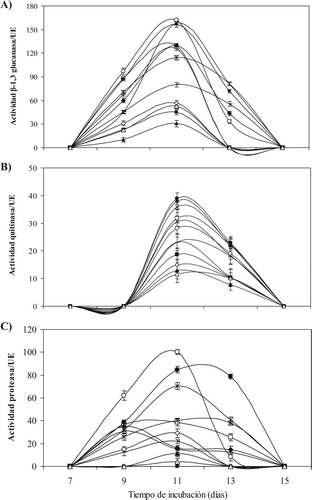
Todas las levaduras D. hansenii estudiadas produjeron enzimas (β-1,3 glucanasa, quitinasa y proteasa) en presencia de paredes celulares del hongo patógeno. La muestra los niveles de actividad de cada una de las enzimas ensayadas en función del tiempo. El intervalo de actividad para β-1,3 glucanasa se determinó entre los 9 y 13 días de evaluación, alcanzando el máximo nivel de producción las levaduras DhfBCS02, DhhBCS04 y DhhBCS06. La levadura con la actividad β-1,3 glucanasa más baja fue DhhBCS01. Para la actividad quitinasa, el intervalo de actividad enzimática se determinó entre los 9 y 11 días de evaluación. Las levaduras con mayor actividad fueron DhhBSC06 y DhhBCS03, presentando el nivel más bajo para los 11 días LL3 y para los 13 días DhhBCS01. En la determinación de proteasa, la actividad inicial se detectó a los 9 días de evaluación, donde las levaduras DhhBCS03 y DhhBCS07 mostraron su nivel más alto dentro de su cinética. La DhfBCS02 presentó la mayor actividad a los 9 y 11 días, y DhhBCS06 a los 13 días de evaluación. La levadura con menor actividad proteasa fue LL3, siendo LL2 la única que no produjo proteasas en las condiciones del ensayo. La comprobación in vitro de β-1,3 glucanasa, quitinasa y proteasa, para las distintas D. hansenii, en presencia de paredes del patógeno, podría implicar que dichas enzimas están involucradas en el control biológico in vivo de P. italicum. Se ha demostrado que la interacción de levaduras productoras de enzimas hidrolíticas con hongos trae como resultado la desintegración y colapso de las hifas (Carsolio et al., Citation1999). Las diferencias en la producción y diversidad de estas enzimas in vitro pueden estar relacionadas con su capacidad de adaptación y asimilación de las fuentes de carbono utilizadas para su crecimiento (Castoria et al., Citation2001), como lo fueron las paredes de P. italicum, usadas como inductores para estas enzimas. De manera especifica, la β-1,3 glucanasa (también denominada glucana-1,3-β-D glicosidasa), hidroliza las uniones β-D-glicosídicas de β-1,3 glucano (componente de la pared celular de los hongos); en el caso de las quitinasas, éstas hidrolizan las uniones β-1,4 de N-acetil-β-D-glicosamida de quitina; finalmente las proteasas hidrolizan las proteínas, específicamente las manoproteínas que componen la pared celular de los hongos (Fleuri & Harumi-Sato, Citation2005). Aunque muchos microorganismos son capaces de producir este tipo de enzimas, en el caso particular de las levaduras su determinación es uno de los criterios de selección de nuevos agentes de control biológico (Castoria, De Curtis, Lima, & De Cicco, Citation1997). Por ejemplo, El-Ghaouth, Wilson, & Wisniewski (Citation2003) encontraron que la levadura productora de enzimas Candida saitoana tuvo un efecto lítico sobre las hifas de Botrytis cinerea restringiendo su proliferación sobre el hospedero. Wisniewski et al. (Citation1991) observaron el mismo mecanismo de acción sobre este patógeno con la levadura Pichia guilliermondii. Por su parte Ippolito et al. (Citation2000) encontraron que Aureobasidium pullulans era capaz de producir quitinasas y β-1,3 glucanasas, las cuales controlaron a B. cinerea y Penicillium expansum en frutos de manzana. De la misma manera Jijakli y Lepoivre (1998) describieron una disminución in vitro de B. cinerea por efecto de la exo-β-1,3 glucanasa producida por P. anomala.
Figura 2. Actividad enzimática de levaduras Debaryomyces hansenii cultivadas con Penicillium italicum en medio YNB. Levaduras; (▴) DhhBCS01, (□) DhhBCS02, (✦) DhhBCS03, (x) DhhBCS04, (∗) DhhBCS05, (•) DhhBCS06, (|) DhhBCS07, (−) DhfBCS01, (○) DhfBCS02, (⋄) LL1, (▪) LL2 y (Δ) LL3. La actividad específica fue expresada en unidades por mL de proteína (UE = Unidades Especificas). Las barras verticales indican el error estándar de la media.
Figure 2. Enzyme activity of yeast Debaryomyces hansenii strains inoculated with Penicillium italicum on YMB medium. Yeast: (▴) DhhBCS01, (□) DhhBCS02, (✦) DhhBCS03, (x) DhhBCS04, (∗) DhhBCS05, (•) DhhBCS06, (|) DhhBCS07, (−) DhfBCS01, (○) DhfBCS02, (⋄) LL1, (▪) LL2 and (Δ) LL3. Specific activity was expressed in units per mL of protein (SU = specific units). Verticals bars indicate standard error of means.
Protección de frutos inoculados con levaduras hacia P. italicum
En frutos de limón mexicano inoculados con las distintas D. hansenii y P. italicum se cuantificaron diversos niveles de protección (). Con todas las levaduras se logró una disminución significativa del desarrollo del patógeno. Sin embargo, los niveles de protección fueron diferentes. El 33% de las levaduras evaluadas disminuyeron la incidencia de la enfermedad en menos del 50%. La mayor protección alcanzada fue con DhhBCS06, LL1 y LL2, las cuales, junto con DhhBCS03, superaron la protección ejercida por el fungicida imazalil. Aunque los tratamientos con las distintas levaduras no lograron inhibir totalmente la podredumbre, se verificó que la magnitud de la misma (determinada como el diámetro de la zona afectada) fue significativamente menor que en el control. En este sentido, la LL1 fue la levadura con la cual se observaron podredumbres de menor diámetro, siendo significativamente menores (P < 0.05) que las del tratamiento con imazalil. Las diferencias entre las D. hansenii en la eficiencia del control hacia P. italicum en los frutos de limón mexicano podrían estar relacionadas con su diferente capacidad de adaptación y crecimiento sobre las heridas de los frutos y con la interacción con el hongo (). Además la unión de las levaduras a las hifas del patógeno dentro de las heridas de limón mexicano podría estar también relacionada con las enzimas detectadas in vitro (), las cuales tienen un rol en el antagonismo en las heridas del fruto. Para establecerse y multiplicarse en las heridas del limón, las levaduras debieron ser capaces de utilizar los nutrientes del flavedo, compitiendo por espacio y nutrientes con el hongo patógeno. Esta competencia es uno de los principales mecanismos antagónicos ejercidos por levaduras (Nunes, Usall, Teixido, & Viñas, Citation2002; Wilson & Wisniewki, Citation1989). Sin embargo, existen otros tipos de antagonismo como lo son la producción de enzimas hidrolíticas (Droby et al., Citation2002), inducción de resistencia en el hospedero (El-Ghaouth, Wilson, & Wisniewski, Citation1998) y producción de sustancias antifúngicas, tales como las toxinas killer (Llorente et al., Citation1997). Las levaduras epífitas LL1 y LL2 que evidenciaron niveles de protección estadísticamente mayores que el imazalil pueden considerarse una alternativa al tratamiento poscosecha tradicional (mediante el uso de fungicidas químicos). Su uso puede resultar una opción ecológica y económicamente viable, ante la creciente demanda por parte del consumidor de productos agrícolas que provengan de un manejo orgánico o bien de donde se apliquen al mínimo sustancias químicas para controlar todo tipo de plagas (Castoria, Caputo, Curtis, & Cicco, Citation2003). Es de importancia hacer un estudio complementario aplicando distintas dosis de inóculo de D. hansenii para el control de P. italicum en frutos de limón mexicano, ya que se ha comprobado que el incremento de la dosis de aplicación de levadura aumenta el control biológico sobre la podredumbre producida por hongos (Hong, Michailides, & Holtz, Citation1998). Además se plantea la posibilidad de probar mezclas entre las mejores levaduras D. hansenii para evaluar su posible aplicación como inoculante mixto.
Figura 3. Incidencia y diámetro de lesión ocasionada por Penicillium italicum en frutos de limón mexicano inoculados con levaduras Debaryomyces hansenii. Letras iguales en las columnas no existe diferencia significativa entre las medias de los tratamientos usando la prueba Fisher (LSD) (P < 0,05). Evaluación a los 15 días de inoculados los frutos con levadura (106 células mL−1) y hongo (104 esporas mL−1), almacenados a 13 °C.
Figure 3. Incidence and diameter of the lesion caused by Penicillium italicum on Mexican lemon fruits inoculated with yeast Debaryomyces hansenii strains. Bars with the same letter are not significantly different according to Fisher's (LSD) (P < 0 .05). Fruits inoculated with yeast (106 cells mL−1), pathogen fungus (104 spores mL−1) and stored at 13 °C for fifteen days.
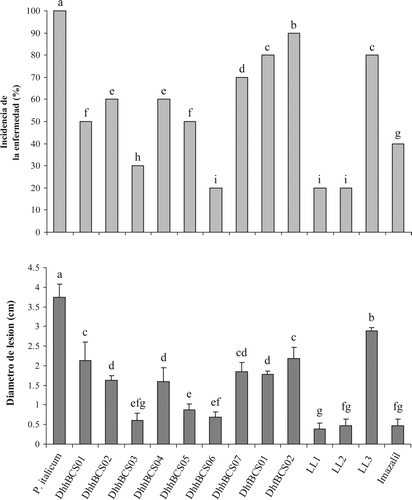
Figura 4. Micrografías por microscopio electrónico de barrido de la levadura antagónica Debaryomyces hansenii (LL1) y Penicillium italicum inoculados en frutos de limón mexicano. (A) Levadura [L] colonizando in vivo heridas de limón. (B) Levadura [L] interactuando sobre el micelio [M] de P. talicum. Frutos almacenados durante 15 días a 13 °C y 85% HR.
Figure 4. Photo scanning electron microscopy of antagonistic yeast Debaryomyces hansenii (strain LL1) and Penicillium italicum inoculated on Mexican lemon fruits. (A) Yeast [L] growing in vivo on wound of Mexican lemon. (B) Yeast [L] on mycelium [M] of P. talicum. Fruits stored at 13 °C and 85% RH for fifteen days.
![Figura 4. Micrografías por microscopio electrónico de barrido de la levadura antagónica Debaryomyces hansenii (LL1) y Penicillium italicum inoculados en frutos de limón mexicano. (A) Levadura [L] colonizando in vivo heridas de limón. (B) Levadura [L] interactuando sobre el micelio [M] de P. talicum. Frutos almacenados durante 15 días a 13 °C y 85% HR. Figure 4. Photo scanning electron microscopy of antagonistic yeast Debaryomyces hansenii (strain LL1) and Penicillium italicum inoculated on Mexican lemon fruits. (A) Yeast [L] growing in vivo on wound of Mexican lemon. (B) Yeast [L] on mycelium [M] of P. talicum. Fruits stored at 13 °C and 85% RH for fifteen days.](/cms/asset/9ac01959-1f30-494c-b4bb-260d9caabea8/tcyt_a_408232_o_f0004g.gif)
Conclusión
Con la caracterización de las levaduras Debaryomyces hansenii se determinó un antagonismo in vitro a Penicillium italicum y se cuantificó actividad enzimática de β-1,3 glucanasa, quitinasa y proteasa. En frutos de limón mexicano inoculados con las levaduras se disminuyó la podredumbre azul, siendo la más eficiente la epífita LL1. Esta levadura fue significativamente (P < 0.05) mejor que el tratamiento con imazalil, fungicida utilizado de manera convencional en la industria de México para el control de hongos patógenos causantes de podredumbres. La aplicación de D. hansenii como agente de control biológico puede ser una alternativa en el manejo poscosecha de los cítricos para el control de P. italicum.
Agradecimientos
Se agradece al CONACYT (Consejo Nacional de Ciencia y Tecnología, México) por la beca otorgada (No. 144710) a L.G. Hernández-Montiel y al Fondo SAGARPA-CONACYT por el apoyo financiero hacia los proyectos 003-C01-8 y 2002-C01-0798. Los autores agradecen a I.C. Rodríguez-Luna por su asistencia técnica.
Referencias
- Al-Aidroos , K. and Bussey , H. 1978 . Chromosomal mutants of Saccharomyces cerevisiae affecting the cell wall binding site for killer factor . Canadian Journal of Microbiology , 24 : 228 – 237 .
- Bar-Shimon , M. , Yehuda , H. , Cohen , L. , Weiss , B. , Kobeshnikov , A. , Daus , A. , Goldway , M. , Wisniewski , M. and Droby , S. 2004 . Characterization of extracellular lytic enzymes produced by the yeast biocontrol agent . Candida oleophila. Current Genetics , 45 : 140 – 148 .
- Benítez , J. A. , Silva , A. J. and Finkelstein , R. A. 2001 . Environmental signals controlling production of hemagglutinin/protease in Vibrio cholerae . Infection and Immunity , 69 : 6549 – 6553 .
- Buzzini , P. and Martini , A. 2000 . Differential growth inhibition as a tool to increase the discriminating power of killer toxin sensitivity in fingerprinting of yeasts . FEMS Microbiology Letters , 193 : 31 – 36 .
- Carsolio , C. , Benhamou , N. , Haran , S. , Cortés , C. , Gutiérrez , A. , Chet , A. and Herrera-Estrella , A. 1999 . Role of the Trichoderma harzianum endochitinase gene, ech42, in mycoparasitism . Applied and Environmental Microbiology , 65 : 929 – 935 .
- Castoria , R. , De Curtis , F. , Lima , G. and De Cicco , V. 1997 . β-1,3-glucanase activity of two saprophytic yeasts and possible mode of action against postharvest diseases . Postharvest Biology and Technology , 12 : 293 – 300 .
- Castoria , R. , De Curtis , F. , Lima , G. , Caputo , L. , Pacifico , S. and De Cicco , V. 2001 . Aureobasidium pullulans (LS-30) an antagonist of postharvest pathogens of fruits: study on its modes of action . Postharvest Biology and Technology , 22 : 7 – 17 .
- Castoria , R. , Caputo , L. , Curtis , F. and Cicco , V. 2003 . Resistance of postharvest biocontrol yeast to oxidative stress: A possible new mechanism of action . Phytopathology , 93 : 564 – 572 .
- Chang-Goyal , T. and Spotts , R. A. 1996 . Control of postharvest pear diseases using natural saprophytic yeast colonists and their combination with a low dosage of thiabendazole . Postharvest Biology and Technology , 7 : 51 – 64 .
- Droby , S. , Lischinski , S. , Cohen , L. , Weiss , B. , Daus , A. , Chand-Goyal , T. , Eckert , J. W. and Manulis , S. 1999 . Characterization of an epiphytic yeast population of grapefruit capable of suppression of green mold decay caused by Penicillium digitatum . Biological Control , 16 : 27 – 34 .
- Droby , S. , Vinokur , V. , Weiss , B. , Cohen , L. , Daus , A. , Goldsmith , E. and Porat , R. 2002 . Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila . Biological Control , 92 : 393 – 399 .
- Eckert , J. W. , Sievert , J. R. and Ratnayake , M. 1994 . Reduction of imazalil effectiveness against citrus green mold in California packinghouses by resistant biotypes of Penicillium digitatum . Plant Disease , 78 : 971 – 974 .
- El-Ghaouth , A. , Wilson , C. L. and Wisniewski , M. 1998 . Ultrastructural and cytochemical aspects of the biological control of Botrytis cinerea by Candida saitoana in apple fruit . Phytopathology , 88 : 282 – 291 .
- El-Ghaouth , A. , Wilson , C. L. and Wisniewski , M. 2003 . Control of Postharvest decay of apple fruit with Candida saitoana and induction of defense responses . Phytopathology , 93 : 344 – 348 .
- Fan , Q. , Tian , S. P. , Xu , Y. , Wang , Y. and Jiang , A. L. 2000 . Biological control of Rhizopus rot of peach fruits by Candida guilliermondii . Acta Botanica Sinica , 42 : 1033 – 1038 .
- Fleuri , L. F. and Harumi-Sato , H. 2005 . Produção, purificação, clonagem e aplicação de enzimas líticas . Química Nova , 28 : 871 – 879 .
- Gacto , M. , Vicente-Soler , J. , Cansado , J. and Villa , T. G. 2000 . Characterization of an extracellular enzyme system produced by Micromonospora chalcea with lytic activity on yeast cells . Journal of Applied Microbiology , 88 : 961 – 967 .
- Garmendia , G. , Garat , F. , Silvera , E. , De Aurrecochea , I. and Vero , S. 2005 . Levaduras nativas como controladores de enfermedades postcosecha de frutas en Uruguay . Agrociencia , 9 : 327 – 335 .
- Hernández-Montiel , L. G. and Ochoa , J. L. 2007 . Fruit rot caused by Penicillium italicumon lemon (Citrus aurantifolia) in Colima, México . Plant Disease , 91 : 767
- Holmes , G. J. and Eckert , J. W. 1999 . Sensitivity of Penicillium digitatum and P. italicum to postharvest citrus fungicides in California . Phytopathology , 89 : 716 – 721 .
- Hong , C. X. , Michailides , T. J. and Holtz , B. A. 1998 . Effects of wounding, inoculum density, and biological control agents on postharvest brown rot of stone fruits . Plant Disease , 82 : 1210 – 1216 .
- Ippolito , S. , El-Ghaouth , A. , Charles , B. C. , Wilson , L. and Wisniewski , M. 2000 . Control of postharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses . Postharvest Biology and Technology , 19 : 265 – 272 .
- Ismail , M. and Zhang , J. Z. 2004 . Post-harvest citrus diseases and their control . Outlooks Pest Management , 15 : 29 – 35 .
- Jijakli , M. H. and Lepoivre , P. 1998 . Characterization of an exo-b-1,3-glucanase produced by Pichia anomala strain K, antagonist of Botrytis cinerea on apples . Phytopathology , 88 : 335 – 343 .
- Llorente , P. , Marquina , D. , Santos , A. , Peinado , M. and Spencer-Martins , I. 1997 . Effect of salt on the killer phenotype of yeasts from olive brines . Applied and Environmental Microbiology , 63 : 1165 – 1167 .
- Long , C. , Wu , Z. and Deng , B. 2005 . Biological control of Penicillium italicum of citrus and Botrytis cinerea of grape by Strain 34–9 of Kloeckera apiculata . Europe Food Research and Technology , 221 : 197 – 201 .
- Lowry , O. H. , Rosebrough , N. J. , Farr , A. L. and Randall , R. J. 1951 . Protein measurement with the folin phenol reagent . Journal of Biological Chemistry , 193 : 265 – 275 .
- Magliani , W. , Conti , S. , Gerloni , M. , Bertolotti , D. and Polonelli , L. 1997 . Yeast killer system . Clinical Microbiology Reviews , 10 : 369 – 400 .
- Nunes , C. , Usall , J. , Teixido , N. and Viñas , I. 2002 . Improvement of Candida sake biocontrol activity against post-harvest decay by the addition of ammonium molybdate . Journal of Applied Microbiology , 92 : 927 – 935 .
- Palou , L. , Usall , J. , Muñoz , J. A. , Smilanick , J. L. and Viñas , I. 2002 . Hot water, sodium carbonate, and sodium bicarbonate for the control of postharvest green and blue molds of clementine mandarins . Postharvest Biology and Technology , 24 : 93 – 96 .
- Rey , M. 1998 . Mejoramiento de cepas de Trichoderma para su utilización como agente de control biológico Tesis Doctoral. Universidad de Sevilla, España
- Rodríguez , L. A. , Abad , D. , Gómez , J. , Casanova , J. B. and Lema , C. 1998 . Fenotipo killer: distribución en la comarca de la Ribeira Sacra en las poblaciones de Saccharomyces cerevisiae . Ciencia y Tecnología Alimentaria , 2 : 33 – 37 .
- Santos , A. , Marquina , D. , Barroso , J. and Peinado , J. M. 2002 . ß-D-glucan as the cell wall binding site for Debaryomyces hansenii killer toxin . Letter in Applied Microbiology , 34 : 95 – 99 .
- Santos , A. and Marquina , D. 2004 . Killer toxin of Pichia membranifaciens and its possible use as a biocontrol agent against grey mould disease of grapevine . Microbiology , 150 : 2527 – 2534 .
- Usall , J. , Teixido , N. , Torres , R. , Ochoa , X. and Viñas , I. 2001 . Pilot test of Candida sake (CPA) applications to control postharvest blue mold on apple fruit . Postharvest Biology and Technology , 21 : 147 – 156 .
- Vero , S. 2006 . “ Mecanismos de biocontrol ” . In Control biológico de patógenos de plantas , Edited by: Mondino , P. and Vero , S. 49 – 78 . Montevideo : Facultad de Agronomía-Unidad de Educación Permanente, Universidad de la República .
- Wilson , C. L. and Wisniewki , M. E. 1989 . Biological control of postharvest diseases of fruits and vegetables: An emerging technology . Annual Review of Phytopathology , 27 : 425 – 441 .
- Wisniewski , M. , Biles , C. , Droby , S. , McLaughlin , R. , Wilson , C. and Chalutz , E. 1991 . Mode of action of the Postharvest biocontrol yeast Pichia guilliermondii: characterization of attachment to Botrytis cinerea . Physiological and Molecular Plant Pathology , 39 : 245 – 258 .
- Yao , H. , Tiana , S. and Wanga , Y. 2004 . Sodium bicarbonate enhances biocontrol efficacy of yeasts on fungal spoilage of pears . International Journal of Food Microbiology , 93 : 297 – 304 .
- Zhang , H. , Zheng , X. and Xi , Y. 2005 . Biological control of postharvest blue mold of oranges by Cryptococcus laurentii (Kufferath) Skinner . BioControl , 50 : 331 – 342 .