Abstract
El objetivo de este estudio fue obtener un pinole de alta calidad funcional a base de vainas de mezquite (Prosopis laevigata). Se llevó a cabo un diseño factorial (3)2 con tres temperaturas de secado (60, 70 y 80°C) y tres de tostado (140, 150 y 160°C) y una muestra control (pinole sin tratamientos térmicos). Se determinó la caracterización proximal, incluyendo proteína soluble, perfil electroforético, digestibilidad de proteínas; Factores antinutrivos como inhibidores de tripsina, lectinas y fenoles; Actividad antioxidante por inhibición de la oxidación de lipoproteínas de baja densidad (LDL); y Capacidad hipotensiva por la inhibición de la Enzima Convertidora de Angiotensina (ACE). La mayor digestibilidad se encontró a 60°C/160°C (74,43±0,38%). La temperatura de secado más alta (80°C) mostró la mayor disminución de inhibidores de tripsina (73%) y lectinas (186,81 U/mg). Asimismo, los fenoles disminuyeron con un incremento de temperatura (secado y tostado). Los extractos de pinole disminuyeron la oxidación de las LDL y los tratamientos térmicos mostraron efecto sobre la inhibición de la actividad de la ACE.
The objective of this study was to prepare a pinole meal made of mesquite pods (Prosopis laevigata) and evaluate its functional properties. A (3)2 experimental design was implemented setting three drying (60, 70, 80°C) and three roasting (140, 150, 160°C) temperatures, and a control sample (pinole without thermal treatment). The product quality was evaluated by proximate analysis, including soluble proteins, electrophoretic profile, and protein digestibility; antinutrient determinations such as trypsin inhibitors, lectins, and phenolics; antioxidant activity by inhibiting the oxidation of low-density lipoproteins (LDL); and the inhibition of the angiotensin converting enzyme (ACE). The major digestibility was obtained at 60°C/160°C (74.43 ± 0.3%). The most effective reduction in trypsin inhibitors (73%), lectins (186.81 U/mg), and phenolics was obtained at higher temperatures (80°C). Pinole extracts have inhibited LDL oxidation and the thermal treatments have shown effect on inhibiting ACE activity.
Palabras clave:
Introducción
El género Prosopis, al cual pertenece el mezquite es una planta silvestre de la familia Leguminosae (Fabaceae), subfamilia Mimosoideae es nativa de Asia, África y América, comprende 44 especies distribuidas en las regiones áridas y semiáridas (Burkart, Citation1976). En México se encuentra principalmente en la vertiente del pacífico desde Michoacán hasta Oaxaca y en la del Golfo de México en Nuevo León, Tamaulipas, y el norte de Veracruz y en las regiones centrales de altura del país hasta los 2,300 m (Gómez, Signoret, & Abuin, 1970). El mezquite produce grandes cantidades de vainas indehiscentes. En promedio las vainas pesan 12 g, la cuales están formadas por tres partes principales: mesocarpio que constituye 56%, endocarpio 35% y semilla 9%. Los frutos de Prosopis spp. Presentan un alto contenido de azúcar (13–50%), fibra (27–32%), proteína (8,1%), cenizas (3,6%), y en menor cantidad compuestos fenólicos (1,2%) (Becker, Sayre, & Saunders, Citation1984; Bravo, Grados, & Saura-Calixto, Citation1994; Grados, Bravo, & Saura-Calixto, Citation1993).Las vainas de mezquite (Prosopis spp.) jugaron un rol importante en el desierto de Sonora, las tribus indias elaboraban harina y pasta con la pulpa de las vainas secas o tostadas (Simpson, Citation1977). Para los rumiantes las vainas y hojas son una fuente económica importante de alimentación (Obeidat, Abdullah, & Al-Lataifeh, Citation2008). Como alimento humano se consumen las vainas en forma de fruta fresca, fruta conservada en su propio jugo dulce, pinole de mezquite, queso de mezquite, piloncillo, atole, harinas o como bebidas fermentadas. La vaina seca es triturada, lo cual da una harina que puede ser mezclada con un poco de agua y consumida inmediatamente (Galindo & García, Citation1986). El jugo extraído del fruto fresco con agua hervida puede ser añadido a la harina de maíz para formar avenate como bebida. La fermentación de los azúcares del fruto produce bebidas alcohólicas como: aloja, añapa y chicha (Galindo & García, Citation1986; Odibo, Ezeaku, & Ogbo, Citation2008). Las semillas son fermentadas para producir condimentos los cuales son consumidos por encima de 1.5 millones de gente (Odibo et al., Citation2008). La goma tiene una consistencia suave y sabor dulce, la cual es usada como dulce para niños.
En el Norte de Argentina, la harina hecha de la pulpa de mezquite es conocida como patay, el cual se sigue consumiendo todavía (Escobar, Estévez, Fuentes, & Venegas, Citation2009). La ausencia de almidón y gluten en la harina de mezquite es una limitación para las formulaciones de pan (Felker, Grados, Cruz, & Prokopiuk, Citation2003). En Brasil se produce un aislado de proteína (Baiao, Gomes, Sant'Anna, & Cruz, Citation1987) de semillas de P. juliflora.Un producto de origen prehispánico elaborado principalmente a base de maíz es el pinole, el cual es definido como una harina de cereales o leguminosas secas y tostadas, a veces endulzado y mezclado con cacao, canela o anís (López, Citation1989). Algunos grupos étnicos mexicanos, como los Tarahumaras, Nahuas, Tepehuanes y Lacandones lo incluyen en su dieta básica. Los granos utilizados para fabricar este producto han cambiado desde la conquista; así se encuentra que en algunas partes de Guanajuato se elabora con garbanzo (Cicer arietinum L.), en Jerez, Zacatecas con haba (Vicia faba L.), arroz (Oriza sativa L.) y semilla de calabaza (Cucurbita pepo L). En el Altiplano mexicano se hace a partir de maíz pinto o bien de amaranto (López, Citation1989). Las etnías Yaquis y Seris ubicadas en el noroeste mexicano en los estados de Baja California y Sonora lo obtienen de la molienda de las vainas de mezquite y lo mezclan con agua para producir un tipo de bebida llamada atole (Felger, Leigh, & Stigers, Citation1979). Otros métodos de trituración manual o mecánica también han demostrado su eficacia para el procesamiento de las vainas de Prosopis (Del Valle, Marco, Becker, & Saunders, Citation1987; Grados & Cruz, Citation1996; Meyer, Becker, & Neukom, Citation1982; Saunders et al., Citation1986).
Al respecto, en especial en relación a su composición proximal han sido realizados algunos estudios (Briones-Labarca, Muñoz, & Maureira, Citation2011). Por otro lado con respecto a su potencial beneficio a la salud, los documentos han sido más bien escasos. Barba, Frias, Olalde, y González (2006), documentaron la presencia de fenoles en harinas de Prosopis, en tanto que Cardozo et al. (Citation2010) documentaron la actividad antioxidante y genotóxica de harinas de Prosopis spp. Igualmente escasos son los reportes sobre la influencia de diferentes tratamientos térmicos sobre la capacidad antioxidante de harinas de Prosopis o bien sobre el desarrollo de diversos productos y su efecto sobre compuestos con actividad antioxidante. Estévez, Escobar, y Ugarte (2000) documentaron el empleo de harina de Prosopis spp. para la obtención de barras de cereal. Barba et al. (Citation2006) evaluaron el efecto del tratamiento térmico sobre factores antinutricios presentes en la harina de Prosopis, así como en el contenido de fenoles. Se han reportado cambios en la capacidad antioxidante de Prosopis nigra y Prosopis alba cuando estas fueron secadas a 50°C hasta obtener un peso constante y una posterior extracción de los compuestos fenólicos con etanol y agua a ebullición por 20 min, mostrando que el potencial antioxidante es significativamente más alto en harina de P. nigra que en harina de P. alba y en extractos acuosos que en extractos alcohólicos (Cardozo et al., Citation2010). Por otro lado, Zunt et al. (Citation2001) reportaron una disminución del colesterol LDL luego de la administración de un preparado con pulpa de algarrobo rico en fibra dietética y polifenoles en pacientes con hipercolesterolemia.
En el caso del sistema angiotensina – renina – aldosterona, juega un papel fundamental en el control de la presión sanguínea de los animales. La renina cataliza la liberación de la angiotensina 1, el cual es un decapéptido inactivo. La enzima convertidora de angiotensina (ACE) es la encargada de activarlo, al hacerlo se produce la angiotensina II, la cual eleva la presión sanguínea por vasoconstricción y por síntesis y liberación de aldosterona (Inoue, Takahashi, & Miyake, 1992). Diversos autores han encontrado que la inhibición de la actividad de ACE puede ser atribuida a compuestos polifenólicos como los encontrados en las leguminosas.
El objetivo del presente trabajo es determinar el efecto de procesamiento (secado/tostado) sobre las características antioxidantes de pinole a base de vainas de mezquite (Prosopis laevigata).
Materiales y métodos
Materia prima
Se emplearon vainas de mezquite de la especie Prosopis laevigata. Las vainas fueron donadas por el Instituto Nacional de Investigaciones Forestales, Agricolas y pecuarias (INIFAP), Valle del Guadiana, la cual se recolectó en Las Mercedes, Cuencamé, Durango, ubicada a 1420 msnm, recolectada durante la cosecha 2008, posteriormente se identificó en el herbario del CIIDIR-IPN unidad Durango.
Preparación de pinole
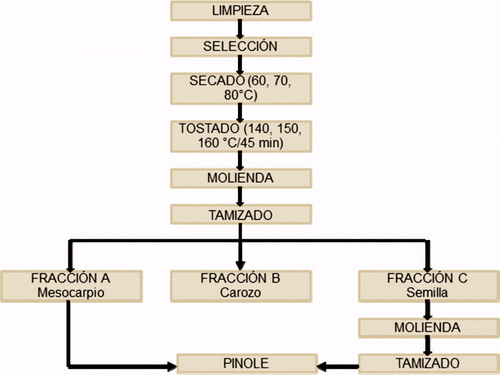
Después de la limpieza () se realizó un acondicionamiento de las vainas que incluyó: a) como primera operación se realizó un secado a tres diferentes temperaturas (60, 70 y 80°C) en un secador de charolas (APEX, México, D.F) hasta obtener una humedad al equilibrio secado a 60°C: 3,50 ± 0,41% durante 170 min, a 70°C 3,23 ± 0,33% durante 140 min y a 80°C: 3,31 ± 0,32% durante 130 min, b) las vainas secadas de acuerdo al procedimeinto indicado en (a) fueron sometidas a un proceso de tostado (140°C, 150°C y 160°C) durante 45 min sobre un comal de cerámica con arena en una relación vainas-arena 1:5. Al final del tostado, las vainas se limpiaron para eliminar el polvo y se almacenaron a −84°C, c) Las vainas secadas y tostadas de acuerdo con las condiciones descritas en (a) y (b) fueron sometidas a un proceso de molienda en un molino de cuchillas (APEX, México, DF) y posterior cribado a malla 80. En el caso de las semillas, estas se separaron manualmente y se molieron empleando un molino Moulinex tipo 645, finalmente fueron tamizadas empleando una malla 80. Para la preparación del pinole se mezclaron las harinas obtenidas del mesocarpio y la semilla, constituyendo esta última un 10% de la mezcla.
Caracterización proximal
Las muestras de pinole fueron almacenadas a 4°C hasta su uso. En las muestras de pinole obtenido a partir de las harinas de las vainas (tratadas y sin tratar), se determinó el contenido de nitrógeno proteico usando el método de micro-Kjeldahl, empleando el factor de conversión de 6,25. Se determinó humedad, fibra cruda, grasa y cenizas (AOAC, Citation1975). El contenido de carbohidratos fue calculado por diferencia.
Extracción de proteínas
En las muestras de pinole obtenido a partir de las harinas de las vainas (tratadas y sin tratar) se desengrasaron con una solución de cloroformo-metanol 2:1 (v/v). Al material desengrasado se le realizó una extracción sucesiva de proteínas, empleando agua, solución buffer de fosfatos, ácido acético 0,5 N y etanol. Después de centrifugar por 10 min a 3500 rpm, para cada uno de los solventes empleados en la extracción, el sobrenadante se almacenó a 4°C para su uso inmediato y el pellet se suspendió en los solventes restantes.
Proteína soluble
El contenido de proteína soluble se determinó empleando el método descrito por Barba et al. (Citation2006). Se realizó una curva de calibración en la que se utilizó seroalbúmina bovina en un rango de concentración de 0 a 100 μg/mL.
Perfil electroforético
Se utilizaron como estándares proteínas de 66 a 14,2 kDa y geles de poliacrilamida al 12,5% en gel separador y 4% en gel concentrador. El volumen de muestra inyectado fue de 10 a 15 μL de cada uno de los extractos de albúminas y globulinas. El análisis electroforético se realizó con una corriente constante de 80 V/gel durante 2,5 h a 4°C. Al término de ésta, los geles se tiñeron con una solución de azul de Coomassie G-250 al 0,025%, 40% metanol y 7% ácido acético durante 4h. Posteriormente fueron decolorados en solución de desteñido I (40% metanol, 7% ácido acético) durante 12 h y posteriormente con una solución desteñido II (7% ácido acético y 5% metanol) (Laemmli, Citation1970).
Digestibilidad in vitro de proteína
La digestibilidad in vitro de proteína en las muestras de pinole obtenido a partir de las harinas de las vainas (tratadas y sin tratar) se determinó usando el método propuesto por Hsu, Vavak, Satterlee, y Miller (1977).
Factores antinutricios
El contenido total de inhibidores de tripsina fue estimado por el método (AOAC, Citation1975) (Ba 12–75), empleando un espectofotómetro Cary UV-Vis (Varian, Palo Alto, CA, USA) a 410 nm.
El contenido de lectinas se determinó empleando el método modificado de Jaffé (Citation1980), el cual consiste en una técnica de diluciones seriadas, en donde se determina el punto final de aglutinación por una estimación al microscopio de eritrocitos de sangre de conejo.
Extracción de compuestos fenólicos
Las muestras fueron desengrasadas con éter de petróleo. Posteriormente se extrajeron los compuestos fenólicos con una solución acuosa de acetona (70%) (24 h en una agitación). Luego se filtraron y concentraron los extractos crudos en un rotavapor (Buchi R-200/250) (Flawil, Suiza). El extracto acetónico fue liofilizado (8 mbar, −50°C, 48–72 h).
Polifenoles totales
El contenido de polifenoles totales se determino por el método de Folin Ciocalteu, descrito por Heimler, Vignolini, Dini, y Romani (2005). Se realizó una curva de catequina y una de ácido gálico como estándar en un rango de concentración de 0 a 140 ppm obtenidos de Sigma Chemical (St. Louis, MO, USA). El contenido de polifenoles en los extractos fue calculado con la curva de calibración de los estándares.
Inhibición de la oxidación de lipoproteínas de baja densidad (LDL)
El plasma recolectado de dos individuos sanos fue donado por el Hospital General del estado de Durango, México. Posteriormente se precipitaron las LDL del plasma empleando el kit de LDL-Colesterol provisto por Wiener Lab (Rosario, Santa Fe, Argentina). El ensayo se realizó de acuerdo a la metodología descrita por Loy, Simon, y Delgado (2002).
Inhibición de la actividad de la enzima convertidora de angiotensina
La inhibición de la actividad de la enzima convertidora de angiotensina (ACE) se determinó de acuerdo al método descrito por Cushman y Cheung (1971). Empleando captopril como control positivo. Las muestras fueron incubadas solo a una concentración (1000 ppm) con la ACE a 37°C por 30 min. La inhibición fue calculada empleando la siguiente ecuación:
Análisis estadístico
Se empleó un diseño experimental factorial completamente aleatorizado 32 (dos factores a tres niveles) junto a un grupo control Los resultados fueron analizados mediante análisis de varianza (p < 0.05). En el caso de diferencias significativas, se realizó una prueba de comparación de medias mediante la prueba de Tukey utilizando el software STATISTICA (StatSoft, Tulsa, OK, EUA).
Resultados
Caracterización proximal
Los valores de proteína cruda (21,20 ± 0,90 - 22,60 ± 0,18); fibra (2,38 ± 0,22 - 3,93 ± 0,77) y cenizas (5,28 ± 0,22 - 5,83 ± 0,30) (5–6% bs) (), no mostraron diferencias estadísticas con respecto a los tratamientos térmicos efectuados (secado p = 0,85; tostado p = 0,62 y la interacción secado * tostado p = 0,65) para el caso de la proteína cruda. En el caso de fibra los valores de p encontrados fueron secado p = 0,89, tostado p = 0,92, interacción 0,74. Cenizas secado p = 0,93, tostado p = 0,90, interacción p = 0,81).
Tabla 1. Composición proximal de pinole sometido a diferentes tratamientos térmicos de secado y tostado.
Table 1. Proximate composition of pinole at different thermal treatments of drying and roasting.
Proteína soluble
En dos de los tres grupos de temperatura de secado que se manejaron (60, 70°C ) así como en la condición 80/140°C las albúminas (1,72 ± 0,02 - 2,70 ± 0,17 mg/g) disminuyeron con respecto a la observada a la muestra sin tratamiento térmico (3,00 ± 0,06) e . En el caso de muestras secadas a 80° C y tostadas a 150 y 160°C, en donde se observó un incremento en albuminas (3,79 ± 0,07 mg/g) ().
Tabla 2. Contenido de proteína soluble en los diferentes extractos de pinole.
Table 2. Soluble protein content in the different extracts of pinole.
En el caso de globulinas, el valor mas alto fue observado en el pinole sin tratamiento térmico (2,27 ± 0,22), en todos los casos se observó una disminución en el contenido de globulinas debido a los tratamientos térmicos, con la excepción de la condición menos severa (60/140°C). La disminución mas drástica fue observada a 80/160°C (0,01 ± 0,00).
El comportamiento de gluteninas no mostró diferencias con respecto al control en el caso de los tratamientos térmicamente menos severos (60/140°C, 60/150°C, 60/160°C y 70/140°C); mientras que a medida que el tratamiento térmico era mas severo, la cantidad de gluteninas presente era menor.
El contenido de prolaminas fue en general el mas bajo de todas las fracciones analizadas. El valor mas alto de ellas fue observado en la condición 80/160°C.
Perfil electroforético
En las y 2B se muestra la electroforesis correspondiente a las albúminas, en el cual, el control y las muestras presentan bandas tanto de alta como de baja masa molecular (69,000–12,000 Da) que incluyen los peso moleculares correspondientes a los estándares. En tanto que en las y 3B se muestra la electroforesis correspondiente a los extractos de globulinas de pinole.
Figura 2. Electroforesis SDS-PAGE de extracto de albúminas (A y B) y globulinas (C y D) de pinole de los tratamientos térmicos aplicados. A: Estándares, B: Faseolina, C: Pinole sin tratamiento térmico, 4: 60°C/140°C, 5: 60°C/150°C, 6: 60°C/160°C, 7: 70°C/140°C, 8: 70°C/150, 9: 70°C/160°C, 10: 80°C/140°C, 11: 80°C/150°C, 12: 80°C/160°C. Peso molecular en kDa.
Figure 2. SDS-PAGE electrophoresis of albumins (A and B) and globulins (C and D). Line 1 = molecular weight standard, line 2 = phaseolin, line 3 = pinole without thermal treatment, 4: 60°C/140°C, 5: 60°C/150°C, 6: 60°C/160°C, 7: 70°C/140°C, 8: 70°C/150, 9: 70°C/160°C, 10: 80°C/140°C, 11: 80°C/150°C, 12: 80°C/160°C.

Digestibilidad
En la se muestran los porcentajes de digestibilidad para las diferentes muestras de pinole, en el cual se observa que en comparación con la muestra sin tratamiento térmico la cual tuvo 71% de digestibilidad esta aumento a 74% en el pinole secado a 60°C y tostado a 160°C siendo esta la muestra con un mayor porcentaje de digestibilidad, seguido por la muestra secada a 60°C y tostada a 140°C con un porcentaje de digestibilidad de 73%.
Lectinas
Los resultados de lectinas en las muestras de estudio se presentan en la . La muestra control sin tratamiento térmico mostró una mayor actividad específica (40960 U/mg), se tuvo un decremento significativamente diferente de 5120 U/mg en el pinole secado a 60°C y tostado a 140°C, mientras que en el pinole secado a 70°C y tostado a 140°C se detectó una actividad específica de 2327,27 U/mg, en el pinole secado a 80°C y tostado a 140°C se detectó la menor actividad específica (1280 U/mg) respecto a todos los tratamientos térmicos. Sin embargo, el pinole secado a 60°C y tostado a 150°C muestra una actividad similar (7529,41 U/mg) al pinole secado a 70°C y tostado a 160°C (7032 U/mg).
Inhibidores de tripsina
Los resultados de inhibidores de tripsina son presentados en la . En donde se aprecia que estos disminuyeron al incremento de temperatura, así en los tratamientos a 60°C se redujo un 60%, a 70°C un 65% y a 80°C un 73% de la cantidad total en comparación con la muestra sin tratamiento térmico.
Polifenoles totales
En la se muestra el contenido de polifenoles, se observa que los tratamientos térmicos tuvieron un efecto significativo (p < 0.05) sobre estos compuestos. El control muestra 22,46 ± 0,51 mg de ácido gálico/g de extracto, mientras que las muestras secadas a 60°C sufrieron modificaciones ya que a 60°C/140°C y 60°C/150°C se redujo el contenido de compuestos fenólicos en un rango entre 43–30%, en las muestras a 70°C/140°C y 70°C/150°C se redujo un 66–63%, y en las muestras a 80°C/140°C y 80°C/150°C se redujo de un 37–20%. Se observó que en los tres tratamientos térmicos de secado en combinación con la temperatura de tostado de 160°C se obtuvo una menor reducción de compuestos fenólicos de alrededor de un 17 y 16%, finalmente la muestra en la que se incrementaron un 8% estos compuestos en comparación con la muestra sin tratamientos térmicos fue a 60°C/160°C (23,96 ± 0,276 mg de ácido gálico/gextracto).
Inhibición de la oxidación de la LDL
La dosis ensayada mostró una acción antioxidante, ya que permitió una discreta formación de peróxidos lipídicos en las lipoproteínas de baja densidad al cabo de las 3 h de incubación. En la se muestra el porcentaje de inhibición en la oxidación de LDL en las muestras de pinole. Se observa que la combinación de los tratamientos térmicos aplicados tuvo un efecto significativo (p < 0.05), el control mostró 67,41 ± 4,03% en la inhibición de la oxidación de LDL, en las muestras secadas a 60°C. De acuerdo con el análisis estadístico realizado, solo se observó un decremento en la capacidad de inhibición de la oxidación de las LDL a la condición de 60°C/150°C (43,04 ± 1,44%). El resto de los tratamientos no mostró diferencias significativas.
Inhibición de la actividad de ACE
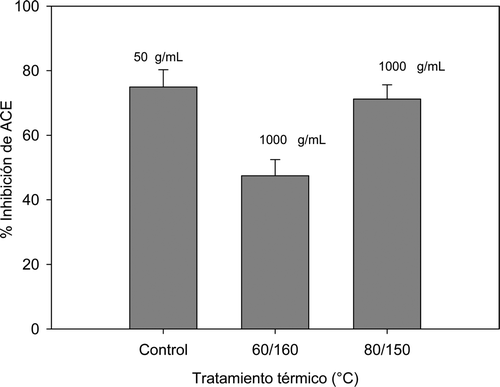
El porcentaje de inhibición de la actividad de ACE () fue mayor para el control (captopril a una concentración de 50 μg/mL) (74,96 ± 5,33%) en comparación con las muestras de pinole, en donde solo se obtuvo respuesta a una concentración de 1000 μg/mL, para las condiciones 80°C/150°C que mostró un porcentaje de inhibición (71,19 ± 4,44%). Así como para la muestra 60°C/160°C, en donde el porcentaje de inhibición disminuyó alrededor de un 30% (p < 0.05), con respecto a la condición 80°/150°C. El resto de las condiciones experimentales no mostró inhibición de la actividad de ACE.
Discusión de resultados
Análisis proximal
Los valores de proteína cruda encontrados fueron superiores a los citados por Lozano, Solórzano, Bernal, Rebolledo, y Jacinto (2008) para pinole de maíz (10%) y pinole elaborado a partir de una mezcla de maíz, amaranto, garbanzo, haba y lenteja (14–15%). En el caso de fibra, los valores encontrados fueron similares a los reportados por Barba et al. (Citation2006) para harina de mezquite. Así como para harina de P. glandulosa (Zolfaghari, Harden, & Huffman, Citation1986). Los valores de cenizas son similares a los reportados para Prosopis Spp (Del Valle, Escobedo, Muñoz, Ortega, & Bourges, Citation1983). Aun cuando se ha reportado valores de entre 1–4% para P. juliflora, P. velutina y P. glandulosa (Del Valle et al., Citation1987; Zolfaghari et al., Citation1986).
Proteína soluble
Los cambios más importantes en proteína soluble (p ≤ 0.05) en las diferentes fracciones de proteína del pinole fueron observados en las globulinas y gluteninas, ya que presentaron una tendencia a disminuir, conforme la temperatura aumentaba en los tratamientos de secado y tostado. Similar comportamiento fue observado en gluteninas de trigo micronizado (Sun, Watts, Lukow, & Arntfield, Citation2006). Por otro lado las prolaminas, se incrementaron con el aumento de temperatura en comparación con el control (0,42 ± 0,06 mg/g). La variación observada puede deberse, en parte a la desnaturalización que sufren las proteínas dando origen a una modificación en su conformación nativa. En términos generales, una disminución en el contenido de proteína soluble ha sido asociada a un incremento en las interacciones no covalentes entre cadenas polipeptídicas y otros contituyentes ademas de asociarlas a la formación de nuevos enlaces disulfuro (Jeunink & Cheftel, Citation1979).
Electroforesis
El comportamiento electroforético de las albuminas es mostrado en las y 2B, en donde se observa una similitud entre el control y el tratamiento térmico 60°C/140°C lo que indica estabilidad térmica. Sin embargo en las muestras restantes (temperaturas de proceso más elevadas) se aprecia que existe diferencia entre la apariencia de las bandas presentes en el control y el resto de los tratamientos térmicos, debido a que se rompen los puentes disulfuro en la cadena polipeptídica que ayudan a estabilizar la estructura terciaria y cuaternaria, esto se nota en el cambio de las masas moleculares. El comportamiento de las globulinas se muestra en las y 2D, en el cual se observó en la mayoría de las muestras tratadas térmicamente la desnaturalización de la proteína con mayor peso molecular (67,000 Da), a excepción del tratamiento 60°C/140°C que presentó la mayoría de las bandas que se encuentran en el control. se detectó la presencia de una proteína de peso molecular similar a la faseolina en todos los tratamientos térmicos (incluyendo el control), encontrándose también una banda de peso molecular de alrededor de 42,500 Da; en la mayoría de las muestras predominó una banda con peso similar al estándar 3 que corresponde al gliceraldehído-3–fosfato deshidrogenasa con un peso de 36,000 Da y otra de 21,000 Da, la cual coincide con el peso molecular del inhibidor de tripsina de soya (Glycine max).
Digestibilidad in vitro
El incremento en la digestibilidad de proteína en leguminosas es atribuido no solamente a la remoción de antinutrientes, sino además a la desintegración estructural de la proteína nativa. Valores similares de digestibilidad han sido reportados para P. juliflora (De Monte-Negreiros, Citation1992; Marangoni & Alli, Citation1987) y para P. laevigata, según (Barba et al., Citation2006) con una digestibilidad de 77 y 78%. (Lozano et al., Citation2008) reportaron valores mayores de digestibilidad de 84,5% en pinole elaborado a partir cereal-leguminosa (maíz, amaranto, garbanzo, haba y lenteja) y 81,9% para pinole de maíz.
Inhibidores de tripsina
En el caso de los inhibidores de tripsina, no se logró inactivar por completo estos compuestos quedando parte de ellos, debido a que existen dos tipos de inhibidores: el inhibidor de tripsina de Kunitz (KTI) tiene una masa molecular de 20 kDa y su actividad no se modifica en el rango de pH 1–14 y es sensible al calor, pero es térmicamente estable en condiciones de baja humedad (Lin & Ng, Citation2008). Condiciones que se encontraban en el desarrollo del pinole. Así mismo, el inhibidor de Bowman-Birk (BBTI) que resiste las temperaturas de cocción y pH del estómago humano debido al alto número de puentes disulfuro en su estructura.
Polifenoles
Los cambios observados en el contenido de polifenoles totales, encontrados en el presente trabajo coinciden con lo reportado por (Xu, Ye, Chen, & Liu, Citation2007), quienes en encontraron que el efecto de la temperatura sobre la estabilidad de los fenoles en general se reducen al combinar temperatura y tiempo, lo cual indica que existe una destrucción de algunos fenoles debido al tratamiento térmico principalmente, sin embargo también observaron que en algunos casos se incrementaba la fracción de los ácidos fenólicos libres, ocurriendo una redistribución de los mismos, esto debido probablemente a la ruptura de los fenoles unidos a otros compuestos como los esterificados o los glicosilados. El contenido de polifenoles totales obtenidos en este trabajo fueron mayores a los reportados por Zunt et al. (Citation2001) en pulpa de Prosopis pallida L, la cual contenía 12,40 ± 0,40 de polifenoles solubles. Así como los reportados por Cardozo et al. (Citation2010) en harinas de Prosopis alba y Prosopis nigra con un contenido fenólico en extractos acuosos de 0,40 ± 0,01 g GAE/100 g y en extractos etanólicos 0,18 ± 0,00 g GAE/100 g. En todo caso las diferencias pueden estar asociadas con la diferente especie trabajada, así como por las distintas condiciones de suelo, humedad y clima.
Inhibición de la oxidación de LDL
Los cambios en la capacidad antioxidante, asociada a la inhibición de la oxidación de lipoproteínas de baja densidad (LDL), mostrada por los extractos de pinole de mezquite pueden atribuirse a los tiempos de secado ya que a 60°C el tiempo fue de 170 min, a 70°C 140 min y a 80°C 130 min, en combinación con el tostado, debido a que la única condición que mostró una disminución fue observada a 60°C/150°C. En el caso de la temperatura de secado, se han reportado cambios en la capacidad antioxidante de Prosopis nigra y Prosopis alba cuando estas fueron secadas a 50°C hasta obtener un peso constante y una posterior extracción de los compuestos fenólicos con etanol y agua a ebullición por 20 min, mostrando que el potencial antioxidante es significativamente más alto en harina de P. nigra que en harina de P. alba y en extractos acuosos que en extractos alcohólicos (Cardozo et al., Citation2010). Por otro lado, Zunt et al. (Citation2001) reportaron una disminución del colesterol LDL luego de la administración de un preparado con pulpa de algarrobo rico en fibra dietética y polifenoles en pacientes con hipercolesterolemia.
Inhibición de la actividad de la ACE
En comparación con el estándar captopril que es el hipotensor más ampliamente utilizado y primero de la serie utilizado en clínica (Anderson, Karlberg, Lindgren, Persson, & Rosenqvist, Citation1991), los extractos de las muestras tratadas térmicamente presentaron un porcentaje de inhibición mucho menor, ya que el captopril, para inhibir 80%, requirió de 50 μg/mL, en tanto que el pinole, solo en dos condiciones de proceso mostró actividad inhibitoria contra ACE, pero a concentraciones muy elevadas (1000 μg/mL). Estos resultados no concuerdan con lo reportado por Sreerama, Sashikala, y Pratape (2012) quienes encontraron en extractos alcohólicos de Macrotyloma uniflorum una inhibición de 67,3% de la actividad de ACE a una concentración de 40 μg/mL. Si bien se ha reportado que algunos compuestos polifenólicos presentan inhibición de la enzima ACE (Ranilla, Kwon, Genovese, Lajolo, & Shetty, Citation2010). Takahashi, Hori, Kumagai, y Wakabayashi (2007) reportan que la actividad inhibitoria de ACE-1 en las leguminosas puede agruparse en dos, una de alta actividad con valores de IC50 de entre 240 y 420 μg/mL y las de baja actividad con concentraciones de IC50 que se encuentran en el rango de 1600–1900 μg/mL. En base a lo anterior se puede inferir que el pinole de mezquite es de baja actividad.
Conclusiones
La temperatura de secado más alta (80°C) mostró la mayor disminución de inhibidores de tripsina. El contenido de polifenoles totales disminuyó conforme se incrementaba la temperatura. Los extractos de pinole en general no vieron afectada su capacidad de inhibir la oxidación de las LDL por efecto de la temperatura. Los tratamientos térmicos mostraron efecto sobre la inhibición de la actividad de la ACE, ya que gran parte de las muestras de pinole no mostró actividad contra ACE. Los resultados demuestran que el pinole de mezquite (Prosopis laevigata) es una buena fuente de alimento para el ser humano.
Agradecimientos
Este trabajo fue financiado parcialmente por DGEST. MGC agradece la beca de parte de Conacyt.
Referencias
- Anderson , R.G.G. , Karlberg , B.E. , Lindgren , B.R. , Persson , K. and Rosenqvist , U. 1991 . Enalaprilat, but not cilazapri-lat, increases inflammatory skin reactions in guinea pigs . Drugs , 41 ( suppl 1 ) : 49 – 53 .
- AOAC . 1975 . Official methods and recommended practices , Urbana/Champaign , IL : AOAC Press .
- Baiao , V.B. , Gomes , J.C. , Sant'Anna , R. and Cruz , R. 1987 . Chemical characteristics of mesquite beans (Prosopis juliflora) and amino acid composition of concentrate and a protein isolate . Arquivos de Biologia e Technologia , 30 : 275 – 286 .
- Barba , A.R. , Frias , J.H. , Olalde , V.P. and González , J.C. 2006 . Processing, nutritional evaluation, and utilization of whole mesquite flour (Prosopis laevigata . Journal of Food Science , 71 : S315 – S320 .
- Becker , R. , Sayre , R.N. and Saunders , R.M. 1984 . Semiarid legume crops as protein resources . Journal of American Oil Chemist' Society , 61 : 931 – 938 .
- Bravo , L. , Grados , N. and Saura-Calixto , F. 1994 . Composition and potential uses of mesquite pods (Prosopis pallida L): Comparison with carob pods (Ceratonia siliqua L) . Journal of the Science and Food Agriculture , 65 : 303 – 306 .
- Briones-Labarca , V. , Muñoz , C. and Maureira , H. 2011 . Effect of high hydrostatic pressure on antioxidant capacity, mineral and starch bioaccessibility of a non conventional food: Prosopis chilensis seed . Food Research International , 44 : 875 – 883 .
- Burkart , A. 1976 . A monograph of the genus Prosopis (Leguminosae subfam. Mimosoideae) . Journal of the Arnold Arboretum , 57 : 219 – 249 . 450–525
- Cardozo , M.L. , Ordoñez , R.M. , Zampini , I.C. , Cuello , A.S. , Dibenedetto , G. and Isla , M.I. 2010 . Evaluation of antioxidant capacity, genotoxicity and polyphenol content of non conventional foods: Prosopis flour . Food Research International , 43 : 1505 – 1510 .
- Cushman , D.W. and Cheung , H.S. 1971 . Spectrophotometric assay and properties of angiotensin-converting enzyme of rabbit lung . Biochemical Pharmacology , 20 : 1637 – 1648 .
- De Monte-Negreiros , N.A. 1992 . “ Processing and utilization of P. juliflora as an alternative source of food ” . In Prosopis species. Aspects of their value, research and development cord , Edited by: Dutton , R.W. 277 – 291 . Durham : Cerure for overseas .
- Del Valle , F. , Escobedo , M. , Muñoz , M.J. , Ortega , R. and Bourges , H. 1983 . Chemical and nutritional studies on mesquite beans (Prosopis juliflora) . Journal of Food Science , 48 : 914 – 919 .
- Del Valle , F. , Marco , E. , Becker , R. and Saunders , R.M. 1987 . Development and evaluation of a procedure to produce mesquite (Prosopis spp.) pod protein-concentrate . Journal of Food Processing and Preservation , 11 : 237 – 246 .
- Escobar , B. , Estévez , A.M. , Fuentes , C. and Venegas , D. 2009 . Use de algarrobo (Prosopis chilensis (Mol) Stuntz) flour as protein and dietary fiber source in cookies and fried chips manufacture . Archivos Latinoamericanos de Nutrición , 59 : 191 – 198 .
- Estévez , A. , Escobar , B. and Ugarte , V. 2000 . Utilización de cotiledones de algarrobo (Prosopis chilensis (Mol) Stunz) en la elaboración de barras de cereales . Archivos Latinoamericanos de Nutrición , 50 : 148 – 151 .
- Felger , C.D. , Leigh , S.L. and Stigers , C. Semillas Mágicas del Desierto: Un Modelo de Agricultura Apropriada del Desierto Sonorense . Proceedings of the IV Simposio Sobre el Medio Ambiente del Golfo de California . pp. 70 – 80 .
- Felker , P. , Grados , N. , Cruz , G. and Prokopiuk , D. 2003 . Economic assessment of production of flour from Prosopis alba and P. pallida pods for human food applications . Journal of Arid Environments , 53 ( 3 ) : 517 – 528 .
- Galindo , S.A. and García , E.M. 1986 . The uses of mesquite (Prosopis spp.) in the highlands of San Luis Potosi, Mexico . Forest Ecology and Management , 16 ( 1 ) : 49 – 56 .
- Gómez , F. , Signoret , J. and Abuín , M.C. 1970 . Mezquites y Huizaches. Algunos Aspectos de la Economía, Ecología y Taxonomía de los Géneros, Prosopis y Acacia en México , A.C. México , D.F : Instituto Mexicano de Recursos Naturales Renovables .
- Grados , N. , Bravo , L. and Saura-Calixto , F. 1993 . Aplicaciones de algarroba peruana (Prosopis pallida) y mediterránea (Ceratonia siliqua) en la industria alimentaria . Alimentaria , 11 ( 1 ) : 71 – 76 .
- Grados , N. and Cruz , G. 1996 . “ New approaches to industrialization of algarrobo (Prosopis pallida) pods in Peru ” . In Prosopis: Semiarid fuelwood and forage tree; building consensus for the disenfranchised , Edited by: Felker , P. and Moss , J. 325 – 342 . Kingsville , Texas : Center for Semi-Arid Forest Resources .
- Heimler , D. , Vignolini , P. , Dini , M. and Romani , A. 2005 . Rapid tests to assess the antioxidant activity of Phaseolus vulgaris L. dry beans . Journal of Agriculture and Food Chemistry , 53 : 3053 – 3056 .
- Hsu , H.W. , Vavak , D.L. , Satterlee , L.D. and Miller , G.A. 1977 . A multienzyme technique for estimating protein digestibility . Journal of Food Science , 42 : 1269 – 1273 .
- Inoue , H. , Takahashi , S. and Miyake , Y. 1992 . Modulation of Active Renin Secretion by Renin-Binding Protein (RnBP) in Mouse Pituitary AtT-20 Cells Transfected with Human Renin and RnBP cDNAs . Journal of Biochemistry , 111 : 407 – 412 .
- Jaffé , W.G. 1980 . “ Haemaglutins (lectins) ” . In Toxic constituents of plants food stuffs , Edited by: Liener , I.E. 264 – 290 . 2nd ed. New York : Academic Press .
- Jeunink , J. and Cheftel , J.C. 1979 . Chemical and physicochemical changes in field bean and soy bean protein texturized by extrusion . Journal of Food Science , 44 : 1322 – 1327 .
- Laemmli , U.K. 1970 . Cleavage of structural proteins during the assembly of the head of bacteriophage T4 . Nature , 277 : 680 – 685 .
- Lin , P. and Ng , T.B. 2008 . A stable trypsin inhibitor from Chinese dull black soybeans with potentially exploitable activities . Process Biochemistry , 43 : 992 – 998 .
- López , T.A. 1989 . El hambre. 2a parte. Editorial Escuela Superior De Agricultura Hermanos Escobar 82
- Loy , S. , Simon , R. and Delgado , R. 2002 . Vimang, un potencial protector de la peroxidación lipídica en lipoproteínas de baja densidad . Rev. Cubana Investigación Biomédica , 21 : 167 – 170 .
- Lozano , O.A. , Solórzano , E.V. , Bernal , I.L. , Rebolledo , H.R. and Jacinto , C.H. 2008 . Pinole de alto valor nutricional obtenido a partir de cereales y leguminosas . Revista de Sociedad, Cultura y Desarrollo Sustentable , 4 : 283 – 294 .
- Marangoni , A. and Alli , I. 1987 . Composition and properties of seeds and pods of the tree legume Prosopis juliflora (DC) . Journal of the Science and Food Agriculture , 44 : 99 – 110 .
- Meyer , D. , Becker , R. and Neukom , H. 1982 . “ Milling and separation of Prosopis pod components and their application in food products ” . In Mesquite utilization , Edited by: Parker , H.W. L1 – L12 . Lubbock , TX : Texas Tech University .
- Obeidat , B.S., , Abdullah , A. and Al-Lataifeh , F.A. 2008 . The effect of partial replacement of barley grains by Prosopis juliflora pods on growth performance, nutrient intake, digestibility, and carcass characteristics of Awassi lambs fed finishing diets . Animal Feed Science and Technology , 146 : 42 – 54 .
- Odibo , F.J. , Ezeaku , E.O. and Ogbo , F.C. 2008 . Biochemical changes during the fermentation of Prosopis africana seeds for ogiri-okpei production . Journal of Industrial Microbiological Biotechnology , 35 : 947 – 952 .
- Ranilla , L.G. , Kwon , Y.-I. , Genovese , M.I. , Lajolo , F.M. and Shetty , K. 2010 . Effect of thermal treatment on phenolic compounds and functionality linked to type 2 diabetes and hypertension management of Peruvian and Brazilian bean cultivars (Phaseolus vulgaris L.) using in vitro methods . Journal of Food Biochemistry , 34 : 329 – 355 .
- Saunders , R.M. , Becker , R. , Meyer , D. , Del Valle , F.R. , Bellestin , E.M. and Torres , M.E. 1986 . Identification of commercial milling techniques to produce high sugar, high fiber, high protein and high galactomannan gum fractions from Prosopis pods . Forest Ecology and Management , 16 ( 1 ) : 169 – 181 .
- Simpson , B.B. 1977 . Mesquite, its biology in two desert shrub ecosystems , Stroudsburg , PA : Dowden, Hutchinson and Ross .
- Sreerama , Y.N. , Sashikala , V.B. and Pratape , V.M. 2012 . Phenolic compounds in cowpea and horse gram flours in comparison to chickpea flour: Evaluation of their antioxidant and enzyme inhibitory properties associated with hyperglycemia and hypertension . Food Chemistry , 133 ( 1 ) : 156 – 162 .
- Sun , S. , Watts , B.M. , Lukow , O.M. and Arntfield , S.D. 2006 . Effects of micronization on protein rheological properties of spring wheat . Cereal Chemistry , 83 : 340 – 347 .
- Takahashi , S. , Hori , K. , Kumagai , M. and Wakabayashi , S. 2007 . Human renin inhibitory activity in legumes . Journal of Biological Macromolecules , 7 : 49 – 54 .
- Xu , G. , Ye , X. , Chen , J. and Liu , D. 2007 . Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract . Journal of Agriculture and Food Chemistry , 55 ( 1 ) : 330 – 335 .
- Zolfaghari , R. , Harden , M. and Huffman , L. 1986 . Some physical and chemical properties of honey mesquite pod (Prosopis glandulosa) and applications in food products . Cereal Chemistry , 63 ( 1 ) : 104 – 108 .
- Zunt , H.J.F. , Luder , W. , Harde , A. , Haber , B. , Graubaum , H.J. and Gruenwald , J. 2001 . Carob preparation for treatment of hypercholesterolemia . Advanced Therapy , 18 ( 1 ) : 230 – 236 .