Abstract
Microencapsulation by molecular inclusion technique was applied by using β-cyclodextrin to reduce the degradation of carotenoids and capsaicin present in the habanero chili oleoresin. The molecular inclusion complex was prepared in the proportions 20:80 and 30:70 oleoresin:β-cyclodextrin, respectively, and stored for 5 weeks in a range of aw = 0.103–0.765 at 25, 35 and 45 °C, determining weekly total carotenoid contents (UV-Vis) and capsaicin (High Performance Liquid Cromatography (HPLC)). The molecular inclusion complex in the ratio 30:70 stored at 25 °C had a greater retention of total carotenoids and capsaicin at aw = 0.536 and 0.765, respectively, showing the highest shelf life values (5.92 and 5.68 weeks) and activation energy (−7618 and −6104 cal/mol·K) and the lowest values for the degradation constant (0.04 and 0.02 week−1), both processes carried out by a first-order kinetics.
Se aplicó la técnica de microencapsulación por inclusión molecular utilizando β-ciclodextrina para disminuir la degradación de carotenoides y capsaicina, presentes en la oleorresina de chile habanero. El complejo de inclusión molecular se preparó en las proporciones 20:80 y 30:70 de oleorresina:β-ciclodextrina, respectivamente, y fueron almacenadas por 5 semanas en un rango de aw=0,103-0,765, a 25, 35 y 45 °C, determinando semanalmente sus contenidos de carotenoides totales (UV-Vis) y capsaicina (HPLC). Los resultados mostraron que el complejo de inclusión molecular en la proporción 30:70 almacenado a 25 °C, tuvo una retención mayor de carotenoides totales y capsaicina a una aw de 0,536 y 0,765 respectivamente, presentando los valores más altos de vida media (5,92 y 5,68 sem), de energía de activación (−7618 y −6104 cal/mol·K), así como los valores más bajos para la constante de degradación (0,04 y 0,02 sem−1), llevándose a cabo ambos procesos mediante una cinética de primer orden.
Introducción
La oleorresina de chile habanero tiene gran demanda en el mercado debido a sus atributos funcionales y sensoriales, especialmente la pungencia, de ahí que la industria alimentaria es su mayor consumidor. Se emplea como agente colorante y saborizante en una amplia cantidad de productos alimenticios procesados que incluyen carnes, sopas, botanas, condimentos, dulces e incluso bebidas alcohólicas (Fernández-Trujillo, Citation2007; Pino et al., Citation2007; Restrepo, Citation2007; Singh et al., Citation2009).
El chile habanero (Capsicum chinense), al igual que todos los chiles (Capsicum spp.), se cultivan también como una fuente de nutrientes como carbohidratos, azúcares, calcio, magnesio, β-caroteno, ácido ascórbico, tocoferoles, las vitaminas A, C y E, y numerosos compuestos bioactivos no nutritivos como carotenoides y capsaicinoides, los cuales presentan actividad antioxidante importante (Antonious, Kochhar, Jarret, & Snyder, Citation2006; Singh et al., Citation2009; Topuz & Ozdemir, Citation2007).
La fuerte pungencia y sabor especiado de los chiles picantes, se atribuyen a una familia de sustancias llamadas capsaicinoides cuyos dos componentes mayoritarios son la capsaicina y la dihidrocapsaicina. Estos componentes se encuentran presentes únicamente en los frutos del género Capsicum, variando su concentración de una variedad a otra (Kadian & Garg, Citation2012). Comercialmente, la capsaicina natural está disponible en forma líquida como oleorresina de Capsicum, que es un concentrado oleoso que contiene antioxidantes naturales de las especias más picantes, que desafortunadamente posee algunos problemas en su manejo y uso debido a la irritación causada por su pungencia (Shrivastava & Saxena, Citation2011) así como a su sensibilidad a la luz, el oxígeno atmosférico y las condiciones de almacenamiento, factores que promueven una corta vida de anaquel si no se almacena correctamente (Kanakdande, Bhosale, & Singhal, Citation2007; Meunier, Cardot, Manzanilla, Wysshaar, & Alric, Citation2007; Singh et al., Citation2009).
La microencapsulación convierte las oleorresinas en polvos de libre movimiento que pueden ser fácil y homogéneamente mezclados con el alimento, controlando el comportamiento biofarmacéutico del aditivo en el tracto gastrointestinal y liberando el compuesto activo en un sitio específico de acción, lo que mejoraría su eficiencia (Kanakdande et al., Citation2007; Zaibunnisa, Norashikin, Mamot, & Osman, Citation2009). La microencapsulación se lleva a cabo mediante secado por aspersión, aspersión por enfriamiento o congelamiento, liofilización, recubrimiento en lecho fluidizado, extrusión, coaservación, co-cristalización e inclusión molecular. Todos ellos, excepto el último, son macroprocesos, resultando en partículas con diámetro en el rango de 3–800 μ (Astray, Gonzalez-Barreiro, Mejuto, Rial-Otero, & Simal-Gándara, Citation2009; Cho & Park, Citation2009; Karathanos, Mourtzinos, Yannakopoulous, & Andrikopoulos, Citation2007; Reineccius, Reineccius, & Peppard, Citation2002).
La formación de complejos de inclusión ocurre a nivel molecular, donde moléculas individuales de alimento o ingrediente de sabor son atrapadas parcial o totalmente, siendo incluidas dentro de las cavidades hidrofóbicas de las moléculas individuales del material de pared. Los materiales de pared más empleados son las ciclodextrinas que son oligómeros cíclicos de glucosa no tóxicos, formados por 6, 7 u 8 unidades de glucosa, llamados respectivamente α, β y γ-ciclodextrinas, que han sido recomendadas para aplicarse en el procesamiento de alimentos como aditivos alimentarios con una variedad de objetivos: a) proteger los componentes lipofílicos de alimentos que son sensibles a la degradación inducida por el oxígeno, la luz ó el calor; b) solubilizar colorantes alimenticios y vitaminas; c) estabilizar fragancias, sabores, vitaminas y aceites esenciales contra cambios indeseables; d) eliminar olores y sabores indeseables; e) lograr una liberación controlada de ciertos componentes de los alimentos y f) mejorar la solubilidad acuosa de componentes orgánicos por la formación de complejos de inclusión entre las moléculas de la ciclodextrina hospedera y las moléculas huésped (Astray et al., Citation2009; Cho & Park, Citation2009; Martin del Valle, Citation2004).
La β-ciclodextrina se conoce por ser la ciclodextrina más común y adecuada para microencapsulación; es la más accesible y de menor precio, que provee protección efectiva para cada componente individual de sabor presente en un sistema alimenticio multicomponente (Ayala-Zavala et al., Citation2008; Bhandari, D'Arcy, & Thi-Bich, Citation1998; Challa, Ahuja, Ali, & Khar, Citation2005).
Sin embargo, existe muy poca información sobre la estabilidad de complejos de inclusion molecular de β-ciclodextrina con oleorresinas, y no existe evidencia del uso de oleorresina de chile habanero.
El propósito del presente estudio fue evaluar la estabilidad de los carotenoides y la capsaicina presentes en un producto microencapsulado de oleorresina de chile habanero (Capsicum chinense) por inclusión molecular en β-ciclodextrina, mediante la observación de sus propiedades físicas y fisicoquímicas y el cálculo de las constantes de degradación, vida media y energía de activación durante el almacenamiento a diferentes condiciones de temperatura y aw.
Materiales y métodos
Reactivos
Se utilizó oleorresina de chile habanero (OCH), AMCO de México, S.A., β-ciclodextrina (βCD), Sigma-Aldrich (St. Louis, MO. USA), acetona grado HPLC, y etanol grado reactivo, J.T. Baker (Center Valley, PA. USA).
Microencapsulación de oleorresina de chile habanero
Se utilizó un método de precipitación para preparar el complejo de inclusión OCH-βCD (Domínguez-Cañedo & Beristain-Guevara, Citation2011). 50 ± 0,01 g de βCD se disolvieron en 500 mL de una mezcla de etanol y agua (1:2) que se mantuvo a 55 ± 2 °C y en agitación continua a 150 rev/min aproximadamente, en una parrilla con agitador magnético (Scorpion Scientific Mod. A-50,022). Se prepararon dos proporciones de OCH-βCD por separado, 20:80 y 30:70 (p:p), disolviendo 12,50 y 21,43 ± 0,1 g respectivamente, de OCH en acetona, para ser agregada lentamente a cada solución de βCD, manteniendo la agitación y la temperatura a 55 ± 2 °C. Terminada la incorporación de la OCH a la βCD se suspendió la aplicación de calor, se cubrieron las mezclas y se mantuvieron en agitación por 4 h más. Las soluciones finales se refrigeraron por 8–12 h a 4 °C. Los precipitados formados del complejo de inclusión molecular OCH-βCD se recuperaron mediante filtración y se secaron en un horno de convección con vacío (ShelLab Inc.) de 15 pulg Hg, a 50° C, por 24 h. Los complejos de inclusión OCH-βCD formados, se pesaron y colocaron en recipientes herméticos color ámbar, con ambiente de nitrógeno y se almacenaron a 4° C. La cantidad de polvo recuperado se calculó restándole el contenido de humedad. Cada preparación fue realizada y analizada por triplicado.
Humedad en base seca
Se pesó 1 ± 0.01 g del complejo de inclusión y se colocó en un desecador, en ambiente de pentóxido de fósforo (P2O5) de J.T. Baker (Center Valley, PA. USA), hasta alcanzar el peso de equilibrio.
Aceite superficial
Se determinó de acuerdo la técnica de Sankarikutty, Sreekumar, Narayanan, and Mathew (Citation1988). Se colocaron 2 ± 0.05 g del complejo de inclusión y 20 mL de éter de petróleo en un frasco ámbar y se agitó manualmente durante 5 minutos. Se filtró la solución con papel filtro realizando un lavado al residuo de la filtración, utilizando 10 mL más de acetona. Se colectó el disolvente y se llevó a la estufa de convección (ShelLab Inc.) a 70 °C secando por 24 h y/o hasta alcanzar el peso constante.
Aceite total
Se determinó por el método Soxhlet. (A.O.A.C., Citation1990) Se colocaron 2 ± 0.05 g del complejo de inclusión en papel filtro bien sellado llevándose a cabo la extracción con n-hexano, J.T. Baker (Center Valley, PA. USA) durante 4 horas, mediante goteo constante de aproximadamente 10 gotas/min. Al término de este tiempo se colectó todo el disolvente y se eliminó el exceso del mismo utilizando un rotavapor (Heidolph, modelo LABOROTA 4001- efficient). Se procedió a llevar la muestra a sequedad en una estufa de vacío (ShelLab Inc.) por 24 h. La diferencia de pesos se reportó como g aceite total/g de encapsulado.
Eficiencia de encapsulación
Se empleó la relación de Pauletti and Amestoy (Citation1999), para calcular la proporción de aceite que esta menos expuesta a las condiciones ambientales que afectarían su calidad.
Rendimiento de encapsulación
Se evaluó como la relación entre la cantidad de oleorresina presente en el complejo de inclusión respecto a la adicionada inicialmente (Vernon-Carter, Pedroza Islas, & Beristain Citation1998).
Vida de anaquel del complejo de inclusión OCH-βCD
El complejo de inclusión preparado bajo cada una de las proporciones propuestas, fue sometido a almacenamiento para determinar su vida útil, monitoreando semanalmente sus propiedades físicas y químicas. Se emplearon frascos de vidrio con cierre hermético, en los que se colocaron muestras individuales de 0,5–0,7 g en charolas pequeñas de aluminio, que fueron retiradas semanalmente para su análisis. Cada desecador contenía soluciones saturadas de sales estabilizadoras de humedad para los valores de aw de 0, 103 a 0,765 de acuerdo con los valores reportados (Labuza, Kaanane, & Chen, Citation2006; Rockland & Beuchat, 1986). Se prepararon tres series de cuatro desecadores cada una, las cuales se sometieron a las temperaturas constantes de 25, 35 y 45 °C respectivamente, empleando estufas incubadoras.
Extracción del pigmento
Todas las muestras se obtuvieron de acuerdo a Domínguez-Cañedo and Beristain Guevara (Citation2011). Se extrajeron 0,5 ± 0.05 g del complejo OCH-βCD por medio de ultrasonido en 25 mL de acetona por 20 min. El extracto fue filtrado y aforado a un volumen final de 50 mL.
Determinación de carotenoides totales
Se determinaron espectrofotométricamente las fracciones isocromáticas roja y amarilla, así como los carotenoides totales, mediante el método propuesto por Hornero-Méndez and Mínguez-Mosquera (Citation2001), utilizando un espectrofotómetro con arreglo de diodos UV-VIS, (Agilent, modelo 8453). Los datos obtenidos se introdujeron en las fórmulas desarrolladas con base en la Ley de Lambert y Beer para concentraciones conocidas de estándares de ambas fracciones carotenoidales:
Donde CT es el valor de carotenoides totales, CR y CA son las fracciones carotenoidales roja y amarilla, respectivamente (todas en μg/ml); A508 y A472 son las absorbancias del extracto del complejo a cada una de las longitudes de onda indicadas. Los valores 2144, 0,403, 3,270, 9,1724, 3 y 2450,1 son constantes de las fórmulas desarrolladas por Hornero-Méndez y Mínguez-Mosquera.
Determinación del contenido de capsaicina
Se utilizó la técnica de Perucka and Oleszek (Citation2000), con algunas modificaciones. Se elaboró una curva estándar con capsaicina pura (Sigma Aldrich, Inc.) y acetona HPLC como disolvente. Se preparó una solución de 1000 μg, para después tomar de ésta alícuotas de 50, 40, 30, 20 y 10 μg. Las muestras tanto de la solución estándar como las obtenidas del método de inclusión OHC-βCD se clarificaron, filtraron e inyectaron en un equipo de Cromatografía Líquida de Alta Resolución (HPLC) marca Varian, compuesto de una bomba trifásica (modelo 9012) y un detector UV/VIS (modelo 9050), utilizando como fase móvil metanol:agua 73:27 (V:V) grado HPLC. La velocidad de flujo fue de 0,5 mL/min y una presión de 90 atm. Se utilizó una columna C18 de fase reversa (Thermo Scientific) de 250x4,6 mm y un tamaño de poro de 5 μm (Hypersil). El detector UV-VIS se utilizó a una longitud de onda de 280 nm, y el volumen de inyección fue de 20 μL.
Estimación de la velocidad de degradación
Se calculó como porcentaje de retención. Se buscó el ajuste matemático para calcular la constante de degradación de carotenoides (k) a un determinado valor de aw, lo cual permitió determinar la estabilidad de la oleorresina encapsulada en βCD en los diferentes tratamientos. El análisis matemático se realizó con la ecuación desarrollada por Brown, Le May, Bursten, and Burdge (Citation2004):
donde A es la concentración del reactivo de interés al tiempo t; A0 es la concentración inicial del reactivo A; k1 es la constante de velocidad de degradación de primer orden. Se calculó también el tiempo de vida media o vida de anaquel (θ) de los carotenoides y la capsaicina de la OCH encapsulado en βCD a cada una de las proporciones almacenados a las diferentes condiciones de aw seleccionadas. Si A corresponde al valor de la calidad al final de la vida útil del alimento, entonces la vida de anaquel (θ) del alimento es inversamente proporcional a la constante de velocidad de degradación, de acuerdo con Bin y Labuza (Citation1977):
La tasa de pérdida de calidad dependió principalmente de la temperatura, así que la ecuación de Arrhenius se utilizó atinadamente para describir la dependencia de la temperatura de la tasa de deterioro, ya sea para orden cero o primer orden:
donde k0 es un factor pre-exponencial; Ea es la energía de activación (cal/mol); R es la constante de los gases (1,986 cal/mol·K); T es la temperatura absoluta (K). Al graficar el logaritmo de la constante de degradación como una función del inverso de la temperatura absoluta, se obtuvo una línea recta, donde la energía de activación estuvo determinada por la pendiente de la recta dividida por la constante de los gases. Midiendo la constante de degradación a dos o tres temperaturas, pudo extrapolarse sobre la gráfica de Arrhenuis con una línea recta para predecir la constante de degradación a una determinada temperatura de almacenamiento.
Diseño experimental
Se utilizó un diseño completamente al azar con dos tratamientos (proporciones de preparación). La unidad experimental fue el microencapsulado con tres repeticiones. Las variables de respuesta fueron el porcentaje de retención de carotenoides y de capsaicina, durante el tiempo de almacenamiento a cuatro diferentes valores de aw (0,103–0,765) y tres temperaturas (25, 35 y 45 °C).
Análisis de datos
Los resultados obtenidos de las diferentes pruebas durante el tiempo de almacenamiento a los cuatro valores de aw y tres temperaturas, fueron analizados mediante un ANOVA de una vía. La comparación de medias se llevó a cabo con la prueba de Tukey, con un nivel de significancia del 5% (α = 0,05).
Resultados y discusión
Inclusión molecular
El complejo de inclusión molecular de oleorresina de chile habanero pudo ser elaborado exitosamente de acuerdo al método de precipitación usando βCD. En la se puede observar que el peso del complejo recuperado fue menor que el de las cantidades originalmente utilizadas, tanto para la proporción 20:80 como para 30:70 de OCH a βCD, pero no se presentaron diferencias significativas entre sus valores tanto de eficiencia como de rendimiento, por lo cual podría suponerse que el máximo nivel de formación del complejo de inclusión se ha alcanzado, de acuerdo con el criterio de Bhandari et al. (Citation1998).
Tabla 1. Propiedades físicas y fisicoquímicas del complejo de inclusión molecular Oleorresina de chile habanero-β ciclodextrina (OCH–βCD).
Table 1. Physical and physicochemical properties of the OCH–βCD molecular inclusion complex.
Degradación de carotenoides
En la se muestran los resultados de la cinética de degradación de los carotenoides. Se observó que la reacción de degradación de los carotenoides y la capsaicina presentes en la OCH encapsulada en βCD, siguió mayoritariamente una cinética de primer orden por sobre el orden cero, para las dos proporciones de preparación, tres temperaturas de almacenamiento y cuatro valores de aw utilizados, dado que los valores de r2 presentaron mayoritariamente la mejor correlación a este tipo de cinética, coincidiendo esto con las investigaciones de Zaibunnisa et al. (Citation2009), quienes estudiaron la estabilidad durante el almacenamiento de la curcumina en el complejo de inclusión de βCD y oleorresina de cúrcuma rizoma (Curcuma domestica), y encontraron también una reacción de primer orden para la cinética de degradación de la curcumina en el complejo de inclusión.
Tabla 2. Parámetros cinéticos del complejo de inclusión OCH-βCD obtenidos del ajuste del porcentaje de retención de carotenoides a un modelo cinético de primer orden.
Table 2. Kinetic parameters of the OCH–βCD inclusión complex obtained from the adjustement of the caroteoids retaining percentage to a first-order kinetic model.
Experimentalmente se observó que la disminución del contenido de carotenoides de la OCH microencapsulada en βCD se llevó a cabo mostrando un comportamiento exponencial donde se da inicialmente un descenso rápido de 1–2 semanas para posteriormente mostrar un comportamiento asintótico de degradación más lenta a tiempos mayores, reportado anteriormente por Domínguez-Cañedo and Beristain-Guevara (Citation2011) y que coincide con el criterio de von Elbe (Citation1987), quien encontró que cuando la concentración de oxígeno no es limitante, como en el caso de éste estudio, los carotenoides siguen una reacción de degradación de primer orden, como lo han reportado Desobry, Netto and Labuza (Citation1997, Citation1999), Rodríduez-Huezo, Pedroza-Islas, Prado-Barragán, Beristain, and Vernon-Carter (Citation2006), y Wagner and Warthesen (Citation1995). . Este comportamiento también coincide con lo reportado por Oliveira, Carvalho, Nuttí, Carvalho, and Fukuda (Citation2010), para la degradación total de carotenoides en muestras de harina de yuca, así como por Moreno-Álvarez, Belén, and Torres (Citation2003), quienes estudiaron la degradación de carotenoides liofilizados extraídos del pericarpio de la Carica papaya L., los cuales siguieron también cinéticas de degradación de primer orden.
En general los valores de la constante de degradación de carotenoides de la OCH en βCD para la proporción 20:80 (), fueron mayores que los de la proporción 30:70 a cualquier aw y temperatura, lo que indicó que los carotenoides en esta última proporción presentaron una mayor retención a los mismos valores de aw. Se observó que a valores menores de aw la constante de degradación de carotenoides también disminuyó, sin apreciarse un efecto directo de la temperatura, a excepción de la muestra del complejo en la proporción 20:80 almacenada a aw = 0,115 y 25 °C, que presentó el valor más alto de k1 (0,7730 min−1), siendo la aw determinante en la velocidad de degradación, debido a que un escaso número de moléculas de agua rodeó al complejo de inclusión OCH en βCD, propiciando una mayor permeabilidad al oxígeno y en consecuencia la degradación de los carotenoides de la OCH. Además de que al haber una temperatura menor y una cantidad mínima de agua presente, ésta no podría actuar como medio reaccionante y por tanto no tenría efecto en la estabilidad, lo cual coincide con lo expuesto por Beristain, Garcı́a, and Vernon-Carter (Citation2001) y Carrillo-Navas, Cruz-Olivares, Barrera-Pichardo, and Pérez-Alonso (Citation2012).
Los valores de vida de anaquel (θ) de los carotenoides de la OCH presente en el complejo de inclusión, estuvieron relacionados con las constantes de degradación obtenidas, encontrándose los valores mayores para las muestras almacenadas a 25 °C en la proporción 30:70, siendo 5,56, 5,92 y 5,58 semanas a las aw de 0,329, 0,536 y 0,765, respectivamente, las cuales no tuvieron diferencias significativas entre el primer y tercer valor de aw (α > 0.05). También éstas muestras presentaron los valores menores de la constante de degradación de carotenoides, sin observar diferencias significativas entre ellos (α > 0.05). A este respecto, Zaibunnisa et al. (Citation2009), encontraron que las constantes de degradación de la curcumina de la oleorresina de cúrcuma microencapsulada en βCD, tienen correlación con las condiciones de almacenamiento presentando menores valores en las muestras resguardadas de la luz, mismas que presentan los mayores valores de vida de anaquel.
De acuerdo a los resultados obtenidos para las constantes de velocidad de degradación y vida de anaquel, podría decirse que la proporción 30:70 en el complejo de inclusión molecular OCH–βCD, sería más eficiente que el de 20:80 en función de la teoría de Bhandari et al. (Citation1998), que dice que a mayor cantidad de material a encapsular, en este caso la OCH en βCD, se obtiene un mejor proceso de inclusión que se ve reflejado en una mayor eficiencia en el desempeño del complejo, con respecto a la degradación de los carotenoides.
En cuanto a la energía de activación se observó que el complejo de inclusión molecular OCH-βCD en la proporción 30:70, presentó mejores valores (−5738,18 a −7618,71 cal/mol·K), que en la proporción 20:80 (−2590,80 a −6525,67 cal/mol·K). Estos resultados podrían explicar que la estructura originada con una proporción mayor de OCH en el complejo de inclusión con βCD, retardó más la difusión del oxígeno hacia el interior de la microestructura, logrando una mejor estabilidad contra la oxidación de los carotenoides, fenómeno observado por Beristain, Azuara, and Vernon-Carter (Citation2002) cuando encapsularon aceite esencial de naranja con goma de mezquite, así como Carrillo-Navas et al. (Citation2012), quienes microencapsularon un saborizante de nuez en una matriz de goma arábiga, goma de mezquite y maltodextrina. Por lo que podría suponerse que el complejo de inclusión en la proporción 30:70 de OCH-βCD fue más estable cuando se almacenó a 25 °C con un aw = 0, 536, debido a que la energía de activación obtenida fue alta (Ea = − 7618,71 cal/mol·K), por tanto la oxidación de los carotenoides podría haber estado relacionada con el contenido de humedad y la aw de la βCD, independientemente del efecto de la temperatura de almacenamiento.
Degradación de capsaicina
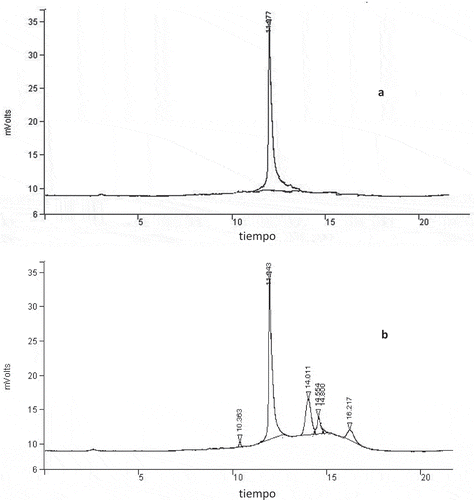
En la muestra la identificación de la señal emitida por el estándar de capsaicina por High Performance Liquid Cromatography (HPLC), así como en una muestra representativa de lo obtenido durante este estudio. Como se aprecia, en ambos casos el tiempo de retención fue cercano a los 11.4 min, las diferencias fueron prácticamente de centésimas por lo que no se consideraron significativas.
Figura 1. Detección de Capsaicina por HPLC: (a) estándar de capsaicina y (b) muestra representativa de la oleorresina extraída del complejo de inclusión molecular.
Figure 1. Capsaicin detection by HPLC: (a) standard of capsaicin and (b) representative sample of extracted oleoresin molecular inclusion complex.
En la se muestran los resultados de la evaluación de la cinética de degradación de la capsaicina, el cual se ajustó a un modelo de primer orden. Los valores menores de la constante de degradación de capsaicina, que denota un mejor proceso de retención, se presentaron en las muestras almacenadas a 25 °C en ambas proporciones, como podemos observar todos fueron significativamente diferentes (α < 0.05). No se observó efecto de la aw de almacenamiento, lo cual indicaría que la degradación de la capsaicina no fue dependiente de la cantidad de oxígeno presente en el almacenamiento. A 35 °C se presentaron los valores menores del coeficiente de degradación, en las muestras de la proporción 30:70 a un aw = 0,515 y 0,743, siendo los valores de vida de anaquel en el complejo de inclusión OCH-βCD, 5,89 y 5,68 semanas, respectivamente. A 45 °C se presentaron las constantes más altas de velocidad de degradación de la capsaicina, siendo más notorio en la proporción 20:80, obteniendo pérdidas mayores al 50 % del contenido inicial al finalizar las 5 semanas de almacenamiento, coincidiendo esto con Zaibunnisa et al. (Citation2009), quienes encontraron que las constantes de degradación de la curcumina de la oleorresina de cúrcuma microencapsulada en βCD, tienen correlación directa con las temperatura de almacenamiento, observando los menores valores a 5° y los mayores valores a 45 °C.
Tabla 3. Parámetros cinéticos del complejo de inclusión OCH-βCD obtenidos del ajuste del porcentaje de retención de capsaicina a un modelo cinético de primer orden.
Table 3. Kinetic parameters of the OCH–βCD inclusión complex obtained from the adjustement of the capsaicin-retaining percentage to a first-order kinetic model.
En cuanto a la energía de activación se puede observar que el complejo de inclusión molecular OCH-βCD de la proporción 30:70, presentó los valores más altos (−1429,84 a −6104,73 cal/mol·K), en comparación con la proporción 20:80 (−113.8 a −4673,87 cal/mol·K), lo cual podría sugerir que la proporción 30:70, almacenada a 25 °C y aw = 0,765 presentó menor degradación de capsaicina, debido a que tuvo el menor valor de la constante (k1 = 0,0227 min−1) de todo el proceso y una vida de anaquel de 6,47 semanas, esto podría suponer que el deterioro de la capsaicina no fue oxidativo, ya que no dependió de la cantidad de humedad y de la aw. Por otro lado, los valores de las constantes de degradación aumentaron conforme la temperatura de almacenamiento se incrementó, por lo que se podría sugerir un proceso dependiente de la temperatura. Esto coincide con el mecanismo de deterioro térmico de capsaicina propuesto por Henderson and Henderson (Citation1992), quienes atribuyeron la degradación de la capsaicina al efecto de la temperatura, debido a la fragmentación de los grupos alquilo de la capsaicina, oxidándose la molécula para dar lugar primero a vainillina, y posteriormente dar origen a un segundo rompimiento de ésta última en otros fenoles, para formarse finalmente la alquilamida.
Conclusiones
El complejo de inclusión molecular de oleorresina de chile habanero se pudo elaborar de acuerdo al método de precipitación utilizando βCD. Se encontró que las mejores condiciones para la mayor retención de los carotenoides presentes en el complejo fueron para la proporción 30:70, con un aw = 0,536 de acuerdo al valor de energía de activación y de vida media obtenidos, lo que podría demostrar que la oxidación de los carotenoides fue dependiente del contenido de humedad y de la aw de la βCD, independientemente de la temperatura de almacenamiento. En cuanto a la capsaicina, la retención mayor también se encontró en la proporción 30:70, sin embargo, las mejores condiciones se dieron a una aw = 0,765, de acuerdo a los valores de energía de activación y vida media, por lo que podría sugerirse a la proporción 30:70 como la más adecuada para la encapsulación de oleorresina de chile habanero por el método de inclusión molecular.
Agradecimientos
Los autores agradecen al Laboratorio de Cromatografía y Biología Molecular del Instituto de Ciencias Básicas y al Sistema de Apoyo en Resolución Analítica (SARA), ambos pertenecientes a la Universidad Veracruzana, por las facilidades otorgadas.
References
- Antonious, G. F., Kochhar, T. S., Jarret, R. L., & Snyder, J. C. (2006). Antioxidants in hot pepper: Variation among accessions. Journal of Environmental Science and Health, Part B: Pesticides, Food Contaminants, and Agricultural Wastes, 41, 1237–1243. doi:10.1080/03601230600857114
- A.O.A.C. (1990). Official methods of analysis (15th ed.). Método 920.39. Determinación de grasas. U.S.A: Association of Analytical Chemists.
- Astray, G., Gonzalez-Barreiro, C., Mejuto, J. C., Rial-Otero, R., & Simal-Gándara, J. (2009). A review on the use of cyclodextrins in foods. Food Hydrocolloids, 23, 1631–1640. doi:10.1016/j.foodhyd.2009.01.001
- Ayala-Zavala, J. F., Soto-Valdez, H., González-León, A., Álvarez-Parrilla, E., Martín-Belloso, O., & González-Aguilar, G. A. (2008). Microencapsulation of cinnamon leaf (Cinnamomum zeylanicum) and garlic (Allium sativum) oils in β-cyclodextrin. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 60(3–4), 359–368. doi:10.1007/s10847-007-9385-1
- Beristain, C. I., Azuara, E., & Vernon-Carter, E. J. (2002). Effect of water activity on the stability to oxidation of spray-dried encapsulated orange peel oil using mesquite gum (Prosopis juliflora) as wall material. Journal of Food Science, 67, 206–211. doi:10.1111/j.1365-2621.2002.tb11385.x
- Beristain, C. I., Garcı́a, H. S., & Vernon-Carter, E. J. (2001). Spray-dried encapsulation of cardamom (Elettaria cardamomum) essential oil with mesquite (Prosopis juliflora) gum. LWT – Food Science and Technology, 34(6), 398–401. doi:10.1006/fstl.2001.0779
- Bhandari, B. R., D’Arcy, B. R., & Thi-Bich, L. L. (1998). Lemon oil to β-cyclodextrin ratio effect on the inclusion efficiency of β-cyclodextrin and the retention of oil volatiles in the complex. Journal of Agricultural and Food Chemistry, 46, 1494–1499. doi:10.1021/jf970605n
- Bin, F., & Labuza, T. P. (1977). Shelf life testing: Procedures and prediction methods for frozen foods. Disponible en http://link.springer.com/chapter/10.1007%2F978-1-4615-5975-7_19. Consulta: Enero, 2013
- Brown, T. L., Le May, H. E., Bursten, B. E., & Burdge, J. (2004). Cinética Química (9a Edición). Prentice Hall: Química: La Ciencia Central. Cap. 14.
- Carrillo-Navas, H., Cruz-Olivares, J., Barrera-Pichardo, J. F., & Pérez-Alonso, C. (2012). Estabilidad térmica oxidativa de microcápsulas de saborizante de nuez. Superficies Y Vacío, 23(S), 21–26.
- Challa, R., Ahuja, A., Ali, J., & Khar, R. K. (2005). Cyclodextrins in drug delivery: An updated review. American Association of Pharmaceutical Scientists Journal, 6(2), Article 43.
- Cho, Y. H., & Park, J. (2009). Encapsulation of flavor by molecular inclusion using β-cyclodextrin: Comparison with spray-drying process using carbohydrate-based wall materials. Food Science and Biotechnology, 18(1), 185–189.
- Desobry, S. A., Netto, F. M., & Labuza, T. P. (1997). Comparison of spray-drying, drum-drying and freeze-drying for β-carotene encapsulation and preservation. Journal of Food Science, 62, 1158–1162. doi:10.1111/j.1365-2621.1997.tb12235.x
- Desobry, S. A., Netto, F. M., & Labuza, T. P. (1999). Influence of maltodextrin systems at an equivalent 25DE on encapsulated β-carotene loss during storage. Journal of Food Processing Preservation, 23, 39–55. doi:10.1111/j.1745-4549.1999.tb00368.x
- Domínguez-Cañedo, I. L., & Beristain-Guevara, C. I. (2011). Microencapsulation of habanero chili (Capsicum chinense) oleoresin in β-cyclodextrin and antioxidant activity during storage. Memorias del Congreso Internacional “III European Drying Conference - EuroDrying 2011”, Palma de Mallorca, España, 26–28 October ISBN 978-84-694-7298-9.
- Fernández-Trujillo, P. (2007). Review: extracción convencional de oleorresina de pimentón dulce y picante. I. generalidades, composición, proceso e innovaciones y aplicaciones. Grasas Y Aceites, 58(3), 252–263.
- Henderson, D. E., & Henderson, S. H. (1992). Thermal decomposition of capsaicin. 1. Interactions with oleic acid at high temperatures. Journal of Agricultural and Food Chemistry, 40, 2263–2268. doi:10.1021/jf00023a042
- Hornero-Méndez, D., & Mínguez-Mosquera, M. I. (2001). Rapid spectrophotometric determination of red and yellow isochromic carotenoid fractions in paprika and red pepper oleoresins. Journal of Agricultural and Food Chemistry, 49, 3584–3588. doi:10.1021/jf010400l
- Kadian, S. S., & Garg, M. (2012). Pharmacological effects of carotenoids: A review. International Journal of Pharmaceutical Sciences and Research, 3(1), 42–48.
- Kanakdande, D., Bhosale, R., & Singhal, R. S. (2007). Stability of cumin oleoresin microencapsulated in different combination of gum arabic, maltodextrin and modified starch. Carbohydrate Polymers, 67, 536–541. doi:10.1016/j.carbpol.2006.06.023
- Karathanos, V. T., Mourtzinos, I., Yannakopoulous, K., & Andrikopoulos, N. K. (2007). Study of the solubility, antioxidant activity and structure of inclusion complex of vanillin with β-cyclodextrine. Food Chemistry, 101, 652–658. doi:10.1016/j.foodchem.2006.01.053
- Labuza, T. P., Kaanane, A., & Chen, Y. (2006). Effect of temperature on the moisture sorption isotherms and water activity shift of two dehydrated foods. Journal of Food Science, 50, 385–392. doi:10.1111/j.1365-2621.1985.tb13409.x
- Martin del Valle, E. M. (2004). Cyclodextrins and their uses: A review. Process Biochemistry, 39, 1033–1046. doi:10.1016/S0032-9592(03)00258-9
- Meunier, J. P., Cardot, J. M., Manzanilla, E. G., Wysshaar, M., & Alric, M. (2007). Use of spray-cooling technology for development of microencapsulated capsicum oleoresin for the growing pig as an alternative to in-feed antibiotics: A study of release using in vitro models. Journal of Animal Science, 85, 2699–2710. doi:10.2527/jas.2007-0027
- Moreno-Álvarez, M. J., Belén, D., & Torres, V. (2003). Degradación cinética de carotenoides obtenidos de frutos de Carica papaya L. Revista De La Facultad De Agronomía, Caracas, Venezuela, 20(2), 232–237.
- Oliveira, A. R. G., Carvalho, L. M. J., Nuttí, M. R., Carvalho, J. L. V., & Fukuda, W. G. (2010). Assessment and degradation study of total carotenoid and β-carotene in bitter yellow cassava (Manihot esculenta Crantz) varieties. African Journal of Food Science, 4(4), 148–155.
- Pauletti, M. S., & Amestoy, P. (1999). Butter microencapsulation as affected by composition of wall material and fat. Journal of Food Science, 64(2), 279–282. doi:10.1111/j.1365-2621.1999.tb15882.x
- Perucka, I., & Oleszek, W. (2000). Extraction and determination of capsaicinoids in fruit of hot pepper Capsicum annuum L. by spectrophotometry and high-performance liquid chromatography. Food Chemistry, 71(2), 287–291. doi:10.1016/S0308-8146(00)00153-9
- Pino, J., González, M., Ceballos, L., Centurión-Yah, A. R., Trujillo-Aguirre, J., Latournerie-Moreno, L., & Sauri-Duch, E. (2007). Characterization of total capsaicinoids, colour and volatile compounds of habanero chilli pepper (Capsicum chinense Jack.) cultivars grown in Yucatan. Food Chemistry, 104, 1682–1686. doi:10.1016/j.foodchem.2006.12.067
- Reineccius, T. A., Reineccius, G. A., & Peppard, T. L. (2002). Encapsulation of flavors using cyclodextrins: Comparison of flavor retention in alpha, beta and gamma types. Journal of Food Science: Food Chemistry and Toxicology, 67(9), 3271–3279. doi:10.1111/j.1365-2621.2002.tb09577.x
- Restrepo, G. M. (2007). Oleorresinas de capsicum en la industria alimentaria. Revista Lasallista De Investigación, 3(2), 43–47.
- Rodríduez-Huezo, M. E., Pedroza-Islas, R., Prado-Barragán, L. A., Beristain, C. I., & Vernon-Carter, E. J. (2006). Microencapsulation by spray drying of multiple emulsions containing carotenoids. Journal of Food Science, 69(7), 351–359. doi:10.1111/j.1365-2621.2004.tb13641.x
- Sankarikutty, B., Sreekumar, M. M., Narayanan, C. S., & Mathew, A. G. (1988). Studies on microencapsulation of cardamom oil by spray drying technique. Journal of Food Science and Technology, 25, 325–355.
- Shrivastava, A., & Saxena, P. (2011). Stability indicating reverse phase high performance liquid chromatography method for the estimation of capsaicin. Pharmaceutical Methods, 2(2), 135–142. doi:10.4103/2229-4708.84451
- Singh, S., Jarret, R., Russo, V., Majetich, G., Shimkus, J., Bushway, R., & Perkins, B. (2009). Determination of capsinoids by HPLC-DAD in capsicum species. Journal of Agricultural Food Chemistry, 57(9), 3452–3457. doi:10.1021/jf8040287
- Spies W. E. L. & Wolf W. (1987). Critical Evaluation of Methods to Determine Moisture Sorption Isotherms. In Rockland, L. B., & Beuchat, L. R. (Eds.). Water activity: Theory and applications to food. (pp. 215–234). New York: Mercel Dekker.
- Topuz, A., & Ozdemir, F. (2007). Assessment of carotenoids, capsaicinoids and ascorbic acid composition of some selected pepper cultivars (Capsicum annuum L.) grown in Turkey. Journal of Food Composition and Analysis, 20, 596–602. doi:10.1016/j.jfca.2007.03.007
- Vernon-Carter E. J., Pedroza Islas R. & Beristain C. I. (1998). Stability of Capsicum anuum oleoresin in water emulsion containing Prosopis and acacia gums. Journal of Texture Studies, 29(5), 553–567.
- von Elbe, J. H. (1987). Influence of water activity on pigment stability in food products. In L. B. Rockland & L. R. Beuchat (Eds.), Water activity: Theory and applications to food, 1986, IFT Basic Symposium Series (pp. 55–73). New York: Marcel Dekker Inc.
- Wagner, L. A., & Warthesen, J. J. (1995). Stability of spray-dried encapsulated carrot carotenes. Journal of Food Science, 60(5), 1048–1053. doi:10.1111/j.1365-2621.1995.tb06290.x
- Zaibunnisa, A. H., Norashikin, S., Mamot, S., & Osman, H. (2009). Stability of curcumin in turmeric oleoresin-β-cyclodextrin inclusion complex during storage. The Malaysian Journal of Analytical Sciences, 13(2), 165–169.
