RESUMEN
Se evaluaron las propiedades tecnofuncionales y biológicas de harina, aislado proteico, albúminas y globulinas de semillas de Inga paterno, incluyendo solubilidad proteica, capacidad de absorción de agua y aceite, capacidad espumante y emulsionante, poder reductor de hierro (FRAP) y capacidad inhibitoria de la Enzima Convertidora de Angiotensina (ECA-I). Los resultados muestran que las globulinas presentan mayor solubilidad proteica, capacidad emulsionante y de absorción de aceite; mientras que las albúminas mejor capacidad de absorción de agua, mientras que el aislado proteico mostro mejor capacidad espumante. Estas propiedades fueron dependientes del pH. El FRAP fue de entre 3 y 30% de (0,1–0,3 mg proteína/mL) en todas las muestras, mientras que la actividad de inhibitoria de la ECA-I (0,3 mg proteína/mL) se presentó en harina y aislado proteico, existiendo diferencia estadísticamente significativa (p < 0,05) debido al tratamiento en ambos ensayos. La incorporación de proteínas de semillas de Inga paterno a formulaciones alimenticias podría mejorar sus propiedades tecnofuncionales y su actividad biológica.
ABSTRACT
Inga paterno seeds techno-functional and biological properties of flour, protein isolate, albumins and globulins were evaluated. Protein solubility, water and oil absorption capacity, foaming and emulsifying capacity and stability, FRAP and inhibitory capacity ACE-I were including. Globulins had the highest protein solubility, emulsifying capacity and fat absorption capacity; while albumins showed better water absorption capacity. Protein isolate had higher values at foaming capacity. Techno-functional properties were pH dependent. The tested samples showed values between 3 and 30% of FRAP (0.1–0.3 mg protein/mL). Furthermore, flour and protein isolate showed inhibitory activity of ACE-I (0.3 mg protein/mL). Incorporation of Inga paterno proteins seed to food formulations could improve its techno-functional properties and biological activity.
Introducción
Las leguminosas son especies vegetales nutricionalmente importantes debido a su capacidad de sintetizar y almacenar proteínas (Zia-Ul-Haq et al., Citation2007). Los concentrados, aislados y fracciones de proteínas vegetales han adquirido interés debido a las propiedades tecno-funcionales que presentan (formación de geles, espumas y emulsiones, absorción de agua y aceite), por lo que son ideales para adicionarse a matrices alimentarias como los productos de panificación, cárnicos, lácteos, bebidas y alimentos de nutrición especializada. Las fracciones proteicas más abundantes y analizadas en las leguminosas son albúminas y globulinas (Aguilar-Raymundo & Vélez-Ruiz, Citation2013).
Figura 1. Solubilidad de las proteínas de Harina desgrasada (HDI), Aislado proteico (API), Albúminas (AI) y Globulinas (GI) de Inga paterno. La gráfica representa la media de tres determinaciones independientes± DE. Letras diferentes indican diferencia significativa (p < 0,05).
Figure 1. Protein solubity of defatted flour (HDI), protein isolate (API), albumins (AI) and globulins (GI) from Inga paterno. Graph represents the mean of three independent determinations ± SD. Using different letters to show statistical significance (p < 0.05).
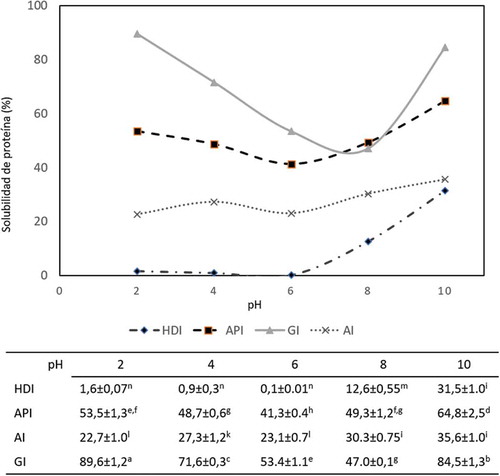
Figura 2. Capacidad emulsionante (a) y estabilidad de emulsión (b) de Harina desgrasada (HDI), Aislado proteico (API), Albúminas (AI) y Globulinas (GI) de Inga paterno. La gráfica representa la media de tres determinaciones independientes± DE. Letras diferentes indican diferencia significativa (p < 0,05).
Figure 2. Emulsion capacity (a) and emulsion stability (b) of defatted flour (HDI), protein isolate (API), albumins (AI) and globulins (GI) from Inga paterno. Graph represents the mean of three independent determinations ± SD. Using different letters to show statistical significance (p < 0.05).
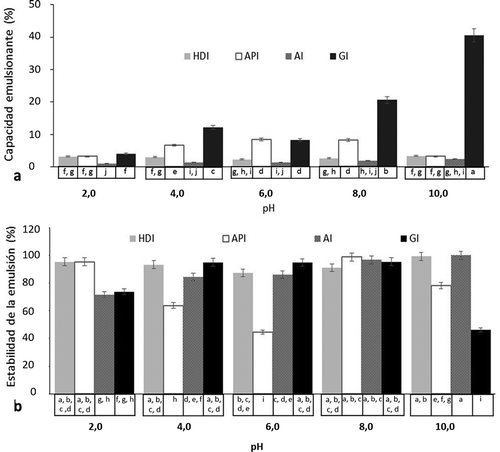
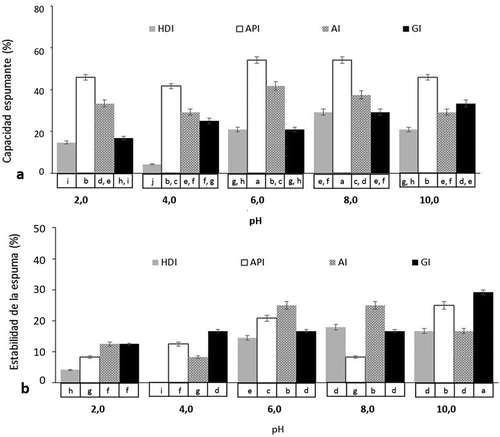
Figura 3. Capacidad espumante (a) y estabilidad de espuma (b) de Harina desgrasada (HDI), Aislado proteico (API), Albúminas (AI) y Globulinas (GI) de Inga paterno. La gráfica representa la media de tres determinaciones independientes± DE. Letras diferentes indican diferencia significativa (p < 0,05).
Figure 3. Foam capacity (a) and Foam stability (b) of defatted flour (HDI), protein isolate (API), albumins (AI) and globulins (GI) from Inga paterno. Graph represents the mean of three independent determinations ± SD. Using different letters to show statistical significance (p < 0.05).
Además, las propiedades biológicas que presentan las proteínas vegetales también son importantes, ya que el efecto preventivo en el desarrollo de diversas patologías, depende del tipo y secuencia de aminoácidos que las conformen, destacando la actividad inhibitoria de la ECA-I y las propiedades antioxidantes, como el FRAP (Herrera Chalé, Ruiz Ruiz, Acevedo Fernández, Betancur Ancona, & Segura Campos, Citation2014; Rutherfurd-Markwick & Moughan, Citation2005; Torruco-Uco et al., Citation2008). Las proteínas obtenidas de soya, cacahuate y colza han sido empleadas como ingredientes funcionales en alimentos; sin embargo, existen fuentes proteicas de buena calidad y accesibles cuyo uso no es común, tal es el caso del anacardo (Ogunwolu, Henshaw, Mock, Santros, & Awonorin, Citation2009), Asclepias spp. (Hojilla-Evangelista, Evangelista, & Victor, Citation2009) o de leguminosas no convencionales como Inga paterno.
Inga paterno pertenece al género Inga, la tribu Ingeae, subfamilia Mimosoideae, familia Fabaceae. Es un árbol que puede alcanzar hasta 10 m de altura. Sus flores producen después de ser polinizadas, vainas de 15 a 50 cm de largo con semillas de 2 a 3 cm de largo y rodeadas por un árilo blanco de sabor dulce (Navarrete-Tindall & Aragon, Citation2002) y cuyas semillas generalmente son desechadas (Ruiz-Carrera et al., Citation2004), por lo que pueden ser fuente promisoria de proteínas; sin embargo, se desconocen sus propiedades tecno-funcionales y bioactivas. El objetivo de este trabajo fue evaluar y caracterizar las proteínas de I. paterno (harina desgrasada, aislado proteico, albúminas y globulinas) para conocer su potencial como ingredientes tecno y biofuncionales.
Materiales y métodos
Obtención de harina
Las semillas de I. paterno fueron recolectadas en Tochimilco, Puebla, México. Por ser plantas de producción anual, se recolectaron alrededor de 30 kg de vaina que no presentaron daños por insecto o enfermedad, en los meses de Junio-Septiembre 2014 y 2015, de manera aleatoria y de la misma zona. Para el estudio, las semillas libres de arilo y limpias, se secaron a temperatura ambiente durante 96 h y se molieron para obtener harina (tamiz 45–350), misma que fue desgrasada con hexano (proporción 1:4 harina/hexano, p/v) por 24 h en frío. La mezcla se filtró y se dejó secar a temperatura ambiente durante 12 h.
Obtención de Las fracciones proteicas
Las fracciones proteicas se extrajeron a partir de la harina desgrasada usando el método de Osborne and Mendel (Citation1914) con algunas modificaciones. Las albúminas se extrajeron con agua desionizada (relación 1:10 p/v. pH 7) durante 1 h con agitación magnética y se centrifugó (Modelo Z323 K, Hermle, Alemania) a 9000 rpm/20 min, conservando el sobrenadante, repitiendo este proceso dos veces en el precipitado, juntando el sobrenadante obtenido (fracciones de albúminas). A partir del residuo, se extrajo de manera similar, la fracción de globulinas empleando como disolvente NaCl al 5,0% (p/v), pH 7. La sal se eliminó por diálisis a 4 °C utilizando una membrana de celulosa (6–8 kDa, Spectra/Por 132 660) durante 72 h con cambios de agua cada 24 h. Las fracciones se liofilizaron a su pH de extracción (Thermo Fisher Scientific, Alemania) y almacenaron en congelación (Thermoforma, Alemania) hasta su análisis.
Preparación del aislado proteico
El aislado proteico (API) fue preparado de acuerdo al método descrito por Rakashanda et al. (Citation2013), con algunas modificaciones. El API fue obtenido por precipitación con sulfato de amonio (90 % de saturación) y dializado en agua por 48 h con cambios de agua cada 24 h. La solución dializada fue liofilizada y almacenada en congelación hasta su análisis.
Contenido de proteína
La concentración de proteína de la harina desgrasada (HDI), el aislado proteico (API) y las fracciones albúminas (AI) y globulinas (GI) de las semillas de I. paterno fue determinada por Kjeldahl (método 954,01), empleando como factor de conversión de Nitrógeno, 6,25 (AOAC, Citation2000).
Solubilidad en agua
La solubilidad de las proteínas en agua se determinó de acuerdo a Rodríguez-Ambriz, Martínez-Ayala, Millán, and Dávila-Ortíz (Citation2005). Se ajustó el pH a 2, 4, 6, 8 y 10 con HCl 1.0 N y NaOH 1.0 N. La proteína en el sobrenadante se determinó utilizando el método de Bradford (Citation1976). La solubilidad de proteínas se calculó mediante la siguiente ecuación:
Propiedades emulsionantes
La capacidad emulsionante (CE) y la estabilidad de la emulsión (EE) se determinó según el método de Pedroche et al. (Citation2004) con modificaciones. La solución de proteínas se ajustó a pH 2, 4, 6, 8 y 10 con HCl 0,1 M y NaOH 0,1 M y se empleó aceite de soya (Golden Hills). CE y EE se determinaron mediante las ecuaciones siguientes:
Propiedades espumantes
La Capacidad espumante (FC) y la estabilidad de la espuma (FS) se midieron de acuerdo al método de Sze-Tao and Sathe (Citation2000) con modificaciones. Se ajustó el pH a 2, 4, 6, 8 y 10 con HCl 0,1 M y NaOH 0,1 M. Mediante las siguientes ecuaciones, FC se expresó como el aumento del volumen (%) debido a la agitación y FS se registró como el cambio en el volumen después de 30 min de almacenamiento.
Capacidad de absorción de aceite
La Capacidad de absorción de aceite (CAG) se determinó utilizando el método descrito por Lin and Zayas (Citation1987) modificado. Se pesó 1,0 g de muestra y se transfirió a un tubo de centrifuga de 15 mL previamente pesado, se agregaron 5 mL de aceite de soya y se emulsionó, manteniéndola por 30 min a temperatura ambiente durante 30 min, después se centrifugó a 5000 x g durante 20 min y se eliminó el sobrenadante. La CAG (g de aceite/g de muestra) se calculó con la siguiente ecuación:
Capacidad de absorción de agua
La Capacidad de absorción de agua (CAA) se determinó utilizando el método de Rodríguez-Ambriz et al. (Citation2005) modificado y se calculó mediante la ecuación:
Poder reductor de fe (III)
Se determinó el poder reductor de hierro (FRAP, Ferric Reducing Antioxidant Power) según el método de Oyaizu (Citation1986) y se calculó de acuerdo a la ecuación siguiente:
Donde:
Absm = Absorbancia de la muestra
Absb = Absorbancia del blanco
Capacidad inhibitoria de La ECA-I
Se determinó la actividad inhibitoria de la enzima convertidora de angiotensina (ECA-I) de acuerdo con lo descrito por Hayakari, Kondo, and Izumi (Citation1978), en el cual la ECA hidroliza la Hipuril-L-Histidil-L-Leucina (HHL) hasta producir ácido hipúrico y His-Leu. Este método se basa en la reacción colorimétrica del ácido hipúrico con TT (2,4,6-tricloro-triazina). La mezcla de incubación que contenía buffer de fosfato de potasio (40 mM y pH 8,3), solución de cloruro de sodio (300 mM) y HHL (3 g/100 mL) y se trabajó con una solución 100 mU/mL de la enzima. La mezcla se incubó a 37ºC durante 45 min, terminando la reacción al agregar TT en dioxano (3 g/100 mL) y buffer de fosfato de potasio (0,2 M, pH 8,3). La mezcla fue centrifugada a 10 000 g/10 min. La actividad enzimática fue determinada en el sobrenadante y medida por la absorbancia a 382 nm (Perkin Elmer Lambda XLS). Las muestras se analizaron a una concentración de proteína de 0.3 mg/mL. El porcentaje de actividad para cada muestra se calculó de la siguiente manera
Donde A es la absorbancia de la muestra, B es la absorbancia del control y C es la absorbancia del blanco.
Análisis estadístico
Cada ensayo de extracción, cuantificación y caracterización de los componentes se realizó por triplicado. Se llevó a cabo un análisis de varianza unifactorial (ANOVA), mediante la prueba de Tukey HSD. El nivel de significancia de las diferencias se definió como p <0,05. El análisis estadístico se realizó con el software MInitab 17.
Resultados y discusiones
Contenido de proteína en harina, aislado, albúminas y globulinas de I. paterno
Como era de esperarse, API mostró el mayor contenido de proteína de las muestras evaluadas (), la concentración fue superior a la que se ha reportado para aislados de garbanzo (Paredes-López, Ordorica-Falomir, & Olivares-Vázquez, Citation1991), lenteja y frijol (Qayyum, Butt, Anjum, & Nawaz, Citation2012) con 85, 80 y 53 % de proteína, respectivamente, obtenidos por precipitación isoeléctrica a partir de harina desengrasada, esto puede deberse a que la adición de sales de amonio aumenta la fuerza iónica durante la precipitación, mejorando la extracción. A los API, siguieron en concentración GI y AI obtenidas a partir de HDI, cuya proporción proteica se encontró en el intervalo reportado para otras leguminosas (20–40%) (Deshphande & Deshpande, Citation1991).
Solubilidad en agua de Las proteínas de I. paterno
La solubilidad de una proteína depende del tipo de aminoácidos que contenga y en consecuencia, de la cantidad de residuos hidrofilicos que presente, además, es un indicador para considerar la incorporación de aislados proteicos a sistemas alimentarios, así como para conocer el grado de desnaturalización de la proteína por tratamientos físicos y químicos (Badui Dergal, Citation2006).
Los resultados obtenidos mostraron que la solubilidad de las proteínas de I. paterno estuvo influenciada por el pH () con un comportamiento similar al reportado para proteínas de cacahuate (Yu, Ahmedna, & Goktepe, Citation2007) y Lupinus campestris (Rodríguez-Ambriz et al., Citation2005).
Las GI presentaron valores de solubilidad similares a los reportados para la misma fracción de frijol rojo (84%) (Meng & Ma, Citation2002) y algarrobo africano (62%) (Lawal, Adebowale, Ogunsanwo, Sosanwo, & Bankole, Citation2005). Mientras que las AI presentaron solubilidad entre 22,7–35,6%, con diferencia estadísticamente significativa (p < 0,05) debido al pH, menor a la reportada para albúminas de Ginkgo biloba (70%) (Deng et al., Citation2011) y algarrobo africano (65%) (Lawal et al., Citation2005).
La solubilidad de API fue mayor que en HDI, comportamiento similar al observado para proteínas de otras fuentes, donde los aislados mostraron mejor solubilidad que las harinas (Mao & Hua, Citation2012; Ogunwolu et al., Citation2009), debido probablemente a la mayor interacción proteína-disolvente (Singh, Kaur, & Sandhu, Citation2005). Además, el máximo valor de solubilidad de API fue similar a lo reportado para aislados proteicos de cacahuate (60,5%) (Yu et al., Citation2007) y soya (71,7%) (Molina Ortiz & Wagner, Citation2002) y superior a los de ajonjolí (33%) (Khalid, Babiker, & El Tinay, Citation2003) y frijol caupí (32%) (Ragab, Babiker, & Eltinay, Citation2004).
En general, la solubilidad aumentó de forma proporcional al aumentó de pH, similar a lo obtenido por (Sze‐Tao & Sathe, Citation2000); sin embargo, las GI presentaron un valor máximo de solubilidad a pH ácido (pH = 2), por lo que podrían ser una opción prometedora para el uso en bebidas ácidas.
El efecto del pH en la solubilidad de las proteínas es útil para conocer el punto isoeléctrico. Partiendo desde valores de pH ácidos, la solubilidad disminuye a medida que el pH va aumentando, hasta que alcanza el punto isoeléctrico, debido a la pérdida de fuerzas de repulsión electrostáticas, lo que proporciona condiciones favorables para la formación de agregados proteicos, la alta densidad aparente y el gran diámetro de los agregados resultan en la precipitación de la proteína, mientras que las fuerzas electrostáticas de repulsión entre las proteínas con carga positiva ayudan a mantenerlas separadas y aumentar las interacciones proteína-solvente y por tanto la solubilidad a valores de pH básicos (Singh et al., Citation2005). El perfil de solubilidad se emplea como una guía para determinar la funcionalidad de proteínas de diversas fuentes, pues se relaciona directamente con propiedades como la capacidad para formar emulsiones, espumas y geles (Molina, Papadopoulou, & Ledward, Citation2001; Molina Ortiz & Wagner, Citation2002).
Los datos obtenidos sugieren la posibilidad del uso de API y GI en alimentos en condiciones tanto ácidas como básicas.
Propiedades emulsionantes de Las proteínas de I. paterno
Los resultados de CE y EE en un intervalo de pH de 2 a 10 se muestran en la . HDI. HDI, API y AI presentaron valores bajos de CE entre 1–8,4% ()), menores a los reportados para harina de quinchoncho (44%) (García, Mazzarri Aiello, & Chirino Peña, Citation2012), aislado proteico de frijol mungo (41%) (Butt & Batool, Citation2010).
Por otro lado, las GI mostraron los valores superiores. Este comportamiento puede deberse a la diferencia en la concentración de proteína, ya que, a baja concentración, la adsorción de proteínas en la interfase aceite-agua es controlada por difusión, que se extiende sobre la superficie antes de que pueda ser adsorbido. A alta concentración, la barrera de energía de activación no permite que la migración de las proteínas se lleve a cabo de una manera dependiente de la difusión (Sze‐Tao & Sathe, Citation2000). Sin embargo, los valores de CE exhibidos por GI estuvieron por debajo de lo reportado para globulinas de semillas de G. biloba (48,9–60,9%) (Deng et al., Citation2011).
Con respecto a CE, ésta estuvo influenciada por el pH, siendo favorecida cuando el medio es alcalinizado. En la interfase aceite-agua, la proteína orienta los residuos lipófilos a la fase oleosa y los residuos hidrófilos a la fase acuosa, reduciendo así la tensión superficial en la interfase. Teóricamente, un aumento de la solubilidad de la proteína facilita la interacción entre las fases oleosa y acuosa (Wu, Wang, Ma, & Ren, Citation2009). La dependencia de CE respecto al pH (), se debe al efecto de éste sobre el equilibrio hidrófilo-lipófilo (Sathe, Deshpande, & Salunkhe, Citation1982), principalmente mediante la alteración de la distribución de carga en las moléculas de proteína (Hailing & Walstra, Citation1981). Una baja CE es resultado de la disminución de fuerzas hidrófobas de atracción en condiciones alcalinas, propiciando el aumento de la carga neta de la proteína, permitiendo que la proteína se difunda más rápidamente a la interfaz aire-agua (Aluko & Yada, Citation1995); no obstante, se observó una menor CE para API y las fracciones a pH 2; mientras que los mejores valores fueron a pH 10 en el caso de HDI y las fracciones, en el que también presentaron una elevada solubilidad en agua.
El pH tuvo también efecto sobre la EE; sin embargo, es de resaltar que a pesar de la baja CE las emulsiones presentaron estabilidades con valores altos de entre 44,6–100% ()), superiores a los reportados para el aislado proteico de frijol mungo (21%) (Butt & Batool, Citation2010) y de la harina de frijol (40%) (Ahmed, Ahmed, Eltayeb, Ahmed, & Babiker, Citation2011). La estabilidad podría estar dada por una baja interacción entre las gotas emulsionadas debido a la carga neta de las proteínas (Chavan, McKenzie, & Shahidi, Citation2001). La estabilidad que presentaron las emulsiones es una cualidad que puede aprovecharse en la formulación de alimentos que así lo requieran.
Propiedades espumantes de Las proteínas de inga
Los efectos del pH en FC y FS de HDI, API, AI y GI se muestran en la . API, mostró buena solubilidad en agua, con los valores superiores de FC, seguido de AI, GI y HDI, con una estabilidad de 20,8, 25, 29,2, 17,9%, respectivamente, esto en condiciones básicas, excepto las AI que presentaron su máximo valor en pH = 6. La solubilidad de las proteínas es requisito para lograr una mejor capacidad de formación de espuma y estabilidad de la misma (Deng et al., Citation2011).
Se ha reportado que las albúminas, globulinas y harina desgrasada de frijol han mostrado FC por encima de 65% (Lawal et al., Citation2005); mientras que valores de 84,6, 53,8 y 42,4% se reportaron para albúminas, aislado proteico y globulinas obtenidas de G. biloba, respectivamente, en condiciones básicas (pH entre 8 y 9) (Deng et al., Citation2011). El aislado proteico de soya ha mostrado FC de 41,8% con FS de 93% (Boye, Zare, & Pletch, Citation2010).
Los resultados obtenidos para HDI pudieron ser influenciados por la presencia de otros compuestos que también tienen capacidad de formar espuma y son solubles en agua como lo son las saponinas (Birk & Peri, Citation1980).
El aumento de la viscosidad debido a una mayor solubilidad de las proteínas, facilita la formación de una película multicapa proteica cohesiva en la superficie de contacto, propiciando mayor FC (Boye et al., Citation2010); sin embargo, se ha mostrado que no siempre ocurre de esta forma, pues se tienen reportes de que la FC disminuyó cuando la concentración proteica de albúminas de frijol aumentó (Lawal et al., Citation2005). Además, los lípidos a concentraciones superiores de 0,5% propician que las propiedades espumantes de las proteínas se muestren notablemente deterioradas, debido a que los lípidos poseen una superficie más activa que las proteínas, por lo que son fácilmente adsorbidos en la interfase aire-agua, inhibiendo la adsorción de proteínas durante la formación de la espuma (Hermannson, Citation1973; Lawal et al., Citation2005).
FC y FS estuvieron influenciadas por el pH. Valores más altos de FC a pHs alcalinos podría deberse a un aumento en la carga neta de la proteína que debilita la interacción hidrófoba, incrementando la solubilidad de la proteína, permitiendo que se extienda a la interfaz aire-agua más rápidamente, encapsulando las partículas de aire y aumentando así la formación de espuma (Chau, Cheung, & Wong, Citation1997; Lawal et al., Citation2005).
En general, las propiedades espumantes de las proteínas de paterno estuvieron por debajo de lo reportado para proteínas de otras fuentes. La adición de NaCl y el aumento de temperatura contribuye a la mejora de las propiedades espumantes de proteínas (Tian, Citation1998).
Capacidad de absorción de aceite y agua
Los resultados de CAG y CAA se muestran en la . La mayor CAG la tuvo GI, seguida de API, AI y HDI. La CAG de GI estuvo por encima de lo reportado para la misma fracción de semillas de G. biloba (2,56 mL/g), pero por debajo del valor obtenido para las albúminas de esta fuente (9,3 mL/g) (Deng et al., Citation2011). Por otra parte, HDI presentó una baja CAG comparada con la harina de semillas de quinchoncho (2,04 mL/g) (García et al., Citation2012). Mientras que API estuvo por encima de lo reportado para los aislados proteicos de semillas de G. biloba (Deng et al., Citation2011), nuez de castilla (Mao & Hua, Citation2012), Brassica carinata (Pedroche et al., Citation2004), garbanzo (Paredes-López et al., Citation1991) y ajonjolí (Khalid et al., Citation2003) (2,95, 2,81, 2,17, 1,7 y 1,5 mL/g, respectivamente) y es comparable con la de aislado comercial de soya (3,29 mL/g) y el concentrado proteico de frijol (4,01 mL/g) (Sánchez-Vioque, Clemente, Vioque, Bautista, & Millán, Citation1999; Sathe et al., Citation1982).
Las diferencias en los valores obtenidos de CAG de paterno, pueden deberse a sus características conformacionales, hidrofobicidad de la superficie, presencia de grupos lipófilos y de aminoácidos no polares en las muestras que presentaron mayor capacidad de absorción de aceite o a la posible desnaturalización parcial de las proteínas durante la extracción, originando la exposición de grupos hidrófobos de aminoácidos. Además de la presencia de cadenas laterales no polares que pueden unirse a las cadenas hidrocarbonadas de lípidos, resultando en una mayor absorción de aceite (Sathe et al., Citation1982). Así mismo, la hidrofobicidad y alto contenido de proteína favorecen la CAG (El Nasri & El Tinay, Citation2007). La CAG de las proteínas de las semillas de paterno podría ser aprovechada en la industria alimentaria para la formulación de sustitutos de carne y extensores, productos de panadería y formulación de otros alimentos, como sopas.
La CAA () sólo se reporta para AI y API, debido a que tanto HDI como GI se suspendieron en el disolvente en las condiciones del ensayo. La CAA de API (0,8 mL/g) estuvo por debajo de lo reportado para el aislado comercial de soya, el cual presenta un valor más de cuatro veces mayor (3,55 mL/g) (Zhu et al., Citation2010).
Por otro lado, las AI presentaron una CAA mayor a la de las albúminas de semillas de G. biloba (0,41 mL/g) y fue similar al de las globulinas de estás misma fuente (1,51 mL/g) (Deng et al., Citation2011). La CAA de las proteínas es una función de varios parámetros, incluyendo tamaño, forma, factores estéricos, características conformacionales y balance hidrófilo–hidrofóbico de los aminoácidos en las moléculas de proteína; así como la presencia de lípidos, y taninos asociados a proteínas. Los carbohidratos pueden mejorar esta propiedad (Jitngarmkusol, Hongsuwankul, & Tananuwong, Citation2008). Las proteínas de paterno en las condiciones de estudio no presentaron en general una buena CAA comparadas con las proteínas de otras fuentes; sin embargo, la capacidad de las muestras de suspenderse en agua podría ser aprovechada.
Tabla 1. Contenido proteico de Harina desgrasada (HDI), Aislado proteico (API), Albuminas (AI) y Globulinas (GI) de Inga paterno.
Table 1. Protein content of defatted flour (HDI), protein isolate (API), Albumins (AI) and Globulins (GI) from Inga paterno.
Tabla 2. Capacidad de absorción de agua y grasa de Harina desgrasada (HDI), Aislado proteico (API), Albuminas (AI) y Globulinas (GI) de Inga paterno.
Table 2. Water and fat absorption capacities of defatted flour (HDI), protein isolate (API), albumins (AI) and globulins (GI) from Inga paterno.
Poder reductor de hierro (FRAP)
Además de aportar aminoácidos necesarios para el desarrollo y mantenimiento de células y tejidos y presentar propiedades tecnofuncionales importantes, es conocida la capacidad de las proteínas de leguminosas de actuar frente a ciertos padecimientos mediante sus propiedades antioxidantes (Gallegos Tintoré, Chel Guerrero, & Martínez Ayala, Citation2013). Por lo anterior, se evaluó FRAP en las muestras proteicas de paterno.
Se ha indicado que la capacidad de captación de radicales libres y el poder reductor están relacionadas (Li, Jiang, Zhang, Mu, & Liu, Citation2008), sin embargo, pese a que las muestras de semillas de I. paterno no mostraron actividad de captación de radicales DPPH ni actividad quelante de cobre (resultados no mostrados), si presentaron FRAP ().
FRAP evalúa la capacidad reductora por transferencia de electrones. La propiedad de donar electrones, indica que los compuestos que la presentan podrían reducir intermediarios generados durante los procesos de peroxidación lipídica, retardando la propagación de la cadena de oxidación de los radicales libres (Klompong et al., Citation2009).
Las cuatro muestras presentaron FRAP, siendo la fracción AI la que presenta los mejores valores más elevados, mientras API mostró los valores más bajos. Cabe señalar que la concentración proteica máxima en este estudio fue 0,3 mg/ml, obteniéndose valores máximos de 31,35%. Además de las proteínas, la presencia de otros compuestos incide sobre el FRAP, pues al analizarse los productos de hidrólisis del aislado proteico de trigo sarraceno, la actividad antioxidante se atribuyó a que las proteínas fueron ricas en compuestos polifenólicos (Tang, Peng, Zhen, & Chen, Citation2009).
Si bien el poder reductor para las muestras de paterno estuvo por debajo del 50%, esta propiedad podría verse mejorada con la hidrólisis proteica; pues se ha relacionado con el tamaño molecular, aumentado el poder reductor cuando el PM es menor (Herrera Chalé et al., Citation2014); sin embargo, es importante sentar el antecedente de que presentan esta propiedad.
Capacidad inhibitoria de La ECA-I
Se ha dado a conocer ampliamente la capacidad de inhibición de la ECA-I de las proteínas vegetales, específicamente de las provenientes de leguminosas (Torruco-Uco et al., Citation2008), por lo que fue analizada la capacidad inhibitoria de esta enzima de los productos proteicos de paterno. El interés en la propiedad de inhibición de ECA-I es debido a su importancia en la regulación de la presión arterial (Skeggs, Kahn, & Shumway, Citation1956). Se trata de una proteasa que cataliza la degradación del péptido vasodilatador bradiquina y también hidroliza el decapéptido angiotensina-I para producir el octapéptido angiotensina-II, un potente vasoconstrictor implicado en la secreción de aldosterona y la retención de sodio y agua (Ruiz Ruiz, Segura Campos, Betancur Ancona, & Chel Guerrero, Citation2013).
Como puede observarse (), las fracciones AI y GI no mostraron actividad inhibitoria, mientras que HDI presentó el valor más elevado, seguido de API, lo que podría deberse a que las proteínas que confieren esta actividad están en las fracciones prolaminas y glutelinas, las cuales no fueron analizadas. Se ha reportado la capacidad de inhibición de ECA-I para hidrolizados de leguminosas (Pedroche et al., Citation2002), por lo que la hidrólisis podría favorecer esta actividad biológica en las proteínas de paterno, ya que la gran mayoría de los péptidos reportados con actividad inhibitoria de la ECA-I contienen de 2 a 15 residuos de aminoácidos (Li, Le, Liu, & Shi, Citation2005).
Tabla 3. Poder reductor de hierro y Capacidad inhibitoria de la ECA-I de Harina desgrasada (HDI), Aislado proteico (API), Albuminas (AI) y Globulinas (GI) de Inga paterno.
Table 3. Ferric reducing power and ACE-I inhibitory activity of defatted flour (HDI), protein isolate (API), albumins (AI) and globulins (GI) from Inga paterno.
Conclusiones
La evaluación de las propiedades tecnológicas y biológicas de las proteínas de Inga paterno permitio observar que aunque los valores de capacidad emuslionante fueron bajos, estos podrían potenciarse si se combinan con otras proteínas, aprovechando la estabilidad que estas presentan. Por otro lado, estas proteínas no funcionarian como factor importante en la capacidad espumante, ya que los valores tanto de capacidad como de estabilidad fueron bajos. Sin embargo, esta información nos muestra las posibilidades que una leguminosa de poco uso puede tener en la alimentación para uso directo o en la formulación de los mismos.
Con respecto a la actividad biológica, aunque los valores son menores a los mostrados por otras leguminosas, existen alternativas tecnológicas como la hidrolisis enzimática, química o biológica como la germinación, que podrían potencializar estas propiedades al obtener péptidos bioactivos
Conflicto de intereses
Los autores manifestamos que estamos de acuerdo en la publicación de estos resultado en la CyTA – Journal Food y que no existe ningún conflicto potencial de interés.
Agradecimientos
Esta investigación fue apoyada por el Consejo Nacional de Ciencia y Tecnología de México (CONACyT) y por el Instituto Politécnico Nacional, a través de becas a la alumna Sánchez Mendoza N.A. (Becario 281962).
Additional information
Funding
References
- Aguilar-Raymundo, V.G., & Vélez-Ruiz, J.F. (2013). Propiedades nutricionales y funcionales del garbanzo. (Cicer arietinum L.). Temas Selectos De Ingeniería De Alimentos, 7(2), 25–34.
- Ahmed, S.H., Ahmed, I.A.M., Eltayeb, M.M., Ahmed, S.O., & Babiker, E.E. (2011). Functional properties of selected legumes flours as influenced by pH. Journal of Agricultural Technology, 7, 1291–1302.
- Aluko, R., & Yada, R. (1995). Structure-function relationships of cowpea (Vigna unguiculata) globulin isolate: Influence of pH and NaCl on physicochemical and functional properties. Food Chemistry, 53(3), 259–265. doi:10.1016/0308-8146(95)93931-G
- AOAC. (2000). official method of analysis (17th ed.). Washington, D. C.: United States of America: Association of Official Analytical Chemists.
- Badui Dergal, S. (2006). Química de los alimentos (4ª Edicion.). México: Ed Person.
- Birk, Y., & Peri, I. (1980). Saponins. In I.E. Liener (Ed.), Toxic constituents of plant foodstuffs (pp. 161–182). New Yok and London: Academic Press.
- Boye, J., Zare, F., & Pletch, A. (2010). Pulse proteins: Processing, characterization, functional properties and applications in food and feed. Food Research International, 43(2), 414–431. doi:10.1016/j.foodres.2009.09.003
- Bradford, M.M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1), 248–254. doi:10.1016/0003-2697(76)90527-3
- Butt, M.S., & Batool, R. (2010). Nutritional and functional properties of some promising legumes protein isolates. Pakistan Journal of Nutrition, 9(4), 373–379. doi:10.3923/pjn.2010.373.379
- Chau, C.-F., Cheung, P.C.K., & Wong, Y.-S. (1997). Functional properties of protein concentrates from three chinese indigenous legume seeds. Journal of Agricultural and Food Chemistry, 45(7), 2500–2503. doi:10.1021/jf970047c
- Chavan, U.D., McKenzie, D.B., & Shahidi, F. (2001). Functional properties of protein isolates from beach pea (Lathyrus maritimus L.). Food Chemistry, 74(2), 177–187. doi:10.1016/S0308-8146(01)00123-6
- Deng, Q., Wang, L., Wei, F., Xie, B., Huang, F., Huang, W., et al. (2011). Functional properties of protein isolates, globulin and albumin extracted from Ginkgo biloba seeds. Food Chemistry, 124(4), 1458–1465. doi:10.1016/j.foodchem.2010.07.108
- Deshphande, U.S., & Deshpande, S.S. (1991). Legumes. In D.K. Salunkhe & S.S. Deshpande (Eds.), Foods of plant origin: Production, Technology and human Nutrition (pp. 137–300). New York, NY: Van Nostrand Reinhold.
- El Nasri, N.A., & El Tinay, A.H. (2007). Functional properties of fenugreek (Trigonella foenum graecum) protein concentrate. Food Chemistry, 103(2), 582–589. doi:10.1016/j.foodchem.2006.09.003
- Gallegos Tintorè, S. M., Chel-Guerrero, L. A., Corzo Rios, L. J., & Martìnez Ayala, A. L. (2013). Peptidos bioactivos de proteínas vegetales. En Maira Segura Campos, Luis Chel Guerrero, David Betancur Ancona (Eds.), Bioactividad de péptidos derivados de proteínas alimentarias (pp. 111–122). Yucatán Mex: OmniaScience.
- García, O., Mazzarri Aiello, C., & Chirino Peña, M. (2012). Caracterización físico-química y propiedades funcionales de la harina obtenida de granos de quinchoncho (Cajanus cajan (L.) Millsp.) sometidos a diferentes procesamientos. Revista Científica UDO Agrícola, 12(4), 919–928.
- Hailing, P.J., & Walstra, P. (1981). Protein‐stabilized foams and emulsions. Critical Reviews in Food Science & Nutrition, 15(2), 155–203. doi:10.1080/10408398109527315
- Hayakari, M., Kondo, Y., & Izumi, H. (1978). A rapid and simple spectrophotometric assay of angiotensin-converting enzyme. Analytical Biochemistry, 84(2), 361–369. doi:10.1016/0003-2697(78)90053-2
- Hermannson, A. (1973). Determination of functional properties of food proteins. London: Academic Press.
- Herrera Chalé, F.G., Ruiz Ruiz, J.C., Acevedo Fernández, J.J., Betancur Ancona, D.A., & Segura Campos, M.R. (2014). ACE inhibitory, hypotensive and antioxidant peptide fractions from Mucuna pruriens proteins. Process Biochemistry, 49(10), 1691–1698. doi:10.1016/j.procbio.2014.06.021
- Hojilla-Evangelista, M.P., Evangelista, R.L., & Victor, W.Y. (2009). Characterization of milkweed (Asclepias spp.) seed proteins. Industrial Crops and Products, 29(2–3), 275–280. doi:10.1016/j.indcrop.2008.05.013
- Jitngarmkusol, S., Hongsuwankul, J., & Tananuwong, K. (2008). Chemical compositions, functional properties, and microstructure of defatted macadamia flours. Food Chemistry, 110(1), 23–30. doi:10.1016/j.foodchem.2008.01.050
- Khalid, E.K., Babiker, E.E., & El Tinay, A.H. (2003). Solubility and functional properties of sesame seed proteins as influenced by pH and/or salt concentration. Food Chemistry, 82(3), 361–366. doi:10.1016/S0308-8146(02)00555-1
- Klompong, V., Benjakul, S., Yachai, M., Visessanguan, W., Shahidi, F., & Hayes, K. (2009). Amino acid composition and antioxidative peptides from protein hydrolysates of yellow stripe trevally (Selaroides leptolepis). Journal of Food Science, 74(2), C126–C133. doi:10.1111/jfds.2009.74.issue-2
- Lawal, O.S., Adebowale, K.O., Ogunsanwo, B.M., Sosanwo, O.A., & Bankole, S.A. (2005). On the functional properties of globulin and albumin protein fractions and flours of African locust bean (Parkia biglobossa). Food Chemistry, 92(4), 681–691. doi:10.1016/j.foodchem.2004.08.043
- Li, G.H., Le, G.W., Liu, H., & Shi, Y.H. (2005). Mung-bean protein hydrolysates obtained with alcalase exhibit angiotensin I-converting enzyme inhibitory activity. Food Science and Technology International, 11(4), 281–287. doi:10.1177/1082013205056781
- Li, Y., Jiang, B., Zhang, T., Mu, W., & Liu, J. (2008). Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH). Food Chemistry, 106(2), 444–450. doi:10.1016/j.foodchem.2007.04.067
- Lin, C., & Zayas, J. (1987). Functionality of defatted corn germ proteins in a model system: Fat binding capacity and water retention. Journal of Food Science, 52(5), 1308–1311. doi:10.1111/jfds.1987.52.issue-5
- Mao, X., & Hua, Y. (2012). Composition, structure and functional properties of protein concentrates and isolates produced from walnut (Juglans regia L.). International Journal of Molecular Sciences, 13(2), 1561–1581. doi:10.3390/ijms13021561
- Meng, G., & Ma, C.-Y. (2002). Characterization of globulin from Phaseolus angularis (red bean). International Journal of Food Science & Technology, 37(6), 687–695. doi:10.1046/j.1365-2621.2002.00601.x
- Molina, E., Papadopoulou, A., & Ledward, D.A. (2001). Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins. Food Hydrocolloids, 15(3), 263–269. doi:10.1016/S0268-005X(01)00023-6
- Molina Ortiz, S.E., & Wagner, J.R. (2002). Hydrolysates of native and modified soy protein isolates: Structural characteristics, solubility and foaming properties. Food Research International, 35(6), 511–518. doi:10.1016/S0963-9969(01)00149-1
- Navarrete-Tindall, N., & Aragon, H. (2002). Inga paterno harms. In: J. A. Vozzo (Ed.), Tropical tree seed manual: Part II, species descriptions. Agriculture Handbook (pp. 523–525). Washington, DC: Department of Agriculture (USDA), Forest Service.
- Ogunwolu, S.O., Henshaw, F.O., Mock, H.-P., Santros, A., & Awonorin, S.O. (2009). Functional properties of protein concentrates and isolates produced from cashew (Anacardium occidentale L.) nut. Food Chemistry, 115(3), 852–858. doi:10.1016/j.foodchem.2009.01.011
- Osborne, T.B., & Mendel, L.B. (1914). Nutritive properties of proteins of the maize kernel. Journal of Biological Chemistry, 18, 1–16.
- Oyaizu, M. (1986). Studies on products of browning reaction–antioxidative activities of products of browning reaction prepared from glucosamine. Eiyogaku Zasshi= Japanese Journal of Nutrition, 44, 307–315. doi:10.5264/eiyogakuzashi.44.307
- Paredes-López, O., Ordorica-Falomir, C., & Olivares-Vázquez, M.R. (1991). Chickpea protein isolates: Physicochemical, functional and nutritional characterization. Journal of Food Science, 56(3), 726–729. doi:10.1111/j.1365-2621.1991.tb05367.x
- Pedroche, J., Yust, M.M., Girón‐Calle, J., Alaiz, M., Millán, F., & Vioque, J. (2002). Utilisation of chickpea protein isolates for production of peptides with angiotensin I‐converting enzyme (ACE)‐inhibitory activity. Journal of the Science of Food and Agriculture, 82(9), 960–965. doi:10.1002/jsfa.v82:9
- Pedroche, J., Yust, M.M., Lqari, H., Girón-Calle, J., Alaiz, M., Vioque, J., et al. (2004). Brassica carinata protein isolates: Chemical composition, protein characterization and improvement of functional properties by protein hydrolysis. Food Chemistry, 88(3), 337–346. doi:10.1016/j.foodchem.2004.01.045
- Qayyum, M., Butt, M., Anjum, F., & Nawaz, H. (2012). Composition analysis of some selected legumes for protein isolates recovery. The Journal of Animal and Plant Sciences, 22(4), 1156–1162.
- Ragab, D.M., Babiker, E.E., & Eltinay, A.H. (2004). Fractionation, solubility and functional properties of cowpea (Vigna unguiculata) proteins as affected by pH and/or salt concentration. Food Chemistry, 84(2), 207–212. doi:10.1016/S0308-8146(03)00203-6
- Rakashanda, S., Mubashir, S., Qurishi, Y., Hamid, A., Masood, A., & Amin, S. (2013). Trypsin inhibitors from Lavatera cashmeriana Camb. seeds: Isolation, characterization and in-vitro cytoxicity activity. International Journal of Pharmaceutical Science Invention, 2(5), 55–65.
- Rodríguez-Ambriz, S.L., Martínez-Ayala, A.L., Millán, F., & Dávila-Ortíz, G. (2005). Composition and functional properties of lupinus campestris protein isolates. Plant Foods for Human Nutrition, 60(3), 99–107. doi:10.1007/s11130-005-6835-z
- Ruiz Ruiz, J., Segura Campos, M., Betancur Ancona, D., & Chel Guerrero, L. (2013). Proteínas y péptidos biológicamente activos con potencial nutracéutico. In M.S. Campos, L.C. Guerrero, & D.B. Ancona (Eds.), Bioactividad de péptidos derivados de proteínas alimentarias (pp. 11–27). Barcelona: OmniaScience.
- Ruiz-Carrera, V., Peña-López, E., Lau-Vázquez, S., Maldonado-Mares, F., Ascencio-Rivera, J., & Guadarrama-Olivera, M. (2004). Macronutrimentos de fitorrecursos alimenticios de especies aprovechadas por grupos étnicos en Tabasco, México. Universidad Y Ciencia Número Especial, 1, 27–31.
- Rutherfurd-Markwick, K.J., & Moughan, P.J. (2005). Bioactive peptides derived from food. Journal of AOAC International, 88(3), 955–966.
- Sánchez-Vioque, R., Clemente, A., Vioque, J., Bautista, J., & Millán, F. (1999). Protein isolates from chickpea (Cicer arietinum L.): Chemical composition, functional properties and protein characterization. Food Chemistry, 64(2), 237–243. doi:10.1016/S0308-8146(98)00133-2
- Sathe, S.K., Deshpande, S.S., & Salunkhe, D.K. (1982). Functional properties of lupin seed (Lupinus mutabilis) proteins and protein concentrates. Journal of Food Science, 47(2), 491–497. doi:10.1111/j.1365-2621.1982.tb10110.x
- Singh, N., Kaur, M., & Sandhu, K.S. (2005). Physicochemical and functional properties of freeze-dried and oven dried corn gluten meals. Drying Technology, 23(4), 975–988. doi:10.1081/drt-200054253
- Skeggs, L.T., Kahn, J.R., & Shumway, N.P. (1956). The preparation and function of the hypertensin-converting enzyme. The Journal of Experimental Medicine, 103(3), 295–299. doi:10.1084/jem.103.3.295
- Sze-Tao, K.W.C., & Sathe, S.K. (2000). Functional properties and in vitro digestibility of almond (Prunus dulcis L.) protein isolate. Food Chemistry, 69(2), 153–160. doi:10.1016/S0308-8146(99)00244-7
- Sze‐Tao, K.W.C., & Sathe, S.K. (2000). Walnuts (Juglans regia L): Proximate composition, protein solubility, protein amino acid composition and protein in vitro digestibility. Journal of the Science of Food and Agriculture, 80(9), 1393–1401. doi:10.1002/1097-0010(200007)80:9<1393::AID-JSFA653>3.0.CO;2-F
- Tang, C.-H., Peng, J., Zhen, D.-W., & Chen, Z. (2009). Physicochemical and antioxidant properties of buckwheat (Fagopyrum esculentum Moench) protein hydrolysates. Food Chemistry, 115(2), 672–678. doi:10.1016/j.foodchem.2008.12.068
- Tian, S. (1998). The isolation, modification and evaluation of field pea proteins and their applications in foods. (PhD thesis) Victoria University of Technology. Retrieved from http://vuir.vu.edu.au/id/eprint/15713
- Torruco-Uco, J., Domínguez-Magaña, M., Davila-Ortiz, G., Martínez-Ayala, A., Chel-Guerrero, L., & Betancur-Ancona, D. (2008). Péptidos antihipertensivos, una alternativa de tratamiento de origen natural: Una revisión/Antihypertensive peptides, an alternative for treatment of natural origin: A review. CYTA – Journal of Food, 6(2), 158–168.
- Wu, H., Wang, Q., Ma, T., & Ren, J. (2009). Comparative studies on the functional properties of various protein concentrate preparations of peanut protein. Food Research International, 42(3), 343–348. doi:10.1016/j.foodres.2008.12.006
- Yu, J., Ahmedna, M., & Goktepe, I. (2007). Peanut protein concentrate: Production and functional properties as affected by processing. Food Chemistry, 103(1), 121–129. doi:10.1016/j.foodchem.2006.08.012
- Zhu, K.-X., Sun, X.-H., Chen, Z.-C., Peng, W., Qian, H.-F., & Zhou, H.-M. (2010). Comparison of functional properties and secondary structures of defatted wheat germ proteins separated by reverse micelles and alkaline extraction and isoelectric precipitation. Food Chemistry, 123(4), 1163–1169. doi:10.1016/j.foodchem.2010.05.081
- Zia-Ul-Haq, M., Iqbal, S., Ahmad, S., Imran, M., Niaz, A., & Bhanger, M.I. (2007). Nutritional and compositional study of Desi chickpea (Cicer arietinum L.) cultivars grown in Punjab, Pakistan. Food Chemistry, 105(4), 1357–1363. doi:10.1016/j.foodchem.2007.05.004
