Figures & data
Table 1. Substrate specificity of peach PPO.
Tabla 1. Especificidad de la PPO de durazno.
Figure 1. Chemical structures of substrates and inhibitors used in this study. (a) catechol; (b) 4-methyl catechol; (c) chlorogenic acid; (d) 4-hexylresorcinol; (e) β-cyclodextrin.
Figura 1. Estructuras químicas de sustratos e inhibidores utilizados en este trabajo. (a) catecol; (b) 4-metil catecol; (c) ácido clorogénico; (d) 4-hexilresorcinol; (e) β-ciclodextrina.
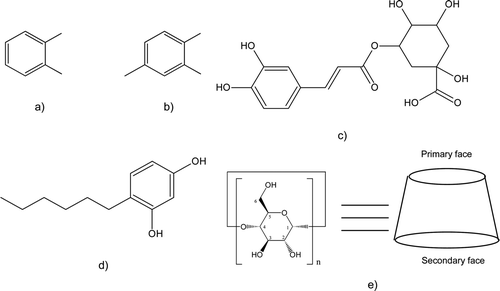
Figure 2. Inhibition of peach PPO by 4-hexylresorcinol (0.5 mM). Enzyme activity was measured spectroscopically (λ = 400 nm, pH 5, 25 °C, 12 μg/mL protein) in the presence of different substrate concentrations and a fixed 4HR concentration. (A) Inhibition of catechol oxidation. (B) Inhibition of 4-methyl catechol oxidation. (C) Inhibition of chlorogenic acid oxidation. Symbols are mean ± SEM of four determinations, lines are non-linear fits to experimental data. *indicates statistical differences from control (T-test, p < 0.05).
Figura 2. Inhibición de la PPO de durazno por 4-hexilresorcinol (0,5 mM). La actividad enzimática se determinó espectrofotométricamente (λ = 400 nm, pH 5, 25 °C, 12 μg/mL de proteína) en presencia de diferentes concentraciones de sustrato y una concentración constante de 4HR. (A) Inhibición de la oxidación del catecol. (B) Inhibición de la oxidación del 4-metil catecol. (C) Inhibición de la oxidación del ácido clorogénico. Los símbolos representan la media ± ESM de 4 experimentos, las líneas son ajustes no lineales a los datos experimentales. *indica diferencias significativas con respecto al control (prueba T, p < 0,05).
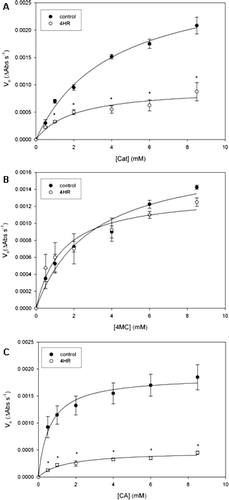
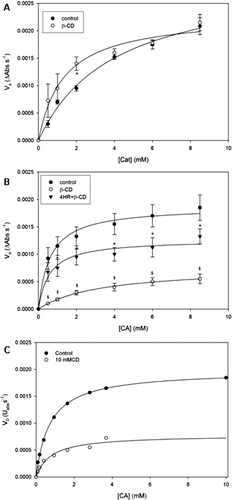
Figure 3. Inhibition of peach PPO by β-cyclodextrin (10 mM). Enzyme activity was measured spectroscopically (λ = 400 nm, pH 5, 25 °C, 12 μg/mL protein) in the presence of different substrate concentrations and fixed inhibitor concentrations. (A) Inhibition of catechol oxidation. (B) Inhibition of chlorogenic acid oxidation by β-CD and a mixture of β-CD and 4HR. Symbols are mean ± SEM of four determinations, lines are non-linear fits to experimental data. *indicates statistical differences from control; $indicates statistical differences from control and from β-CD + 4HR (LSD, p < 0.05). (C) Inhibition of free-CA oxidation by β-CD; free-CA concentrations were calculated from the stability constant of the β-CD/CA complex and the initial CA concentrations used in the experiment of figure 3B. Initial velocities in the presence of β-CD are the same as in figure 3B; initial control velocities were calculated from the non-linear fit to control data in figure 3B.
Figura 3. Inhibición de la PPO de durazno por β-ciclodextrina (10 mM). La actividad enzimática se determinó espectrofotométricamente (λ = 400 nm, pH 5, 25 °C, 12 μg/mL de proteína) en presencia de diferentes concentraciones de sustrato y una concentración constante de 4HR. (A) Inhibición de la oxidación del catecol. (B) Inhibición de la oxidación del ácido clorogénico oxidation por β-CD y mezcla de β-CD y 4HR. Los símbolos representan la media ± ESM de 4 experimentos, las líneas son ajustes no lineales a los datos experimentales. *indica diferencias significativas con respecto al control; $indica diferencia significativa con respecto al tratamiento β-CD + 4HR (DMS, p < 0,05). (C) Inhibición de la oxidación del CA libre por β-CD; las concentraciones de CA libre se calcularon mediante la constante de estabilidad del complejo β-CD/CA y las concentraciones iniciales de CA utilizadas en el experimento de la figura 3B. Los datos de velocidades iniciales en presencia de β-CD son los mismos que en la figura 3B; los datos de velocidades iniciales control fueron calculados a partir del ajuste no lineal a los datos control de la figura 3B.