Figures & data
Table 1. Exopeptidase activity of Theobroma cacao towards various chromogenic substrates1.
Tabla 1. Actividad exopeptidasa de Theobroma cacao frente a varios sustratos cromogénicos1.
Table 2. Effect of inhibitors on the exopeptidase activity of Theobroma cacao L1.
Tabla 2. Efecto de inhibidores sobre la actividad exopeptidase de Theobroma cacao L1.
Table 3. Effect of various inhibitors on peptidase activity of different sources.
Tabla 3. Efecto de diversos inhibidores sobre la actividad peptidasa de diferentes orígenes.
Table 4. Effect of divalent cations and sodium ion on exopeptidase activity of Theobroma cacao L1.
Tabla 4. Efecto de cationes divalentes e ion sodio sobre la actividad exopeptidasa de Theobroma cacao L1.
Figure 1. Effect of temperature on size distribution of interactions (protein–cation) by DLS in the enzymatic extract with Ba2+, Zn2+, Cu2+, Co2+, Cd2+, Mg2+, Ca2+ and Na1+ at 1 mM: (a) 25°C, (b) 40°C, (c) 60°C + (insert: CuCl2 1 mM), (d) 80°C + (insert: CdCl2 1 mM).
Figura 1. Análisis mediante DLS del efecto de la temperatura sobre la distribución de tamaño de interacciones (proteína-catión) en el extracto enzimático con Ba2+, Zn2+, Cu2+, Co2+, Cd2+, Mg2+, Ca2+ y Na1+ at 1 mM (a) 25°C,(b) 40°C, (c) 60°C + (inserto: CuCl2 1 mM), (d) 80°C + (inserto: CdCl2 1 mM).
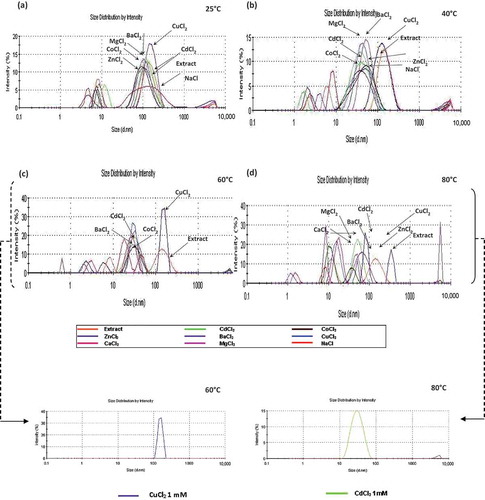
Figure 2. Effect of temperature on size distribution of interactions (protein–cation) by DLS in the enzymatic extract: (a) Cu2+ at 25, 30, 40, 50 and 60°C; (b) Cd2+ at 25, 30, 40, 50, 60, 70 and 80°C.
Figura 2. Análisis mediante DLS del efecto de la temperatura sobre la distribución de tamaño de interacciones (proteína-catión) en el extracto enzimático (a) Cu2+at 25, 30, 40, 50 y 60°C (b) Cd2+ at 25, 30, 40, 50, 60, 70 y 80°C.
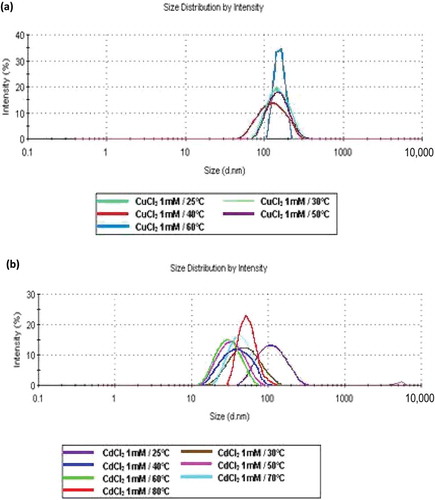
Figure 3. Effect of temperature on enzymatic activity of Xaa-Prolyl dipeptidyl aminopeptidase (Xaa-Pro-DAP2). (a) Control: Xaa-Pro-DAP2 activity without cations in the enzyme extract. (b) Xaa-Pro-DAP2 activity in the enzyme extract in the presence of CoCl2 at a concentration of 1 mM. (c) Xaa-Pro-DAP2 activity in the enzyme extract in the presence of CdCl2 at concentration of 1.0 mM. Mean values are connected by a line, bars represent standard deviations (n = 3).
Figura 3. Efecto de la temperatura sobre la actividad enzimática de Xaa-Prolyl dipeptidyl aminopeptidase (Xaa-Pro-DAP2). (a) Control: Actividad de Xaa-Pro-DAP2 en el extracto enzimático en ausencia de cationes (b) Actividad de Xaa-Pro-DAP2 en el extracto enzimático en presencia de CoCl2 a 1 mM y (c) Actividad de Xaa-Pro-DAP2 en el extracto enzimático en presencia de CdCl2 a 1.0 mM. Los valores de las medias están unidos por una línea, las barras representan la desviación standard (n = 3).
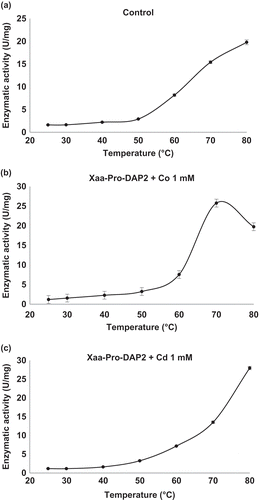
Figure 4. Effect of temperature on enzymatic activity of aminopeptidase (APE) in the enzymatic extract. (a) Control: APE activity without cations. (b) APE activity in the presence of CoCl2 at a concentration of 1 mM. (c) APE activity in the presence of CdCl2 at a concentration of 1.0 mM. Mean values are connected by a line, bars represent standard deviations (n = 3).
Figura 4. Efecto de la temperatura sobre la actividad enzimática de aminopeptidasa (APE) en el extracto enzimático. (a) Control: Actividad APE en ausencia de cationes; (b) Actividad APE activity en presencia de CoCl2 a 1 mM y (c) Actividad APE en presencia de CdCl2 a 1.0 mM. Los valores de las medias están unidos por una línea, las barras representan la desviación standard (n = 3).
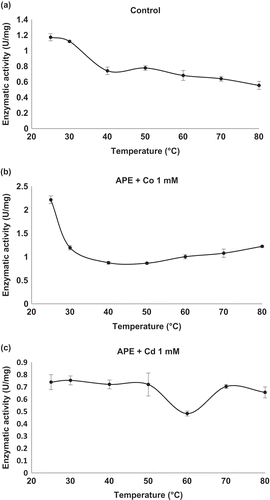
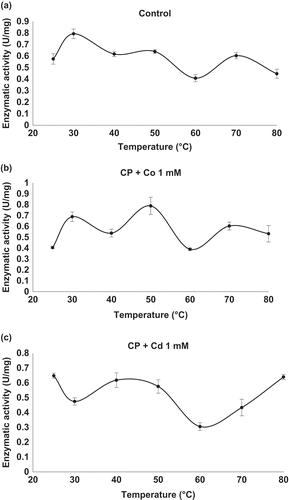
Figure 5. Effect of temperature on enzymatic activity of carboxypeptidase (CP). (a) Control: CP activity without cations in the enzyme extract. (b) CP activity in the enzyme extract in the presence of CoCl2 at a concentration of 1 mM. (c) CP activity in the enzyme extract in the presence of CdCl2 at a concentration of 1.0 mM. Mean values are connected by a line, bars represent standard deviations (n = 3).
Figura 5. Efecto de la temperatura sobre la actividad enzimática de carboxipeptidasa (CP) en el extracto enzimático. (a) Control: Actividad de CP en ausencia de cationes; (b) actividad de CP en presencia de CoCl2 a 1 mM and (c) actividad CP en presencia de CdCl2 a 1.0 mM. Los valores de las medias están unidos por una línea, las barras representan la desviación standard (n = 3).