Abstract
Collagen from the swim bladder of sturgeon has been historically used to precipitate polyphenols in wine. However, little is known about the wine polyphenol precipitation potential of protein from other fishes. Consequently, the objective of this study was to evaluate the polyphenol precipitation potential of collagen extracted from other fish (Rocot, Sebastes sp. and Curvina, Atractoscion nobilis). There were no differences in the complexation time between wine polyphenols and clarifying proteins. However, collagen from fishes from Baja California was more effective in precipitating wine polyphenols than ovalbumin or sturgeon swim bladder collagen. The polyphenol precipitation was specific to the protein added to the wine. The addition of Baja California fish collagen did not change the biochemical structure (pH, total acidity, volatile acidity, and free and total sulfur dioxide) of the clarified wine.
El colágeno de vejiga natatoria de esturión se ha utilizado históricamente para reducir la concentración de polifenoles durante la producción de vinos de mesa. Sin embargo, se desconoce si proteínas provenientes de otros peces pueden ser utilizadas como agentes precipitantes de polifenoles en vinos. Por lo anterior, el objetivo de este estudio fue el de evaluar la precipitación de polifenoles utilizando colágeno de otros peces (Rocot; Sebastes sp. y Curvina; Atractoscion nobilis). No se observaron diferencias en el tiempo de complejamiento de polifenoles del vino y las proteínas clarificantes. Sin embargo, el colágeno de peces de Baja California fue más efectivo para precipitar los polifenoles de vino tinto que la ovoalbúmina o el colágeno de vejiga natatoria de esturión. La concentración de polifenoles clarificados fue específica de la proteína añadida al vino. La adición de colágeno no alteró las características bioquímicas (pH, acidez titulable, acidez volátil) del vino clarificado.
Keywords:
Palabras clave:
1. Introducción
Los polifenoles proveen astringencia y cuerpo a los vinos, especialmente a los vinos tintos. Estos polifenoles están compuestos principalmente de subunidades de catequina, epicatequina y epigalocatequina (Harbertson et al., Citation2008). La concentración de estos polifenoles en el vino generalmente fluctúa entre 50 y 6000 mg L−1 y su concentración depende de la variedad y maduración de la uva utilizada durante el proceso de vinificación, el tiempo y temperatura de maceración, el tipo de polifenol, etc. (Hanlin & Downey, Citation2009; Waterhouse & Teissedre, Citation1997). Durante el proceso de maceración, los polifenoles de la piel de la uva son generalmente extraídos en los primeros siete días de maceración, sin embargo, los polifenoles de las semillas de la uva son liberados por más de 60 días (Boulton, Singleton, Bisson, & Kunkee, Citation1998).
No obstante que los polifenoles proveen estructura y cuerpo a los vinos, altas concentraciones de polifenoles hacen que los vinos sean percibidos amargos y/o astringentes (Kennedy, Ferrier, Harbertson, & Peyrot Des Gachons, Citation2006). Por lo anterior, altos niveles de polifenoles totales son eliminados (clarificados) para producir vinos menos amargos y menos astringentes (Boulton et al., Citation1998). La astringencia de los vinos es definida como una sensación amargor, y una sensación de resequedad de la lengua debido al encogimiento y secado del epitelio de la cavidad bucal como resultado a la exposición de polifenoles (Kennedy et al., Citation2006). En los vinos, la astringencia es causada por los polifenoles que son extraídos de las semillas y las pieles de las uvas, así como por los polifenoles extraídos de la madera de las barricas (Singleton & Trousdale, Citation1992). Los polifenoles de las uvas son flavonoides poliméricos en donde las sub-unidades monoméricas están compuestas de flavan-3-ols. El anillo β de la unidad monomérica puede tener diferentes patrones de hidroxilación y generar una gran diversidad de polifenoles. Entre ellos, procianidinas derivadas de epicatequina y prodelifinidinas (consistentes de epigalocatequina) han sido reportadas en las uvas (Cheynier, Rigaud, & Silva, Citation1992). Mientras que los polifenoles de las semillas de uva están compuestos enteramente de procianidinas, las pieles de las uvas contienen tanto procianidinas y prodelfinidinas (Cheynier et al., Citation2006).
La práctica de utilizar proteínas para clarificar y reducir la astringencia y el color de los vinos tintos es ampliamente aceptada en la industria vitivinícola. La clarificación depende de la adsorción de los polifenoles cargados negativamente sobre los agentes clarificantes cargados positivamente (Boulton et al., Citation1998). La naturaleza catiónica de las proteínas está determinada por su punto isoeléctrico (pI) y el pH del vino en el que se encuentran. La mayoría de las proteínas tienen valores de pI superior al pH del vino (aprox. 3.5) y en consecuencia mantienen cargas electrostáticas positivas si son añadidas al vino (Santoro, Citation1995). Debido a su naturaleza electrostática positiva, las proteínas son añadidas al vino para adsorber y precipitar polifenoles cargados negativamente en un proceso llamado clarificación (Hahn & Possmann, Citation1977; Marchal et al., Citation2002). Estas proteínas adsorben polifenoles y forman agregados que se precipitan al fondo de los tanques de clarificación y/o barricas, y posteriormente son eliminados por decantación. Históricamente la ovoalbúmina y el colágeno de vejiga natatoria de esturión (isinglass) han sido utilizados como proteínas precipitantes de polifenoles de vino (Boulton et al., Citation1998). Sin embargo, no se han realizado estudios para evaluar el uso del colágeno de otros peces como agentes precipitantes. El costo del colágeno de esturión es extremadamente alto en relación a otros clarificantes enológicos (ovalbúmina, gelatina, quitina, etc.), debido a que su producción está limitada a países de Europa del Este, y debido a que el cultivo y la captura de este pez se han reducido en los últimos años. Sin embargo, la vejiga natatoria y la piel de otros peces también están formadas de colágeno (Giraud-Guillea, Besseaua, Chopinb, Durandb, & Herbagec, Citation2000) por lo que podrían presentar la misma capacidad de precipitación de polifenoles. En Baja California se desperdicia una gran cantidad de colágeno de piel de pescado como subproductos de la industria pesquera y además es el principal productor de vino de mesa en el país. En consecuencia, el objetivo de este estudio fue el de evaluar el potencial de precipitación de polifenoles de vino tinto utilizando colágeno de la piel y vejiga natatoria de peces de Baja California.
2. Materiales y métodos
Muestras de tejido de piel y vejiga natatoria de Rocot (Sebastes sp.) y Curvina (Atractoscion nobilis) fueron obtenidas como productos de desecho de plantas de procesamiento de pescado en Ensenada, Baja California. Las muestras fueron lavadas en agua destilada, el exceso de grasa fue eliminado manualmente y las muestras fueron deshidratadas a 40°C hasta obtener peso constante. El tejido deshidratado fue pulverizado en un molino de navajas de acero inoxidable con un tamiz de 1 mm. Como control del proceso de clarificación se utilizó ovoalbúmina (Sigma, EE. UU.) y colágeno de vejiga natatoria de esturión (isinglass, Scott Laboratories, EE. UU.).
2.1. Polifenoles y proteínas en el vino
La concentración de polifenoles totales en el vino se determinó colorimétricamente (Iland, Bruer, Edwards, Weeks, & Wilkes, Citation2004). Muestras de 10 µl se diluyeron en 1 mL de agua destilada, se les añadió 100 µL del reactivo de Folin-Cicalteau (Sigma, EE. UU.) y se incubaron a temperatura ambiente por 5 min. Posteriormente se añadió 300 µL de Na2HCO3 al 20% (v/w) y se incubaron las muestras a 40°C por 30 min. La absorbancia de las muestras fue evaluada por espectrofotometría (Shimadzu, UV-1800, EE. UU.) a 765 nm utilizando una celda de cuarzo de 1 cm. La concentración específica de polifenoles totales se determinó después de generar una curva estándar utilizando ácido gálico como control (0 – 100 mg L−1).
La concentración de proteína añadida a cada uno de los tratamientos se evaluó colorimétricamente utilizando el método descrito por Bradford (Citation1976). Muestras de 5 µl se diluyeron en 1 mL de agua destilada, se les añadió 300 µl de reactivo de Bradford y se incubaron a temperatura ambiente por 30 min. La absorbancia de las muestras fue evaluada por espectrofotometría a 595 nm utilizando una celda de cuarzo de 1 cm. La concentración específica de proteínas se determinó después de generar una curva estándar (0 – 1 mg mL−1) utilizando albúmina de suero bovino como control.
2.2. Características bioquímicas del vino
La densidad de color y tono del vino se determinó espectrofotometricamente utilizando una celda de cuarzo de 1 mm evaluando la absorbancia a 420, 520, 620 nm. La densidad de color del vino se estimó sumando la absorbancia de 420, 520 y 620 nm, mientras que el tono se estimó dividiendo la absorbancia de 420 nm entre la de 520 nm (Iland et al., Citation2004). El pH del vino fue evaluado potenciometricamente mientras que la acidez titulable se determinó mediante una titulación con NaOH 0.1 M hasta un pH 8.2 (Iland et al., Citation2004). La acidez volátil del vino se determinó con un destilador “Cash” y la concentración de sulfitos libres y sulfitos totales se estimó utilizando el método de aspiración-oxidación de acuerdo a Iland et al. (Citation2004).
2.3. Separación de polifenoles
Los distintos polifenoles en el vino tinto y el vino tinto clarificado fueron evaluados mediante cromatografía líquida de alta resolución (HPLC). Muestras de vino (250 μL, capacidad de muestra fija) fueron inyectadas en un cromatógrafo (HP 1090, EE. UU.) con una columna C18 (Nucleosil 5 µm, 4.6 X 250 mm, Supelco, EE. UU.) y un detector UV-visible de matriz de diodos. La separación de los polifenoles se obtuvo mediante un gradiente de una disolución A compuesta de 50 µM fosfato de amonio (pH 2.6), una disolución B compuesta de 20% de la disolución A (v/v) y 80% (v/v) acetonitrilo, y una disolución C con 0.2 M de ácido fosfórico (pH 1.5). El gradiente de elución consistió en 100% A por 5 min, 96% A y 4% B a 25 min, 8% B 92% C a 45 min, 30% B 70% C a 50 min, 40% B 60% C a 55 y 100% A a 60 min. El flujo se mantuvo constante durante todo el gradiente a 1 mL min−1. Los polifenoles fueron detectados a una longitud de onda de 280 nm. La exactitud del método se determinó utilizando estándares internos y la concentración relativa de los compuestos se determinó integrando el área bajo el pico del cromatograma de cada uno de los analitos.
2.4. Electroforesis de proteínas
La composición proteica de la ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión fue determinada mediante una electroforesis desnaturalizante de gel de poliacrilamida (SDS-PAGE, (Harlow & Lane, Citation1998)). Las diferentes muestras de colágeno fueron disueltas en una disolución 0.15 M de NaCl a 37°C. Las disoluciones conteniendo las muestras de proteína fueron desnaturalizadas por 3 min a 95°C en una disolución conteniendo 125 mM Tris pH 6.8, 20% (v/v) glicerol, 10% (v/v) 2-mercaptoetanol, 4% (p/v) SDS y 0.0025% (p/v) azul de bromofenol. Muestras de 2 µg se cargaron en un gel de poliacrilamida (17.5%) y revelados con azul de coomasie (Swain & Ross, Citation1995). La masa molecular de las proteínas en el vino fue estimada de su migración relativa con respecto a estándares (Rainbow MW-Standars, Bio-Rad, EE. UU.).
Para determinar el tiempo de complejación de los polifenoles del vino con las proteínas, se añadió 100 mg L−1 de ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión a vino tinto conteniendo aproximadamente 2.2 mg L−1 de polifenoles totales. Las muestras fueron agitadas en un agitador rotativo a 18 rpm y se tomaron muestras entre 0 y 680 min. Las muestras fueron posteriormente centrifugadas a 1,600 x g durante 10 min y la concentración de polifenoles se determinó de acuerdo a la metodología descrita anteriormente. El efecto de la concentración de proteínas sobre la precipitación de polifenoles se determinó añadiendo 0 – 15 mg L−1 de ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión a vino tinto conteniendo aproximadamente 2.2 mg L−1 de polifenoles totales. Las muestras fueron agitadas en un agitador rotativo a 18 rpm por 1 h, fueron posteriormente centrifugadas a 1,600 x g durante 10 min y la concentración de polifenoles se determinó de acuerdo a la metodología descrita anteriormente.
Para estimar el efecto de la ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión sobre los polifenoles específicos del vino, se añadió 100 mg L−1 de proteína a vino por triplicado y se incubó por 1 h en un agitador rotativo como se describió anteriormente. Las muestras fueron centrifugadas y se analizaron por cromatografía líquida de alta resolución como se describió anteriormente.
2.5. Análisis estadístico
El efecto de la concentración de colágeno de los diferentes peces y tejido sobre la concentración de polifenoles totales del vino y el tiempo de precipitación fueron evaluados mediante un análisis de varianza de una vía (Sokal & Rohlf, Citation1995). Comparaciones múltiples se realizaron mediante una prueba Tukey utilizando un nivel de significancia de p < 0.05. El efecto de la clarificación sobre el pH, acidez volátil, sulfitos libres y totales se estimó mediante pruebas t-Student (Sokal & Rohlf, Citation1995).
3. Resultados y discusión
El proceso de clarificación es un proceso común en las vinícolas para reducir los niveles de algunos compuestos del vino. Este proceso es generalmente definido como la adición de un compuesto adsorbente que facilita la precipitación de compuestos parcialmente solubles en el vino (Boulton et al., Citation1998). Una de las propiedades más importantes de los polifenoles es su habilidad para complejarse con proteínas. En particular, la clarificación utilizando proteínas se utiliza para suavizar y reducir la astringencia de un vino. Las proteínas más utilizadas para la clarificación de los vinos en la industria vinícola generalmente son la caseína, la albúmina y la gelatina. Aunque estas proteínas se han utilizado para la precipitación general de polifenoles, existen muy pocos estudios que demuestren una precipitación específica de los polifenoles en relación a las proteínas utilizadas como agente clarificante.
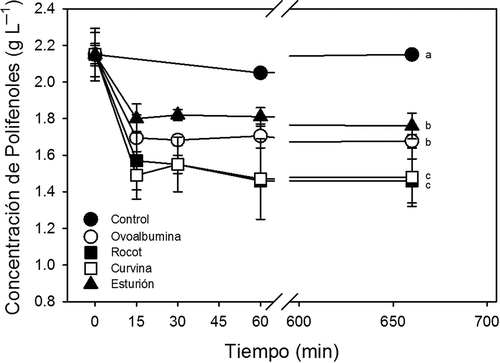
En este estudio no se observaron diferencias en el tiempo de complejamiento de polifenoles del vino al utilizar diferentes proteínas clarificantes (). El uso colágeno de piel de rocot, de piel de curvina, de vejiga natatoria esturión y ovoalbúmina (100 mg L−1) precipitó aproximadamente el 20% de los polifenoles del vino tinto. La precipitación de polifenoles de vino tinto utilizando proteínas de origen vegetal generan precipitaciones similares a las observadas en nuestro experimento (Maury, Sarni-Manchado, Lefebvre, Cheynier, & Moutounet, Citation2003). Sin embargo, a diferencia de otros estudios en donde se han realizado incubaciones de aproximadamente 48 h (Cosme, Ricardo-da-Silva, & Laureano, Citation2009; Marchal et al., Citation2002; Sarni-Machado, Deleris, Avallone, Cheynier, & Moutounet, Citation1999), los polifenoles del vino en este estudio fueron precipitados en incubaciones menores de 15 min. Los resultados de nuestro estudio sugieren que la interacción entre colágeno de peces y polifenoles finaliza en minutos, y probablemente solo esté limitada por el tiempo de mezcla y por la tasa de precipitación del complejo polifenol-proteína en los tanques de clarificación y/o barricas de añejamiento.
Figura 1. Precipitación de polifenoles en relación al tiempo de incubación utilizando 100 mg L−1 de ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión. Símbolos representan promedios (n = 5) y barras desviaciones estándar. Letras diferentes indican diferencias significativas entre tratamientos. Barras no mostradas son más pequeñas que los símbolos.
Figure 1. Precipitation of polyphenols relative to incubation time using 100 mg L–1 of ovalbumin, rocot skin collagen, curvina skin collagen and sturgeon swim-bladder collagen. Symbols represent the means (n = 5) and bars the standard deviations. Different letters indicate significant differences between treatments. Bars not shown are smaller than the symbols.
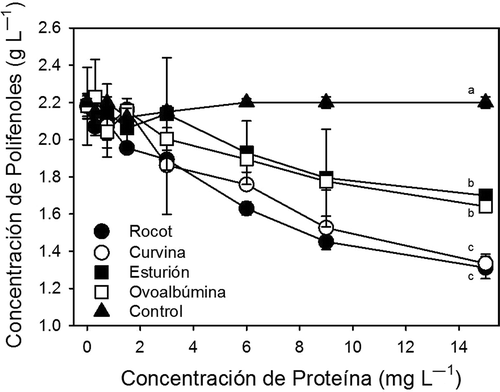
Se ha demostrado que las proteínas añadidas al vino interactúan con los polifenoles formando agregados que se precipitan en los tanques de clarificación y/o en las barricas (Marchal et al., Citation2002). En este estudio se observó que al incrementarse la concentración de proteínas en el vino, aumenta la concentración de polifenoles precipitados (). El incremento de la precipitación de polifenoles al aumentar la concentración de proteínas es consistente con lo observado en otros estudios (Sims, Eastridge, & Bates, Citation1995). Sin embargo, en este estudio se observa claramente que existen diferencias en las concentraciones de precipitación de polifenoles en relación al tipo de proteína utilizado. La precipitación de polifenoles utilizando colágeno de rocot y curvina (peces de Baja California), fue 20% mayor (p < 0.05) que la precipitación utilizando colágeno de esturión y ovoalbúmina. Otros estudios han mostrado diferencias en las concentraciones de precipitación de polifenoles de vino tinto al utilizar caseína y gelatina como agentes precipitantes (Sims et al., Citation1995). Estas diferencias de precipitación probablemente estén relacionadas con las diferencias de masa molecular entre las diferentes proteínas utilizadas. En este estudio se demuestra que el colágeno de peces de Baja California es más efectivo en la precipitación de polifenoles del vino en relación a otros clarificantes utilizados actualmente en la industria vinícola. Por lo anterior, el uso de colágeno de peces de Baja California resultaría en adiciones de menores concentraciones a las utilizadas en la actualidad para precipitar los polifenoles de vino tinto.
Figura 2. Precipitación de polifenoles de vino tinto utilizando colágeno de piel de rocot, colágeno de piel de curvina, colágeno de vejiga natatoria de esturión y ovoalbúmina. Símbolos representan promedios (n = 5) y barras desviaciones estándar. Letras diferentes indican diferencias significativas entre tratamientos. Barras no mostradas son más pequeñas que los símbolos.
Figure 2. Precipitation of red wine polyphenols using ovalbumin, rocot skin collagen, curvina skin collagen and sturgeon swim-bladder collagen. Symbols represent the means (n = 5) and bars the standard deviations. Different letters indicate significant differences between treatments. Bars not shown are smaller than the symbols.
Un clarificante ideal es aquel que remueve las moléculas no deseadas sin modificar el resto de las características bioquímicas y organolépticas del vino procesado. En este estudio, se eliminaron polifenoles del vino sin que se modificaran el resto de las características del vino. Al añadir el colágeno de rocot y curvina no se observaron variaciones en el pH (p > 0.05), concentración de ácidos orgánicos (acidez titulable) (p > 0.05), ácido acético (acidez volátil) (p > 0.05), sulfitos libres (p > 0.05), sulfitos totales (p > 0.05) y proteínas totales en el vino (p > 0.05). Además, no se observaron diferencias aromáticas o gustativas entre los controles y los vinos clarificados con el colágeno. La neutralidad bioquímica del colágeno de peces de Baja California durante la clarificación de vinos tintos fue similar a la observada por el colágeno y la gelatina en otros estudios (Sims et al., Citation1995). Lo anterior sugiere que tanto el colágeno y la gelatina utilizada para suavizar y eliminar astringencia de los vinos nacionales podría ser sustituido por el colágeno extraído de la piel o la vejiga natatoria de peces, sin cambiar las características organolépticas del vino.
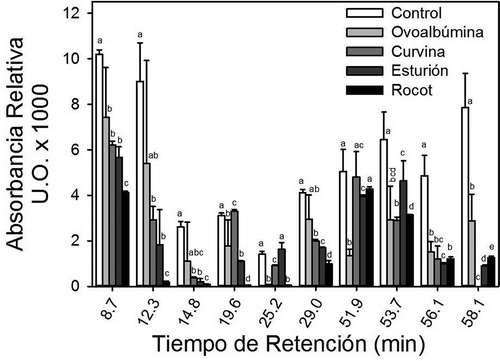
Algunos estudios han mostrado que las proteínas del vino presentan una interacción específica y una capacidad de precipitación de polifenoles condensados específica dependiendo de la proteína añadida (Cosme et al., Citation2009; Maury et al., Citation2003). Las muestras de vino tinto clarificadas en este estudio con colágeno de piel de curvina, colágeno de piel de rocot, colágeno de vejiga natatoria de esturión y ovoalbúmina terminaron con diferentes concentraciones y tipos de polifenoles (). En todos los casos, la concentración de polifenoles específicos fue mayor o igual en el control (vino sin clarificar) que en los vinos clarificados con ovoalbúmina o colágeno de peces. La cromatografía líquida de alta resolución mostró una alta concentración de ácido gálico (retención 8.7 min) en todas las muestras y el resto de los polifenoles en menor concentración relativa. El ácido gálico es un monómero que forma la base de una gran cantidad de polifenoles acomplejados por lo que generalmente se encuentra en altas concentraciones en el vino (Cheynier et al., Citation2006). La concentración de ácido gálico precipitado por el colágeno de piel de rocot fue significativamente mayor (p < 0.05) que la precipitada por la ovoalbúmina. Los polifenoles condensados presentaron máximas concentraciones a los 12.3 (ácido protocatéquico), 14.8 (procianidina B1), 19.6 (procianidina B2), 25.2 (ácido vanílico), 29 (no identificado) min (entre otros) en todos los vinos tintos clarificados. Al igual que la precipitación del ácido gálico, la precipitación de los polifenoles condensados varió en relación a la proteína utilizada como clarificante. El colágeno de piel de rocot, por ejemplo, precipito la totalildad de la procianidina B2 (retención 19.6 min) del vino, mientras que la ovoalbúmina y el colágeno de vejiga natatoria de esturión precipitaron aproximadamente el 50% de este polifenol. En contraste a la precipitación obtenida con estas proteínas, el colágeno de piel de curvina no precipitó procianidina B2 del vino. Por otro lado, los flavonoides presentaron máximas concentraciones a los 51.9 (resveratrol), 53.7 (quercitina), 56.1 (no identificado), 58.1 (no identificado) min (entre otros). Al igual que otros polifenoles, la precipitación de flavonoides varió en relación a la proteína utilizada en la clarificación. No obstante que los tipos y concentraciones de los polifenoles en vinos tintos analizados en este estudio fueron similares a los observados en otros estudios (Lamuela-Raventos & Waterhouse, Citation1994), la gran diversidad de polifenoles condensados encontrados en el vino se debe en gran medida al amplio rango de tamaños de polímeros en las semillas (hasta 30 grados de polimerización, DP) y las pieles (hasta 80 DP) de las uvas (Cheynier et al., Citation2006). Lo anterior sugiere que las diferentes proteínas tienen una afinidad específica sobre ciertos grupos o tipos de polifenoles.
Figura 3. Concentración relativa de polifenoles de vino tinto después de una clarificación con ovoalbúmina, colágeno de piel de curvina, colágeno de piel de rocot y colágeno de vejiga natatoria de esturión. Ácido gálico (8.7 min), ácido protocatéquico (12.3 min), procianidina B1 (14.8 min), procianidina B2 (19.6 min), ácido vanílico (25.2 min), no identificado (29.0 min), resveratrol (51.9 min), quercitina (53.7 min), no identificado (56.1), no identificado (58.1 min). Letras diferentes indican diferencias significativas entre tratamientos. Barras representan promedios (n = 5) y líneas desviaciones estándar.
Figure 3. Relative concentration of red wine polyphenols after clarification with ovalbumin, rocot skin collagen, curvina skin collagen and sturgeon swim-bladder collagen. Gallic acid (8.7 min), protocatechuic acid (12.3 min), procyanidin B1 (14.8 min), procyanidin B2 (19.6 min), vanillic acid (25.2 min), not identified (29.0 min), resveratrol (51.9 min), quercetin (53.7 min), not identified (56.1), not identified (58.1 min). Different letters indicate significant differences between treatments. Bars represent the means (n = 5) and lines represent the standard deviations.
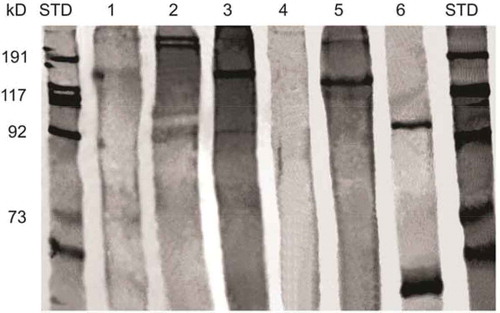
Las proteínas extraídas de un tejido animal o vegetal están compuestas de una serie de polipéptidos de diferentes pesos moleculares y diferentes cargas electrostáticas (Maury et al., Citation2003). Los resultados de este estudio coinciden con trabajos previos en donde se muestra que los polipéptidos de colágeno de diferentes tejidos y animales presentan diferentes masas moleculares (). Hasta la fecha se han detectado aproximadamente 29 tipos de colágeno que varían dependiendo del tejido y del organismo que lo produzca. En este estudio, la electroforesis desnaturalizante del colágeno de diferente tejido y diferentes peces mostró diferencias en la masa molecular de los polipéptidos del colágeno. El colágeno de piel y vejiga natatoria de rocot y curvina mostraron en su mayoría polipéptidos con masa molecular mayor a los 100 kD. Por otro lado la ovoalbúmina y el colágeno de vejiga natatoria de esturión mostró una masa molecular de aproximadamente 45 kD. Las diferencias en la masa molecular del colágeno es probablemente el resultado del diferente origen genético de cada uno de estos colágenos. Por otro lado, el vino tinto sin clarificar no presentó proteínas disueltas lo que demuestra que los polifenoles del vino precipitan totalmente las proteínas del vino. Es posible que las diferencias de precipitación de polifenoles del vino en este experimento sea el resultado de las diferencias de masa molecular entre los diferentes colágenos y ovoalbúmina utilizados. Debido a que los polifenoles proveen estructura y características organolépticas al vino, el uso de proteínas específicas podría proveer un carácter organoléptico específico al vino. Por lo anterior, el uso de colágeno de peces de Baja California en los vinos nacionales podría impartir una estructura y unas características organolépticas únicas.
Figura 4. Electroforesis de proteínas extraídas de la piel y vejiga natatoria de peces utilizados en la clarificación de vino tinto. STD-marcadores de masa molecular, 1-vino tinto (control), 2-piel rocot, 3-vejiga natatoria rocot, 4-vejiga natatoria esturión, 5-piel curvina, 6- ovoalbúmina.
Figure 4. Electrophoresis of proteins extracted from fish skin and swim bladder used for red wine clarification. STD-molecular mass markers, 1-red wine (control), 2-rocot skin, 3-rocot swim bladder, 4-sturgeon swim bladder, 5-curvina skin, 6-ovalbumin.
Los antocianos proveen tono y densidad de color a los vinos tintos (Boulton et al., Citation1998). Debido a su naturaleza polifenólica, los antocianos pueden ser precipitados por las proteínas durante el proceso de clarificación (Cosme et al., Citation2009). De hecho, la adición de proteínas al vino ha sido utilizado para reducir la concentración antociánica o color en el vino (Harbertson, Picciotto, & Adams, Citation2003). De acuerdo a lo observado en este estudio, la densidad de color del vino tinto disminuyó hasta en un 50% después de añadir ovoalbúmina y colágeno de peces de Baja California (). Sin embargo, el colágeno de piel de peces de Baja California fue de 10–15% más eficiente (p < 0.05) que la ovoalbúmina y el colágeno de vejiga natatoria de esturión para precipitar antocianos del vino tinto. Los resultados de este estudio sugieren que vinos tintos o vinos rosados con altos niveles de antocianos podrían ser decolorados más eficientemente con el colágeno de piel de peces de Baja California, que con las proteínas utilizadas actualmente en la industria vinícola.
Figura 5. Efecto de concentración de ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina y colágeno de vejiga natatoria de esturión sobre la densidad y tono de vino tinto. Símbolos representan promedios (n = 5), las barras de error no se muestran debido a que son más pequeñas que los símbolos. Letras diferentes indican diferencias significativas entre tratamientos.
Figure 5. Effect of the concentration of ovalbumin, rocot skin collagen, curvina skin collagen and sturgeon swim-bladder collagen on the density and tone of red wine. Symbols represent the means (n = 5). Error bars are not shown because they are smaller than the symbols. Different letters indicate significant differences between treatments.
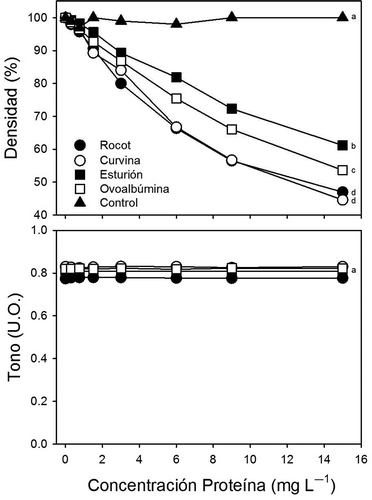
Se ha demostrado que el tono del vino generalmente no es modificado cuando se le añaden clarificantes a base de proteínas (Cosme et al., Citation2009). Al igual que estos estudios, el tono del vino no se modificó al añadir ovoalbúmina, colágeno de piel de rocot, colágeno de piel de curvina o colágeno de vejiga natatoria de esturión (). Tonos mayores de 0.7 son típicos de vinos con tonalidades altas en azules y purpuras, y bajos niveles de color naranja y café. El mantener los valores de tono altos es indispensable para mantener una apariencia del vino sin notas de oxidación. Los resultados de este experimento sugieren que la adición de colágeno extraído de peces de Baja California no alteran las características del tono del vino. Sin embargo, la densidad del color del vino si es disminuida al incrementar la concentración de proteínas añadidas.
4. Conclusiones
En este estudio demostramos que el colágeno extraído de peces de Baja California tiene una mayor afinidad por los polifenoles de vino tinto que la ovoalbúmina y el colágeno de esturión comercial. La mayor afinidad sugiere que este producto puede ser utilizado en menor cantidad para clarificar vinos. Se demuestra también que el colágeno de peces de Baja California precipita polifenoles de una manera selectiva por lo que el vino podría adquirir un carácter organoléptico particular y regionalizado. La precipitación específica de polifenoles por los diferentes colágenos es probablemente el resultado de la diversidad y variación de polipéptidos observados en los diferentes colágenos analizados en este estudio. Por otro lado, el resto de las características bioquímicas del vino (pH, acidez titulable, acidez volátil, sulfitos libres y sulfitos totales) no son alteradas al añadirse el colágeno de pescado local. Los resultados sugieren que la piel y vejiga natatoria de peces de Baja California podría ser utilizado como materia prima para la clarificación de vinos tanto a nivel nacional como a nivel mundial. Además, proveería de ingresos adicionales a los pescadores ribereños al transformar un producto sin valor (piel y vejiga natatoria) en un producto de alto valor agregado (colágeno para la clarificación de vinos).
Disclosure statement
No potential conflict of interest was reported by the authors.
Referencias
- Boulton, R., Singleton, V., Bisson, L., & Kunkee, R. (1998). Principles and practices of winemaking (pp. 604). Gaithersburg, MD: Aspen. doi:10.1007/978-1-4615-1781-8
- Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72, 248–254. doi:10.1016/0003-2697(76)90527-3
- Cheynier, V., Dueñas-Paton, M., Salas, E., Maury, C., Souquet, J., Sarni-Manchado, P., & Fulcrand, H. (2006). Structure and properties of wine pigments and tannins. American Journal of Enology and Viticulture, 57, 289–305.
- Cheynier, V., Rigaud, J., & Silva, J. (1992). Structure of procyanidins oligomers isolated from grape seeds in relation to some of their chemical properties. In M. Hemingway & P. Laks (Eds.), Plant polyphenols: Biogenesis, chemical properties and their significance (pp. 281–294). New York, NY: Plenum Press.
- Cosme, F., Ricardo-da-Silva, J., & Laureano, O. (2009). Effect of various proteins on different molecular weight proanthocyanidin fractions of red wine during wine fining. American Journal of Enology and Viticulture, 60, 74–81.
- Giraud-Guillea, M.-M., Besseaua, L., Chopinb, C., Durandb, P., & Herbagec, D. (2000). Structural aspects of fish skin collagen which forms ordered arrays via liquid crystalline states. Biomaterials, 21, 899–906. doi:10.1016/S0142-9612(99)00244-6
- Hahn, G., & Possmann, P. (1977). Colloidal silicon dioxide as a fining agent for wine. American Journal of Enology and Viticulture, 28, 108–112.
- Hanlin, R., & Downey, M. (2009). Condensed tannin accumulation and composition in skin of shiraz and cabernet sauvignon grapes during berry development. American Journal of Enology and Viticulture, 60, 13–23.
- Harbertson, J., Hodgins, R., Thurston, L., Schaffer, L., Reid, M., Landon, J., … Adams, D. (2008). Variability of tannin concentration in red wines. American Journal of Enology and Viticulture, 59, 210–214.
- Harbertson, J. F., Picciotto, E. A., & Adams, D. O. (2003). Measurement of polymeric pigments in grape berry extracts and wines using a protein precipitation assay combined with bisulfite bleaching. American Journal of Enology and Viticulture, 54, 301–306.
- Harlow, E., & Lane, D. (1998). Antibodies. A laboratory manual (pp. 726). Cold Spring Harbor: Cold Spring Harbor Laboratories. doi:10.1016/0753-3322(89)90130-3
- Iland, P., Bruer, N., Edwards, G., Weeks, S., & Wilkes, E. (2004). Chemical analysis of grapes and wine: Techniques and concepts (pp. 109). Campbelltown: Patric Iland Wine Promotions.
- Kennedy, J. A., Ferrier, J., Harbertson, J. F., & Peyrot Des Gachons, C. (2006). Analysis of tannins in red wine using multiple methods: Correlation with perceived astringency. American Journal of Enology and Viticulture, 57, 481–485.
- Lamuela-Raventos, R. M., & Waterhouse, A. L. (1994). A direct HPLC separation of wine phenolics. American Journal of Enology and Viticulture, 45, 1–5.
- Marchal, R., Marchal-Delahaut, M., Michels, F., Parmentier, M., Lallement, A., & Jeandet, P. (2002). Use of wheat gluten as clarifying agent of musts and white wines. American Journal of Enology and Viticulture, 53, 308–314.
- Maury, C., Sarni-Manchado, P., Lefebvre, S., Cheynier, V., & Moutounet, M. (2003). Influence of fining with plant proteins on proanthocyanidin composition of red wines. American Journal of Enology and Viticulture, 54, 105–111.
- Santoro, M. (1995). Fractionation and characterization of must and wine proteins. American Journal of Enology and Viticulture, 46, 250–254.
- Sarni-Machado, P., Deleris, A., Avallone, S., Cheynier, V., & Moutounet, M. (1999). Analysis and characterization of wine condensed tannins precipitated by proteins used as fining agent in enology. American Journal of Enology and Viticulture, 50, 81–86.
- Sims, C. A., Eastridge, J. S., & Bates, R. P. (1995). Changes in phenols, color and sensory characteristics of muscadine wines by pre- and post-fermentation additions of PVPP, casein and gelatin. American Journal of Enology and Viticulture, 46, 155–158.
- Singleton, V., & Trousdale, E. (1992). Anthocyanin-tannin interactions explaining differences in polymeric phenols between white and red wines. American Journal of Enology and Viticulture, 43, 63–70.
- Sokal, R. R., & Rohlf, F. J. (1995). Biometry (pp. 887). New York, NY: W.H. Freeman and Company. doi:10.1002/bimj.19700120319
- Swain, M., & Ross, N. W. (1995). A silver stain protocol for proteins yielding high resolution and transparent background in sodium dodecyl sulfate-polyacrylamide gels. Electrophoresis, 16, 948–951. doi:10.1002/elps.11501601159
- Waterhouse, A. L., & Teissedre, P. L. (1997). Levels of phenolics in California varietal wines. In T. C. Watkins (Ed.), Wine: Nutritional and therapeutic benefits (pp. 12–23). Washington, DC: American Chemical Society. doi:10.1021/bk-1997-0661.ch003
